冷冻电镜技术在分子植物学研究中的应用
殷国良 孙文浩 庞效云 孙飞
(1. 中国科学院生物物理研究所生物大分子国家重点实验室,北京 100101;2. 中国科学院大学,北京 100049)
1 冷冻电镜技术发展历史
光学显微镜的发明使得人们于17世纪第一次看见细胞,推动了细胞学说的建立。但由于光学显微镜的分辨能力有限,限制了对细胞内部精细结构的观察。1931年,Max Knoll和Ernst Ruska发明了世界上第一台透射电子显微镜,为人们观察细胞内部精细结构提供了可能。但在发明之初,利用电子显微镜观察生物样品存在明显的局限性:一是使用电子显微镜观察生物样品需要严格的真空环境,而真空环境会导致生物样品脱水而改变其自然状态;二是利用电子对生物样品成像时所带来的辐照损伤在一定程度上会破坏样品的自然状态。为了克服这些问题,人们自19世纪60年代以来发展出了一套生物电镜样品制备技术,通过化学固定、脱水、树脂包埋、超薄切片、重金属染色等步骤制备出适合于电子显微镜观察的生物样品,或者通过重金属负染色的方法制备出适合于电子显微镜观察的病毒颗粒、生物大分子复合体等样品,基于这些样品制备技术,人们利用电子显微镜开始观察细胞内部的超微结构,发现了诸如线粒体、叶绿体、细胞核、内质网、高尔基体等细胞器和亚细胞结构,有效推动了细胞生物学的研究。然而传统的样品制备和电镜成像方法依然无法使得人们研究接近天然状态的生物样品结构,这就是冷冻电镜技术需要解决的问题。
英国剑桥大学Richard Henderson在冷冻电镜技术的早期发展过程中起到了至关重要的作用。1975年,他与同事获得了细菌视紫红质的7Å分辨率的三维结构[1-2],这是历史上第一个膜蛋白的三维结构,并首次证明利用电子显微镜可以获得生物大分子亚纳米分辨率的结构。为达到防止真空干涸及降低电子辐照损伤的目的,Henderson与其同事在样品表面包被了葡萄糖,并建立了低剂量电子照明技术——冷冻电镜技术的重要组成部分。1990年Henderson等[3]利用冷冻电子晶体学技术解析了近原子分辨率的细菌视紫红质的三维结构,有力证明了电子显微镜在生物大分子高分辨率成像方面所具备的潜力。1981年,瑞士洛桑大学的Jacques Dubochet团队发明了快速冷冻的方法,使得病毒颗粒、生物大分子等生物样品可以通过冷冻固定保持其天然的结构状态,并用于冷冻电镜成像。他们的方法是将待观察的样品迅速冷冻于非晶态的冰中(也称玻璃态冰),既可以防止生物样品暴露在高真空状态下严重脱水,同时在低温情况下可以显著降低电子辐照损伤。在样品快速冷冻制备和冷冻电镜低剂量成像技术出现之后,第三个需要克服的问题是生物大分子冷冻电镜图像的处理、解析和三维重构。美国哥伦比亚大学乔基姆·弗兰克(Joachim Frank)和他的同事则率先针对这个问题提出了行之有效的计算处理方法,他们对同一生物大分子样品多个不同拷贝的冷冻电镜图像进行对齐和平均,以提高图像的信噪比;在获得了样品不同角度的二维图像后,再利用计算机软件对其三维重构从而得到样品的三维结构。至此,冷冻电镜单颗粒分析技术(cryo-SPA)[4]完成了样品快速冷冻玻璃态化[5]、生物样品电子辐射损伤[6-7]、蛋白质机器单颗粒图像分类分析[8]等关键技术理论的建立,从而发展成为一项研究蛋白质机器三维结构的重要手段。2017年,Richard Henderson、Jacques Dubochet和 Joachim Frank三 人由于“开发冷冻电镜,用于溶液中生物分子结构的高分辨率测定”的原创奠基性工作,共同获得了该年度的诺贝尔化学奖。
近些年来,冷冻电镜技术取得飞速发展。在样品制备方面,载网支持膜技术的完善(包括了石墨烯支持膜[9]、氧化石墨烯支持膜[10]、多晶金膜[11]、非晶镍钛合金膜[12]和疏水蛋白膜[13]等),以及新型快速冷冻技术的研发(包括VitroJet技术[14]和Spotiton技术[15]),使得冷冻样品的制备效率和质量得到显著提高,在一定程度上避免了由气液界面所带来的蛋白样品变性和取向优势问题,提升了冷冻电镜的成像质量,减少了蛋白样品的用量,可以获得更高质量和更高分辨率的生物样品三维结构。
在软硬件设备方面,具有先进电子光学系统的高稳定电子显微镜(FEI Titan Krios)、高性能直接电子探测相机(Gatan K2/K3,ThermoFisher Scientific Falcon III/IV,DE-20/64)、能量过滤器的开发与使用(ThermoFisher Scientific Selectris X)、数据采集自动化程度不断地提高(SerialEM,Leginon,EMAutomation和 UCSFImage4)、电子束倾斜(beam tilt)和电子束平移(beam-image-shift)的校正使得数据收集的效率和质量得到显著提高。在数据处理方面,高度自动化软件的开发,如RELION[16]、cryoSPARC[17]、Warp[18]等,逐渐替代了人工干预,使得冷冻电镜三维重构分辨率得到进一步提高[19]。
基于上述软硬件设备和数据处理算法的突破,2013年程亦凡与合作者利用cryo-SPA技术首次获得膜蛋白TRPV1的3.4Å结构[20],标志着冷冻电镜技术正式打开近原子分辨率结构的大门,到2020年,Yip等[21]依赖于硬件的进步(球差校正器、单色仪等)解析获得了1.25Å分辨率的脱铁铁蛋白结构,Nakane等[22]使用冷场发射枪,能量过滤器和更灵敏的直接电子探测相机获得了人膜蛋白β3GABAA受体的1.7Å分辨率的冷冻电镜结构和小鼠脱铁铁蛋白1.22Å分辨率的冷冻电镜结构,这些结构提供揭示了前所未有的结构细节。在这期间,同时有大量复杂蛋白质机器的高分辨率结构通过cryo-SPA技术得到了解析,包括酵母剪接体2.9-3.8Å的高分辨率结构[23]、非洲猪瘟病毒颗粒精细三维结构[24-25]、G蛋白偶联受体(GPCR)[26-33]、线粒体呼吸链系统中的众多膜蛋白复合体[34-36]。在新冠疫情防控中,冷冻电镜技术扮演着十分重要的角色,如新冠病毒的刺突蛋白结构[37-42]、RNA依赖的RNA聚合酶(RdRp)结构[43]均通过单颗粒分析技术迅速解析,进一步证明冷冻电镜cryo-SPA技术在生物样品精细结构解析方面的巨大潜力。
冷冻电镜技术除了可以观察溶液中的蛋白质分子,也可以对细胞、组织等复杂的生物学样品进行成像,对细胞内的各种蛋白质机器进行指认和分析,解析蛋白质机器在接近自然状态下的三维结构,这就是蛋白质分子机器的冷冻电子断层扫描(cryo-ET)技术。该技术最早由德国马普生化细胞所的Baumeister等[44]发展起来。近年来,由于各项技术的进步和突破,包括透射电镜平行光照明技术、直接电子探测技术、相位板技术[45-46]、基于直接电子探测相机的新型图像处理技术、辐射损伤补偿技术、三维图像分类处理技术以及聚焦离子束(focused ion beam,FIB)铣削技术[47-49]等,使蛋白质机器的冷冻电镜原位结构解析技术取得了进一步发展,包括细菌细胞鞭毛马达[50-53]的原位结构分析、肌动蛋白[54-55]的原位结构分析以及核孔复合物(nuclear pore complex)[56-58]的高分辨率原位结构解析。这些蛋白质机器在细胞原位的高分辨率结构解析会极大推动人们对于蛋白质机器在生理环境下结构动态的认识。
冷冻电镜技术的飞速发展也推动了生物三维电镜技术的发展和应用,这方面的介绍可以参考《生物三维电子显微成像技术展望》一书[59]。
冷冻电镜技术发展至今,其解析的结构已达17 000多个,涉及动物学、分子植物学、微生物学、细胞生物学等多个研究领域(引自https://www.ebi.ac.uk/emdb/statistics)。本文将对近年来人们利用冷冻电镜技术在植物光合作用及胁迫响应等方面进行的应用研究进行综述,以此展望未来冷冻电镜技术在分子植物学研究领域的重要应用前景。
2 冷冻电镜在光合作用分子机理研究方面的应用
光合作用是科学界公认的、地球上最重要的生化反应。植物体通过直接吸收光能,分解水释放氧气,将二氧化碳转换为碳水化合物。光合作用的分子机制十分复杂,包含光反应及暗反应两个阶段,其中涉及光能的吸收、电子的传递和能量的转化等一系列物理化学及生物化学反应。目前,光合作用的机理依然有诸多问题需探索,诸如蛋白复合体之间如何组装、相关蛋白如何捕获并吸收光能等。X-射线晶体学在植物光合作用的研究中已发挥了重要的作用[60-61],PDB数据库中通过该方法解析结构的数量也具有较高的占比(图1),为我们了解光合作用的分子机理提供了坚实的理论基础。但鉴于该方法受限于获得高质量的蛋白质结晶,极大地限制了光系统中复杂生物大分子复合体的结构解析,因此通过X-射线晶体学方法仅局限于分子量较小的光合作用相关蛋白研究,这限制了我们对光合作用分子机制的进一步探究。冷冻电镜技术的兴起与发展填补了这一缺陷,不需要结晶,能够保持样品的天然状态,为深入了解植物体的光合作用分子机制提供了新的技术手段。

图1 光合作用相关蛋白结构解析采用的手段Fig. 1 Methods used for structural analysis of photosynthesis-related proteins
在整个光合作用的过程中,各蛋白复合物之间的电子传递是其核心部分。目前冷冻电镜技术在植物光合作用领域的研究主要集中在对电子传递链中各重要组分的结构解析,以阐明光合作用的原理与机制。在所有能够进行光合作用的生物体内,都具有光系统 I(photosystem I,简称PSI)和光系统 II(photosystem II,简称PSII)两个主要组成部分。其中PSI因其能被波长为700 nm的光所激发,故也被称为P700;同理,PSII可被波长为680 nm的光激发,也被称为P680。PSI和PSII通过电子传递链连接在一起,并高度有序地排列在类囊体膜上,它们主要起到电子传递和质子传递的功能。本小节将对利用冷冻电镜技术研究光合作用相关复合体的结构与功能进行综述。
2.1 冷冻电镜在光系统I结构与功能研究中的应用
PSI复合物分子量低于PSII复合物,它仅存在于基质和基粒片层的非堆叠区域。PSI的核心复合体由反应中心色素PSI、电子受体和捕光复合体(light harvesting complex I,LHCI)所组成。关于PSI复合体的研究,冷冻电镜技术扮演着十分重要的角色(图2)。2020年,Mazor团队结合冷冻电镜技术和光谱学方法在集胞藻PCC 6803中解析了嵌合的PSI复合物结构[62],该结构具有高度保守的核心天线,由11个亚基和90多个叶绿素组成。它在红色光谱区域显示出增强的吸收值,这主要得益于捕获红光的结构位点,同时也可对光收集效率进行调节。该研究确定了光系统I复合物结构与功能的关系,以此揭示了能量传递途经的多样性。

图2 光系统I的冷冻电镜结构Fig. 2 cryo-EM structure of photosystem I
在真核藻类和高等植物中,PSI被LHCI蛋白包围,进而形成PSI-LHCI超复合体,其主要功能是将电子从质体蓝素传递至铁氧还蛋白,并将光能转化为化学能。沈建仁及隋森芳两个研究团队于2018年合作解析了红藻PSI-LHCI超复合体近原子分辨率的冷冻电镜结构[63],分辨率达3.63-3.82Å。该项研究得到的结构存在两种不同的形式,一种与高等植物相似,PSI同3个Lhcr亚基相连;另一种PSI与两个Lhcr亚基相连。此外,红藻类的PSI核心还显示出类似于蓝藻和高等植物PSI的特征,表明从原核生物向真核生物的进化过程中存在某种中间类型。该研究成果揭示了红藻区别于高等植物PSI-LHCI的独特电子传递途径,为研究其对多变环境的适应能力以及在低等植物向高等植物进化过程中PSI-LHCI的结构变化提供了新思路。2019年,Minagawa团队通过冷冻电镜技术解得莱茵衣藻的PSI-LHCI复合体冷冻电镜结构[64],该复合体包含9个LHCI。该研究同时证明相比于陆地植物,莱茵衣藻的 PSI 具有更大、更明显的外周天线组织和更高的光捕获能力。同年,李梅团队联合章新政团队利用冷冻电镜技术将莱茵衣藻的PSI-LHCI复合体结构的分辨率提高至近原子分辨率[65],相比于Minagawa团队取得的结果,该结构同时揭示了两种不同排列方式的LHCI,一种包含8个与PSI核心相关的LHCI,另一种则包含10个与PSI核心相关的LHCI,为超复合物中天线组织和色素排列提供了更加详细的信息。触角中高度密集且紧密排列的叶绿素阐明了CrPSI-LHCI中光收集和激发能转移的高效率,并为理解CrPSI-LHCI中光收集和能量转移的高效率提供了新见解。2020年,Nelson团队综合使用X射线晶体学和冷冻电镜技术从耐盐绿藻杜氏盐藻中确定了PSI-LHCI的结构[66]。该结构揭示了一种新的PSI内核配置,它仅由7个亚基组成,形成已知最小的PSI,而植物和莱茵衣藻中则为14-16个亚基。该研究为揭示PSI的组织及物种进化保守性提供了重要信息。
除PSI-LHCI复合体外,Akita团队解析了硅藻光系统 I-叶绿素a/c蛋白 I(fucoxanthin chlorophyll a/c protein I,FCPI)超复合物的 2.4Å 冷冻电镜结构[67]。该结构为硅藻PSI-FCPI的采光策略以及放氧光合生物光收集的进化动力学提供了新的见解。超级复合体由16个不同的FCPI亚基围绕单体PSI核心组成,每个FCPI亚基具有不同的色素含量和结合位点,因而呈现不同的蛋白质结构,它们与PSI核心一起形成复杂的色素-蛋白质网络,以有效地收集和转移光能。此外,研究者还在PSI核心中发现了两个独特的亚基。该结构不仅为硅藻PSI-FCPI中的光捕获策略提供了新见解,同时也为放氧光合生物中光收集器的进化动力学提供了新的结构基础。
在PSI-LHCI复合体的结构研究基础上,人们利用冷冻电镜技术对更为复杂的超级复合体结构进行研究。2018年,李梅团队联合章新政团队报道了玉米来源的光系统 I-捕光复合体 I-捕光复合体 II超级复合物的高分辨率冷冻电镜结构[68],揭示了LHCII和PSI之间的识别位点。该结构的LHCII和PSI核心内的叶绿素网络与此前的光谱结果一致,印证了LHCII三聚体作为高效光收集器的作用。同时每个亚基通过一对叶绿素分子将能量传递到PSI核心,进而揭示了PSI核心与捕光天线之间能量转移的路径。该研究弥补了过去通过X-射线晶体学方法获得的PSI结构信息的缺失,为进一步探索植物电子传递和能量转换的分子机制提供了重要的理论依据,在揭示高等植物对自然界多变光照环境适应性机理的同时,也为PSI和PSII的捕光机制及能量调节提供了新的理论依据。
2021年,中科院植物所和浙江大学合作利用冷冻电镜技术解析了大麦叶绿体PSI-NDH超分子复合物结构[69],这是首次解析获得的高等植物PSI-NDH复合体高分辨结构。该复合体由2个PSI-LHCI、1个NDH及一个未知蛋白(unidentified stromal protein,USP)组成,共包含55个蛋白亚基、298个叶绿素分子、67个类胡萝卜素分子和25个脂分子,总分子量达1.6 MD,是目前解析得到的最大的光合作用相关蛋白复合体结构。该研究揭示了NDH亚基特有的10个高等植物叶绿体的精确位置及结构特点,首次阐明高等植物PSI-LHCI-NDH相互作用及组装的机理,在填补高等植物NDH结构信息的同时,也为高等植物PSI-NDH介导光合环式电子传递的功能及调控提供了新的结构基础。
此外,冷冻电镜技术也被用于更加复杂的PSI:质体蓝蛋白(plastocyanin,PC)-铁氧还蛋白(ferredoxin,Fd)的复合结构解析[70]。该复合体中含19个亚基与Fd结合,其中包含3个β-胡萝卜素和15个脂质分子,各组分在高光胁迫下的环式电子流中发挥不同的作用。结合功能实验,进一步揭示了OPS亚基在蓝藻暴露于强光胁迫期间的调节作用。这一结构阐明了从Fd到NDH的电子转移链结构基础,同时揭示了复合体内所有的接触部位及相互作用的电子载体和PSI之间的相互作用方式。
2.2 冷冻电镜在光系统II结构与功能研究中的应用
PSII反应中心、捕光复合体 II(light harvesting complex II,LHCII)和放氧复合体(oxygen-evolving complex,OEC)等亚单位共同组成了PSII超复合体。其主要功能是利用光能将水氧化并还原质体醌。目前,冷冻电镜技术在PSII复合体的研究也已得到广泛的应用(图3)。2016年,柳振峰、章新政、常文瑞/李梅团队合作利用冷冻电镜单颗粒技术成功解析了菠菜PSII-LHCII超级复合物的高分辨率结构[71]。该复合体总分子量约1 100 kD,分辨率为3.4Å。PSIILHCII超复合体是一个同源二聚体的超分子体系,其中每个单体都含有25个蛋白亚基、105个叶绿素分子、28个类胡萝卜素分子和众多的其它辅因子。该项工作解析了蛋白亚基CP29的全长结构及CP26的结构,揭示了不同外周捕光复合物与核心复合物间的装配方式,彼此之间的相互作用位点,和各亚基间的排布规律,对于深入了解PSII-LHCII超级复合物中的能量传递具有重大意义。2017年,该团队又解析豌豆C2S2M2型PSII-LHCII超级复合体2.7-3.2Å冷冻电镜结构[72],总分子量达到1 400 kD。与菠菜的PSII-LHCII超级复合体结构相类似,该超级复合体也是同源二聚体。不同于菠菜PSII-LHCII复合物,该复合体的每个单体中所包含的蛋白亚基、叶绿素分子及类胡萝卜素分子均多于菠菜的PSIILHCII复合物。该项研究还解析了蛋白亚基CP24与M-LHCII的结构,通过比较两种不同状态的C2S2M2结构,发现CP24与M-LHCII结合的位点不是保守的,说明高等植物PSII复合物能够及时感受环境变化并做出响应。该项研究对进一步理解高等植物PSII复合物中的电子传递及能量转化,揭示高等植物在土壤、水体等弱光条件下实现高效捕光分子机理具有重要意义。此外,Boekema团队及其合作者使用冷冻电镜单颗粒技术以5.3 Å的总分辨率解析得到了拟南芥C2S2M2超复合物的三维结构[73],除PsbJ和PsbY以及LHCII三聚体和次要天线复合物以外,该结构包含了在不同PSII复合物中均保守的膜结合核心亚基,解析了所有叶绿素在亚基中的位置,揭示了这些叶绿素在介导能量从外围触角到核心流动中的作用。
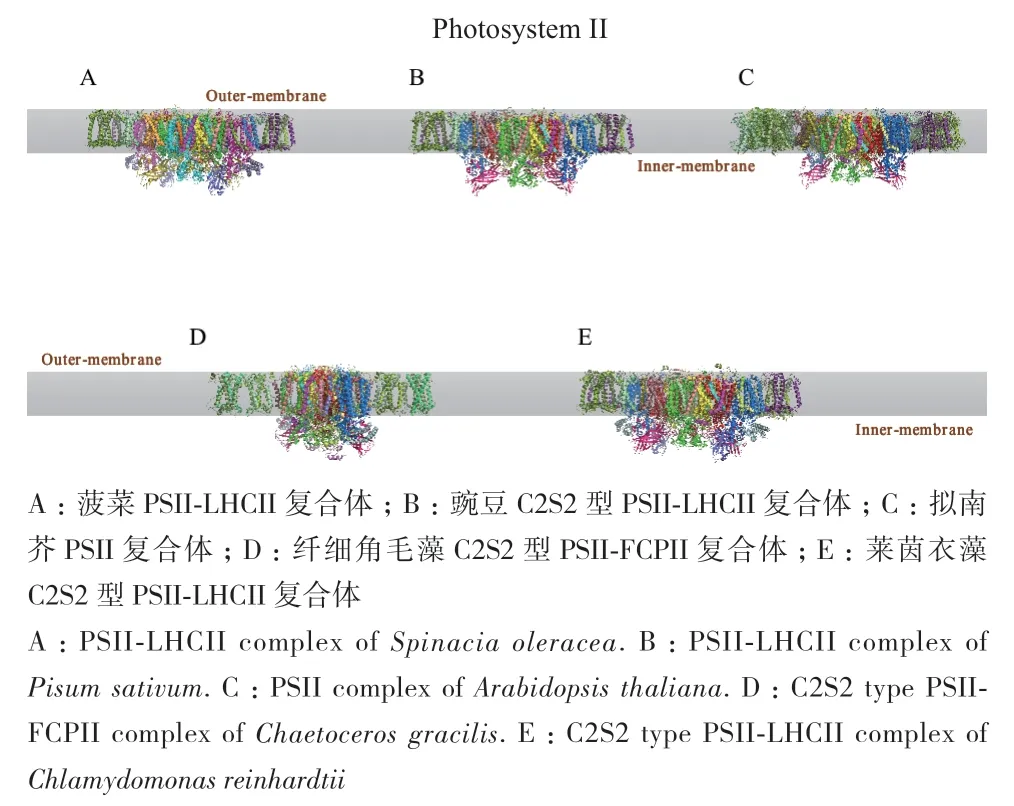
图3 光系统II的冷冻电镜结构Fig.3 Cryo-EM structure of photosystem II
除高等植物外,冷冻电镜技术又迅速被应用于低等植物的PSII复合物结构解析。沈建仁、匡廷云研究组联合隋森芳团队解析了中心纲硅藻PSIIFCPII超级复合体3.0 Å分辨率的冷冻电镜结构[74]。该结构显示PSII-FCPII超级复合体为二聚体,每个单体包含24个PSII亚基和11个FCPII亚基,同时还有200多个色素分子以及大量的脂质分子,共70个蛋白亚基,分子量高达1.4 MD。该PSII与蓝藻和高等植物的PSII结构相似,但区别于二者,硅藻的PSII在放氧中心存在5个外周蛋白以及两个与PSII和FCPII相连接的跨膜蛋白。此外,硅藻PSIIFCPII复合体的组装形式也显著不同,FCPII主要由两个四聚体组成,分别与PSII核心存在两种结合形式,紧密结合与松散结合。而硅藻FCP四聚体两种结合方式的位置与高等植物LHCII三聚体的紧密结合及松散结合的位置刚好相反。该复合体构建了硅藻PSII-FCPII复杂的蛋白和色素网络,揭示了复合体中各个亚基的相互作用方式及硅藻PSII中独特的捕光天线组装排布,为研究硅藻PSII对光能高效吸收、传递和转化的分子机理提供了结构基础。同年,柳振峰团队与合作者也解析了衣藻来源的C2S2和C2S2M2L2型复合物的近原子分辨率冷冻电镜结构[75],发现了衣藻C2S2型复合物中的强结合型LHCII三聚体结构的亚基组成。C2S2M2L2复合物与C2S2复合物的装配方式十分相似,但前者更为复杂。相对于C2S2复合物,C2S2M2L2复合物的两侧分别结合了一对M-LHCII三聚体和一对LHCII三聚体。C2S2M2L2复合物的高分辨率结构还揭示了L-LHCII与CP29、L-LHCII与M-LHCII彼此之间的相互作用方式与装配机制。该些研究结果对理解藻类植物在水体及土壤等弱光环境下高效捕获光能的分子机理提供了结构基础。
2.3 冷冻电镜在光合电子传递链结构与功能研究中的应用
除两类光系统复合体的结构与功能研究外,冷冻电镜技术也被广泛应用于其他光合作用组分的结构及功能研究之中,并取得了突破性的结果。在整个电子传递的过程中,细胞色素b6f(cytochrome b6f,Cyt b6f)复合体也扮演着十分重要的角色。它是一个带有几个辅基的多亚基蛋白质复合体,主要生理功能是将光系统 I与光系统 II联系起来,将还原态质子醌中的电子传递给质体蓝素(plastocyanin,PC),同时将H+释放到类囊体的腔。2019年,Johnson团队利用冷冻电镜单颗粒技术解析得到高等植物菠菜细胞色素b6f复合体3.6Å高分辨率结构(图4)[76],该复合物包含多达3个天然结合的质体醌(plastoquinone,PQ)分子。第一个PQ1位于PQ氧化位点(Qp)附近的一个cytb6f单体中,与血红素bp和叶绿素a相邻。PQ2跨越单体间的空腔,部分阻碍PQ1侧的PQ还原位点(Qn),并使电子转移网络在相邻单体中占据的Qn位点发生转换。第3个PQ分子的位置与Q循环期间相反单体中Qp和Qn位点之间的转变一致。因此,该结构成功揭示了Q循环的结构基础及其氧化还原功能的分子机理,指出菠菜细胞色素b6f复合体与质体醌的结合位点,为了解该复合物如何在光合作用中发挥催化和调节作用提供了新的见解。并为叶绿素吸收并转化光能的机制及Q循环期间各位点之间进行PQ交换时所涉及的构象变化等问题提供了精确的解答。

图4 菠菜细胞色素b6f复合体冷冻电镜结构Fig. 4 cryo-EM structure of spinach cytochrome b6f complex
环式电子流是由PSI参与的一种重要光保护机制,光合作用生物可通过该机制调节有效光合作用所需的ATP和NADPH水平。脱氢酶复合物:NDH在大多数放氧光合生物中均是关键组成部分,将源自PSI的NADPH氧化为NADP+,同时还原质体醌,泵送质子穿过质体膜,建立质体膜两侧的质子浓度梯度,该质子浓度梯度被ATP合成酶用来合成ATP。2019年,Davies团队成功解析了嗜热蓝藻的NDH复合物3.1Å的冷冻电镜结构[77],揭示了主要OPS亚基在NDH复合物中的结构与排列信息,并观察到外周臂中靠近质体醌结合位点的外辅因子,同时也从结构上推测了NDH可能具有的几种电子传递途径,解释了NDH如何最大限度避免半质体醌自由基的产生。科学界普遍认为蓝藻并非植物,但其却可以进行光合作用并产生氧气,该结构的成功解析为整个光合作用的电子传递途径和机理提供了新的见解,同时也为光合作用系统各关键组分彼此之间的相互作用提供了新的认知。
光合作用是地球上所有生物赖以生存的基础。在各种能够进行光合作用的植物中,藻类植物可为全球的光合作用贡献近半数的力量。藻胆体由藻胆蛋白和接头蛋白组成,是藻类植物中的主要捕光复合物,有着接近100%的光能捕获效率。藻胆体作为部分低等植物重要的捕光天线系统,能将捕获的光能传递至光合机器核心,其组装方式以及高效的能量传递机制一直是光合作用研究领域的关键问题。2017年底,隋森芳团队报道了太平洋凋毛藻(G.pacifica)藻胆体的3.5 Å分辨率的冷冻电镜三维结构[78],这是第一个完整藻胆体的近原子分辨率三维结构。该复合体包含862个蛋白亚基,分子量约16.8 MD。该项工作也是首次获得该复合体在功能组装状态下的结构,同时首次确定了藻胆体中全部2 048个色素的整体排布,揭示了接头蛋白如何影响生色团的微环境,并阐明了藻胆蛋白与连接蛋白组装的分子机制,为高效的能量传递途经提供了坚实的结构基础。2020年,该团队又成功解析了盐泽红藻紫球藻(P. purpureum)藻胆体的冷冻电镜三维结构[79],并将分辨率提高到了2.8 Å。将两次结构进行对比发现,盐泽红藻藻胆体仅含有706个蛋白亚基,包含1 598个色素分子,比海洋红藻藻胆体的整体尺寸小。对结构进行分析发现色素分子与周围连接蛋白上的芳香族氨基酸相互作用,从而改变色素分子的能量状态,以保证高效的能量传递。2021年,隋森芳团队联合李雪明团队,应用冷冻聚焦离子束减薄技术(cryo-FIB milling)和冷冻电子断层技术(cryo-ET)解析红藻细胞内藻胆体-光系统复合物 II原位结构,获得了离体研究无法获得的新的结构信息(图5)[80]。原位结构给予了更加丰富的生物学信息,该研究发现红藻细胞内的藻胆体在类囊体膜上以齿状交互的方式规则排布。同时,相比于高分辨率单颗粒结构及PSII晶体结构,细胞原位藻胆体-PSII超复合物还存在3个未知的蛋白密度介导藻胆体的不同亚基与PSII相互连接。细胞水平的藻胆体与PSII存在多个相互作用界面以保证高效的能量传递过程。红藻细胞内部分区域的相邻类囊体膜之间相连接形成“楼梯状”的接孔,从而实现膜间信息交换与能量传递,为类囊体膜系统形成高度连接的膜网络奠定了结构基础。

图5 藻胆体的冷冻电镜结构[80]Fig. 5 cryo-EM structure of phycobilisome[80]
总之,冷冻电镜技术逐渐成为了研究光合作用相关生物大分子的重要手段,它成功解析了光系统II、细胞色素b6f及ATP合酶等光合作用中重要结构,使得我们对于光合作用机制的深入了解成为可能。同时也为深入了解光能捕获机制、高效的电子传递能力以及能量转化的机理提供了重要的结构基础(图6)。

图6 冷冻电镜技术在植物光合作用研究领域的应用Fig. 6 Application of cryo-EM in the field of plant photosynthesis research
3 冷冻电镜在植物感知与应答环境胁迫分子机制研究方面的应用
植物的生长暴露于持续变化的自然环境,经常需要抵御各种不利于植物生长和发育的生存胁迫。这些生存胁迫包括生物胁迫(如病原体感染和食草动物的啃食损伤)和非生物胁迫(主要包括干旱、高温、盐害、营养匮乏等)。不同的环境胁迫会导致植物在基因表达、信号转导和生理性状方面的特异性反应[81]。近年来,随着基因组学、生物信息学、遗传学和结构生物学等技术方法的应用,人们对植物感知胁迫信号并进行抵御的分子机制理解不断加深,其中冷冻电镜技术为研究植物感知与应答环境胁迫相关生物大分子复合物的结构功能研究方面发挥了重要作用。
3.1 冷冻电镜在植物感知与应答生物胁迫分子机制研究中的应用
自然环境中,为了抵御细菌、真菌、病毒等病原体胁迫因子,植物进化出一套以细胞为单位的双重免疫防线:(1)通过细胞膜上锚定的模式识别受体(pattern-recognition receptors,PRRs)识别病原微生物分泌的病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)来激活植物免疫反应,称为病原体相关模式分子触发的免疫反应(PAMPstriggered immunity,PTI), 包 括 活 性 氧 ROS 的 剧增、Ca2+大量内流、防御基因表达上调和气孔关闭等[82-83];另外,植物损伤相关分子模式(damage associated molecular patterns,DAMPs)介导的免疫反应也隶属第一道免疫防线;(2)通过细胞内核苷酸结合和富亮氨酸重复受体(nucleotide-binding and leucine-rich repeat receptors,NLR)直接或间接地感受病原菌分泌的特异性效应因子(virulence protein effector),所激发的植物免疫反应,被称为病原体效应分子触发的免疫反应(effector-triggered immunity,ETI)[84-85]。PTI是植物基础抗性的重要组成部分,该抗性具有广谱性,但抗性较弱。ETI通常具有物种特异性,形式上更进化,能够更有效抵抗病原菌[86-88]。最近的研究发现,植物的ETI免疫防线依赖于PTI防线,同时激活的ETI免疫反应还可以增强PTI免疫防线[89-92]。因此,植物利用相互依赖的两道免疫防线协同激活植物的防卫反应,以抵抗病原菌的入侵。
细胞膜上锚定的模式识别受体PRR家族可分为受体样激酶(receptor like kinase,RLK)和受体样蛋白(receptor like protein,RLP)。RLK-PRRs包含负责识别配体的胞外区(extracellular domain,ECD)、负责胞内外信号传导和膜锚定的跨膜区(transmembrane domain,TM)和负责下游信号传导的胞内激酶结构域,而RLP-PRRs可能不包含跨膜结构域和胞内结构域[93]。
到目前为止,研究较为充分的几类PRRs基本都有原子分辨率的晶体结构,包括FLS2、PEPR1、AtCERK1、CEBiP等[93]。FLS2和 PEPR1属 于 典型的LRR-RLKs受体,两者分别识别细菌鞭毛蛋白flg22和植物诱导肽Pep1,分别启动LRR-RLK/PAMP和LRR-RLK/DAMP模式,通过下游信号通路触发PTI免疫反应[93-94];来自于拟南芥的AtCERK1和来自于水稻的OsCEBiP均属于典型的LysM-PRRs,识别真菌几丁质和细菌肽聚糖后被激活,通过下游信号分子与MAPK级联连接,进而调节多种免疫反应[95-96]。
为了达到侵袭感染植物细胞的目的,病原体进化出可以干扰或抑制PTI信号传导的效应因子,从而绕过第一道防线,侵袭植物细胞。相应的,植物为了抵御这种侵袭,进一步进化出细胞内免疫受体NLR,通过识别病原体效应分子或其活动,诱导病原体效应分子触发的免疫反应ETI。植物细胞内免疫受体NLRs通常包含N端特定结构域、中部保守的核苷酸结合位点(nucleotide-binding site,NBS)结构域和C端高度可变的富含亮氨酸的重复序列(leucine-rich repeat,LRR)结构域。特定N端结构域为 TIR(toll/interleukin-1 receptor)、CC(coiled-coil)或 RPW8(resistance to powdery mildew 8)结构域,相应的NLR受体形成相应的亚家族TNLs,CNLs和RNLs[83]。
NLR作为ETI免疫防线的主要组成,可通过“直接识别”、“间接识别”或者“NLR IDs”[97]多种方式识别病原体分泌的效应因子,触发细胞超敏反应,导致细胞程序性死亡,从而将病原体感染限制在侵染部位。在动物中,NLR在结合其效应子后寡聚化是下游活动的关键,但植物系统在许多方面有所不同,其激活机制不太清楚[98]。在过去的20年中,人们努力了解植物NLRs的作用机制,而冷冻电镜在其中发挥了重要作用。
2019年,柴继杰、周俭民和王宏伟研究团队通过使用冷冻电镜单颗粒分析技术并使用Volta相位板合作解析了首个植物NLR蛋白ZAR1的全长结构[99]。结构信息表明:分子内相互作用和ADP结合导致了ZAR1蛋白的自抑制状态;来自病原体的效应蛋白AvrAC尿苷化免疫信号通路关键分子BIK1阻断PTI免疫信号通路的同时,也导致植物分泌的诱饵分子PBL2的尿苷化,即PBL2UMP,进而会被预先形成的复合体ZAR1-RKS1识别并结合,导致ZAR1NBD构象发生变化,ADP脱落,ZAR1活化进入中间状态,形成ZAR1-RKS1-PBL2UMP单体复合物(图7)。该研究为ZAR1蛋白自抑制状态的维持机制、ZAR1与RKS1的相互作用、ZAR1通过ZAR1-RKS1间接识别PBL2UMP的机制,以及PBL2UMP诱导ZAR1活化的机制提供了详尽的理论基础。同时,该研究团队进一步使用冷冻电镜方法揭示了处于中间状态的单体ZAR1-RKS1-PBL2UMP复合物寡聚化形成抗病小体机制和激活机制[100](图7),并结合生化实验和单分子成像进一步揭示了其生物学功能[101]。这一系列研究揭示了植物NLR寡聚化形成抗病小体发挥功能的关键分子机制,同时也比较了NLR抗病小体与NLRC4炎性小体或Apaf-1凋亡小体的结构差异,以及因此所导致的信号传导机制的不同。

图7 植物NLR蛋白ZAR1由静息状态进入激活状态并寡聚化形成抗病小体的构象变化Fig. 7 Conformational changes of plant NLR protein ZAR1 from inactive state to active state and then oligomerized to form resistsome
2021年5月,继首个CNL类NLR受体ZAR1全长结构得到解析后,两种TNL-NLR受体复合物及相应抗病小体结构首次通过冷冻电镜被解析。柴继杰研究组及其合作者报告了TNL类抗病蛋白RPP1直接识别其效应蛋白ATR1后激活并形成全酶的分子机制,区别于ZAR1-RKS1通过结合PBL2UMP而间接识别效应蛋白的作用机制。该研究通过冷冻电镜单颗粒分析技术成功解析了RPP1-ATR1四聚体复合物激活状态的3.2 Å分辨率的结构[102]。结构分析揭示了LRR结构域和新发现结构域C-JID对效应蛋白ATR1的识别,揭示了RPP1抗病小体的形成并作为全酶催化NAD+水解活性的机制(图8)。生化和功能数据表明C-JID结构域在TNL类NLR受体中广泛存在,作为特异性识别ATR1的主要决定因素,可能对TNL识别配体具有广谱作用。与ATP作为CNL类NLR受体ZAR1激活并寡聚化不同的是,RPP1中相应基序的突变导致结合在NOD结构域的是ADP,而非dATP/ATP。该研究促进了TNL下游免疫通路信号传递机制的研究,为理解植物TNL类抗病蛋白活化机制提供了结构基础。
同时,Nogales和Staskawicz研究团队报道了病原体底物结合的免疫受体复合物ROQ1-XopQ的3.8Å分辨率的冷冻电镜结构,揭示了以ROQ1作为范式的TNLs的直接识别、寡聚和TIR结构域激活机制[103](图 8)。该研究进一步佐证了 TNL-NLRs与病原体的直接识别作用机制:ROQ1的LRR和C-JID通过直接识别病原体效应器XopQ,通过与底物的结合进而解除TNLs的自抑制状态,允许NB-ARC结构域过渡到与ATP结合、准备寡聚化形成抗病小体。ROQ1-XopQ的寡聚化组装使TIR结构域紧密接触,导致TIR结构域对NAD+的切割,释放二磷酸腺苷核糖(一种触发胞浆Ca2+内流的信号分子),进而导致抗病性的下游信号通路激活和局部细胞死亡。

图8 RPP1-ATR1与ROQ1-XopQ分别寡聚化组装形成抗病小体[103]Fig. 8 Resistosomes oligomerized respectively from RPP1-ATR1 and ROQ1-XopQ
作为植物两大类NLR受体CNLs和TNLs的代表,ZAR1与RPP1和XopQ的冷冻电镜结构解析结果是植物抗病蛋白研究领域数十年来一直期待的重大突破。抗病蛋白在植物免疫系统中扮演着核心角色,因此关于其生化活性及其介导的信号转导途径一直是植物免疫领域的研究重点,但无论是PRR受体,还是NLR受体,其结构研究进展并不显著,尚未深入开展结构研究的PRR受体家族除了数量最多的LRR-RLK受体以外,还包括表皮生长因子样受体(EGF-like-PRRs)WAK[104]和凝集素结构域型受体(EGF-like-PRRs)DORN1等[105-106]。病原物分泌的效应子被寄主细胞识别后如何诱导了NLR受体的N端结构域自我寡聚;效应子与抗病蛋白之间的相互作用是否存在中间传递分子,以及其如何参与抗病蛋白的构象变化和激活?冷冻电镜技术将在这些问题的回答中发挥重要作用。
3.2 冷冻电镜在植物感知与应答非生物胁迫分子机制研究中的应用
非生物胁迫和病原菌侵染是影响作物产量和导致巨大损失的两大主要原因。植物在生长发育过程中,除了会受到病原体感染侵害之外,经常会受到诸如高盐、低温、高温、干旱和水涝等非生物胁迫的影响,造成作物生长不良,严重时导致作物减产甚至死亡。为应对各种逆境胁迫,植物已经进化出各种机制来感受外界环境,并通过基因表达调节形态、生理状态的方式来对不同的胁迫作出适应性响应[81,107-108]。
研究人员一直致力于植物体胁迫感受器的鉴定和研究,以期解决植物是如何感知和响应非生物胁迫,进而改善植物抗逆性,提升作物产量和农业生产可持续性。高渗胁迫是植物在干旱环境中面临的主要生存压力,植物细胞会通过一系列生理过程对该胁迫信号做出应答。渗透胁迫可能通过激活某些Ca2+渗透通道快速增加胞质Ca2+浓度。这些通道的激活可能是由细胞膜或细胞骨架的渗透应力产生的机械力所引起。2014年,研究人员发现拟南芥的一种质膜蛋白OSCA1会形成高渗门控Ca2+通道,并认为OSCA1是植物细胞对高渗信号的感受器[109]。另外,植物细胞利用机械门控的小电导离子通道MscS缓解渗透压,参与线粒体内膜电位的调节和非生物胁迫下氧化还原稳态的维持[110-111]。
2018年,高渗门控Ca2+通道OSCA1蛋白家族成员的结构被多个研究小组使用冷冻电镜方法相继解析。陈雷、宋晨和闫志强研究组通过冷冻电镜方法率先解析了机械力敏感的非选择性离子通道 AtOSCA1.1的二聚体结构(3.5 Å)[112],揭示了OSCA通道的组装模式,并通过突变体的电生理研究及分子动力学模拟,推测了该通道基于膜传递机械力激活的分子机制和孔道位置(图9)。该研究通过生化实验阐明了其功能和二聚体构象,鉴定了二聚体界面形成的关键残基。此外,研究团队还解析了4.8Å分辨率的AtOSCA3.1的冷冻电镜结构。AtOSCA3.1与AtOSCA1.1在整体架构和构象上的相似性进一步说明了该蛋白质家族的结构保守性。基于所得的结构特征,研究人员推测渗透胁迫在脂质双层中产生张力会导致构象变化进而激活OSCA通道以允许Ca2+进入,从而对高渗胁迫信号产生一系列应答。

图9 OSCA1蛋白的冷冻电镜结构及其激活构象Fig. 9 cryo-EM structure and activated conformation of OSCA1
同时,Jojoa-Cruz等[113]解析了拟南芥OSCA1.2通道蛋白的高分辨率冷冻电镜结构(图10,绿色),同一团队的Murthy等[114]对OSCA通道蛋白的生物物理特性进行更深入的分析,电生理实验的亚电导状态结果进一步印证了上述研究所解析的OSCA通道蛋白的二聚体结构。与此同时,孙林峰研究组及其合作者也运用单颗粒冷冻电镜方法对拟南芥OSCA1.2通道蛋白的结构进行了研究,最终获得了3.7Å的分辨率(图10,紫色)。与其他研究组结果相比,虽然通道蛋白总体结构非常相似,但在胞质螺旋部分及其锚定区域存在一定差异[115],暗示不同的胞质螺旋结构域可能部分导致了通道蛋白不同的生物物理特性。2019年,Maity等[116]报道了来自水稻的OSCA1.2通道蛋白的冷冻电镜结构,与拟南芥OSCA1.2相比,水稻OSCA1.2位于胞内结构域的延伸螺旋臂具有明显的差异,结合生物化学、生物物理和计算研究,该研究提出水稻OSCA1.2如何在渗透胁迫下进行运输途径门控的模型,为研究植物细胞的机械传感机制提供了分子框架。

图10 AtOSCA1.2单体在多个方向的构象Fig. 10 Conformations of AtOSCA1.2 monomer in multiple directions
2019年,孙林峰研究组及其合作者解析了响应低渗刺激的拟南芥中小电导机械敏感通道MscS样蛋白AtMSL1的3.3Å的冷冻电镜结构[117],总体结构与细菌MscS非常相似,但AtMSL1的跨膜结构域更大,羧基末端更具柔韧性,并且缺少在MscS中观察到的β-桶状结构。AtMSL1中的侧门明显较小,通过诱变扩大门的大小可以增加电导性。该研究明确了真核生物中小电导机械敏感离子通道的结构框架和门控机制。2020年,Deng等[118]通过冷冻电镜单
颗粒技术解析了小电导机械敏感通道MscS闭合和开放的原子分辨率结构(3.0Å),结合电生理实验揭示了其通过横向膜张力导致跨膜区域扁平化扩张进行门控的结构机制。
钾元素作为植物必需的三大基本营养元素之一,可以参与多种植物代谢活动,包括氮代谢、渗透调节和控制细胞膜极化,对于植物的生长发育至关重要。K+可以提高植物对干旱、高盐等非生物胁迫的耐受性,同时也可以抵抗真菌等生物胁迫。植物通过体内的钾离子吸收和转运系统获得足够的K+,其中,钾离子通道发挥了重要作用。2020年,基于冷冻电镜技术,植物钾离子通道的结构与功能研究取得了一定进展。Perozo小组率先解析了拟南芥中超极化激活的电压门控钾离子通道KAT1的冷冻电镜结构,并据此提出了非结构域交换Kv通道KAT1中机电耦合和门控极性的分子机制[119]。这种直接耦合机制与超极化激活环状核苷酸门控通道(HCN)的变构机制相反。同时,田长麟小组及其合作者解析了拟南芥全长KAT1的3.2Å分辨率的冷冻电镜结构[120],确定了KAT1是非域交换离子通道,初步确定了其在超极化激活中门控机制的关键要素,并提出了相应的门控模型,促进了人们对超极化激活离子通道门控特性的了解。
通过冷冻电镜技术,研究人员已经获得了部分植物部分非生物胁迫感受器的分子结构,但尚有众多的胁迫感受器,比如增加耐热性的拟南芥环核苷酸门控Ca2+通道CNGC6[121],定位于水稻细胞质膜上的低温感受器COLD1[122-123],水稻中可以提升冷冻耐受性的两种钙调蛋白受体样细胞质激酶CRLK1和CRLK2[124-125]和下调冷冻耐受性的低温响应性蛋白激酶CPRK1[126],基于Ca2+成像遗传筛选手段分离鉴定的在盐胁迫信号感知中的关键蛋白MOCA1[127],其结构功能研究有待开展,冷冻电镜技术将发挥重要作用。
4 展望
综上,冷冻电镜技术在分子植物学领域已得到众多应用(表1),主要包括:光合作用复合物的结构功能研究,为进一步阐明光合作用分子机理提供了结构基础;植物感应生物胁迫的相关免疫受体复合物的结构功能研究,促进了对植物免疫分子机制的认识;植物感应非生物环境胁迫相关感受器的结构功能研究,揭示了一类新的植物离子通道激活的分子机理。未来,冷冻电镜技术将在植物光合作用、胁迫响应等方面的分子机理研究发挥更大的作用,这包括了对于高等植物光系统 I复合体、低等植物细胞色素b6f等的结构研究,包括了对于植物PRR受体WAK和DORN1等的结构研究,包括了对于植物Ca2+通道CNGC6、低温感受器COLD1和低温响应性蛋白激酶CPRK1等的结构研究。此外,冷冻电镜等结构生物学技术近年来不断发展和突破,特别是原位冷冻电镜技术的突破和成熟[80],人工智能结构计算技术AlphaFold2的出现和成功[128],为冷冻电镜技术在分子植物学研究领域的应用提供了新的更大的契机。这些新技术的成功应用将有效推动人们对植物光合作用、胁迫感知和抗病应答分子机理的认识,为改良育种提高作物产量和品质做出贡献。

表1 冷冻电镜技术解析获得的植物相关重要生物大分子结构Table 1 Structure of important plant-related biological macromolecules solved by cryo-EM

