CRISPR/Cas9介导的二穗短柄草bdfls2敲除突变体的获得
王睿 韩烈保
(北京林业大学草业与草原学院,北京 100083)
植物在自然环境下的生长过程中一直受到数量众多的病原菌的攻击。植物为了生存进化出了一套独特的先天免疫系统,从而识别并清除病原菌入侵者[1]。植物先天免疫系统通常可以分为两个层面,分别是分子模式触发的免疫(pattern-triggered immunity,PTI)和效应子触发的免疫(effector-triggered immunity,ETI)[2-3]。其中 PTI是基于定位在植物细胞细胞膜上的模式识别受体(pattern recognition receptors,PRRs)对病原物相关分子模式(pathogenassociated molecular patterns,PAMPs) 或 损 伤 相关分子模式(damage-associated molecular patterns,DAMPs)进行识别并响应的免疫过程,该免疫过程可以帮助植物抵御大部分病原微生物[4-5]。
PAMPs广泛存在于微生物中,是其生存所必需的一类进化上保守的分子[6]。flg22是其中一种已被深入研究的PAMP,它是一种由22个氨基酸组成的高度保守的细菌鞭毛蛋白,可诱导多种植物的广谱的PTI反应[7-9]。拟南芥的相关研究表明植物细胞表面的模式识别受体FLS2可以识别flg22[10],此后在水稻以及其他植物中也发现同源的FLS2受体也可以识别 flg22 诱导 PTI反应发生[8,11-12]。植物感受PAMPs后诱导活性氧(ROS)爆发、MAPKs激活、防卫基因表达以及植保素合成等一系列的防卫响应,抑制病原物生长,从而实现植物对病原物的广谱抗性[10,13]。
在基因编辑领域,分子生物学家一直在找寻并完善对基因组进行精确编辑和改造的高效便利的新工具,继锌指核酸酶(zinc finger nucleases,ZFNs)、类转录激活因子效应物核酸酶(transcription activator-like effector nucleases,TALENs)技术之后,利用基于细菌以及古菌抵御病毒侵染的CRISPR/Cas系统,使得基因编辑更为简单[14-15]。其中CRISPR/Cas9 系统是当前最为主流的基因编辑技术,其设计流程简单、操作方便、基因编辑效率高,被广泛应用到了各种植物的基因编辑当中,在提高作物产量、改良作物品质、培育抗病及抗逆境胁迫新品种等领域都具有良好的应用前景[16-17]。
二穗短柄草(Brachypodium distachyon)是温带一年生禾本科早熟禾亚科植物。二穗短柄草同禾本科最基本的常用模式植物水稻相比,其生长周期短,对生长环境要求较低,同时与早熟禾亚科之间的亲缘关系更近,是理想的冷季型草坪草模式植物,二穗短柄草 Bd21 已被广泛应用到科学研究中[18-19]。
目前对冷季型草坪草的先天免疫的研究开展十分有限,相关研究的突变体材料十分有限。因此本研究利用基于CRISPR/Cas9 系统的基因编辑技术,在冷季型草坪草模式植物二穗短柄草中对抗病免疫相关的重要基因BdFLS2进行了定向编辑,通过筛选转基因植株,对编辑后的bdfls2 突变体植株进行测序分析,我们发现该突变体中bdfls2 基因编码序列由于碱基的缺失导致提前终止,从而获得了敲除突变体bdfls2。同时基于此前拟南芥和水稻的FLS2的相关研究,我们发现该突变体在flg22 处理后相比于野生型,无显著的ROS爆发或防卫基因的激活,暗示二穗短柄草的FLS2也参与识别病原相关分子模式flg22激活PTI的过程中。进而也证明该突变体植株相关基因FLS2确实是植物中保守存在的识别病原相关分子模式flg22的关键组分,该突变体的构建为此后进一步研究冷季型草坪草FLS2的先天免疫奠定了材料基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 本研究所用二穗短柄草生态型均为BD21,由中国科学院遗传与发育研究所高彩霞研究组提供。
1.1.2 菌株和载体 本研究载体构建使用大肠杆菌菌株为DH5α,转化所用根癌农杆菌菌株为AGL1,利用的CRISPR/Cas9 系统载体为pHUE411,以上菌株及载体均由中国科学院微生物研究所邱金龙研究组提供。
1.1.3 实验试剂 Taq DNA 聚合酶等PCR 相关实验试剂以及RNA提取所用的Trizol试剂均购自天根生化科技(北京)有限公司,反转录试剂盒PrimeScriptTMRT 和染料法荧光定量试剂盒SYBR Premix Ex TaqⅡ均购自TaKaRa;活性氧检测试剂Luminol 和Peroxidase 购自Sigma-Aldrich 公司;激发子肽段flg22(QRLSTGSRINSAKDDAAGLQIA)由南京金斯瑞生物科技有限公司合成;其他实验试剂均为国产试剂分析纯。实验相关的引物合成以及测序工作均由北京六合华大基因科技有限公司完成。
1.2 方法
1.2.1 sgRNA 靶位点的选取 首先从NCBI数据库(https://blast.ncbi.nlm.nih.gov/)中获得 BdFLS2基因序列(BRADI5g21960)。并登陆CRISPR-P 网站(http://crispr.hzau.edu.cn/CRISPR2/)输入本研究目的基因BdFLS2的基因序列,获得该基因上一系列含有PAM序列备选的潜在靶位点[20]。基于此前对拟南芥FLS2 蛋白相关的研究报道[21],显示FLS2蛋白的N端在识别PAMP的过程中具有重要作用,因此我们在众多备选位点中最终选择了位于FLS2 胞外区功能结构域的sgRNA 靶位点序列bdfls2-sgRNA(5′-GCCGGCTTCAGTCCCTCGAAGGG-3′)进行BdFLS2基因的定向编辑。
1.2.2 CRISPR/Cas9-bdfls2载体构建 首先根据选择的靶位点序列,合成含对应靶位点序列的一对引物Tfls2-F(5′-GGCGCCGGCTTCAGTCCCTCGAA-3′)和Tfls2-R(5′-AAACTTCGAGGGACTGAAGCCGG-3′),将靶位点序列引物溶解成100 μmol/L母液,各取1 μL 加入到 98 μL 超纯水中稀释到 1 μmol/L,90℃孵育约30 s后移至室温冷却完成退火。最后如表1所示将完成退火后的靶点序列与pHUE411载体通过酶切连接构建表达载体CRISPR/Cas9-bdfls2[22]。

表1 酶切-连接体系Table 1 Enzyme digestion-connection system
1.2.3 二穗短柄草的转化与阳性株检测 将载体CRISPR/Cas9-bdfls2通过电激转化法转入农杆菌AGL1中,然后通过农杆菌介导的方法对二穗短柄草胚性愈伤进行转化。农杆菌转化后2周再将愈伤组织转接至新的选择诱导培养基上,该过程在设置为16 h光照,8 h黑暗的25℃的光照培养箱培养。此后每2周继代1次,在第2次继代后将筛选出的抗性愈伤组织转移到选择再生培养基上培养。之后当抗性再生绿苗长至4 cm时将阳性苗转移至壮苗培养基内,同时取少量叶片提取基因组DNA通过PCR对含目标位点的序列进行扩增并测序鉴定阳性植株。待抗性再生苗具有较健壮的根后,转入花盆中,于温室内种植[23]。相应PCR扩增引物如下:bdfls2-F(5′-CGTTCCTAGCACTAGCAGCACTG-3′),bdfls2-R(5′-GGTTCCGTGGAGCGAGTTGT-3′)。
1.2.4 实时荧光定量PCR 利用TRIzol试剂参照RNA提取试剂说明书提取植物的总RNA。取等量植物总RNA并通过DNaseⅠ对提取的植物总RNA进行前处理后,将处理后的RNA样品用反转录试剂盒根据说明书进行反转录。参考2014年郭葳等[24]在拟南芥PTI实验中的实时荧光定量PCR反应分析的方法,使用TaKaRa公司的染料法荧光定量试剂盒SYBR Premix Ex TaqⅡ通过伯乐(Bio-Rad)公司的CFX96荧光定量PCR仪进行PCR反应。本实验中以BdAct(Bradi4g41850)作为内参基因,基因相对表达量根据2-ΔΔCt公式的计算方法。本实验中实时荧光定量PCR反应所使用的引物见表2。

表2 qRT-PCR引物序列Table 2 Sequence of primer for qRT-PCR
1.2.5 ROS的测定 挑选14 d大的正常生长的二穗短柄草为材料,用植物叶片打孔器取直径大小为4 mm 的二穗短柄草叶圆片并用镊子小心放入各孔已加入去离子水200 μL 的96 孔酶标板中。室温下静置避光过夜,第2天小心吸去各孔的去离子水,并加入200 μL ROS测定溶液,然后用酶标仪(Centro XS3LB 960微孔板式发光检测仪)按2 min 一次计数,记录总计50 min 内的相关吸光值[25]。本实验中ROS的测定每种样品设8个生物学重复,统计分析作图表示为平均值±标准误。
2 结果
2.1 CRISPR/Cas9介导的bdfls2突变体构建与分子鉴定
在二穗短柄草BdFLS2 基因序列473 bp对应的前间隔序列邻近基序(protospacer adjacent motif,PAM)位置设计一对引物(Tfls2-F和Tfls2-R),通过pHUE411载体相应的酶切连接体系,将该靶序列插入到Bsa I酶切后的pHUE411载体中(图1)。
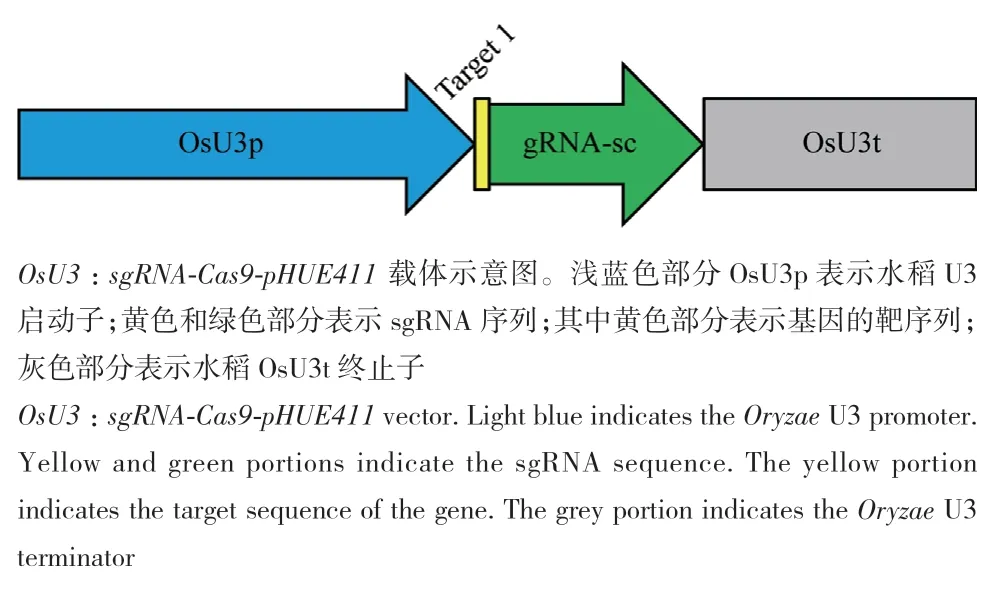
图1 二穗短柄草CRISPR/Cas9-bdfls2基因编辑载体示意图Fig. 1 Illustration of CRISPR/Cas9-bdfls2 gene editing vector in B. distachyon
通过电激法转化将构建好的带有BdFLS2基因靶序列的CRISPR/Cas9-bdfls2载体质粒转入农杆菌菌株AGL1,用于此后二穗短柄草愈伤的转化。同时利用PCR的方法,通过pHUE411植物表达载体上对应的一对鉴定引物OsU3p-F3(5′-GACAGGCGTC TTCTACTGGTGCTAC-3′)和 OsU3t-R(5′-TATTCACTA GCTCGGGATAGTTGGC-3′)进行PCR扩增,发现成功转化的菌株对应的条带大小和预期片段大小一致,表明基于CRISPR/Cas9系统的靶向编辑敲除二穗短柄草BdFLS2的基因组编辑载体已构建成功(图2-A)。在获得了一批经过转化再生后成功通过筛选的植株后,为了验证是否成功靶向编辑对野生型Bd21中的FLS2 基因,以及确定编辑后的基因型,我们选取转化筛选再生后的植株叶片,提取基因组DNA,并利用一对基因型鉴定引物bdfls2-F和bdfls2-R扩增包含编辑位点的片段进行测序分析(图2-B)。如图3-B所示,我们在其中2株不同的转基因植株中发现BdFLS2靶位点处测序结果呈现双峰,利用2015年刘耀光课题组开发的目标靶点突变的分析程序DSDecodeM对测序结果进行解读[26],发现这2株不同的转基因植物的BdFLS2等位基因上均发生了不同大小片段的碱基缺失,导致原有序列提前终止,因此获得了bdfls2 的基因敲除突变体。
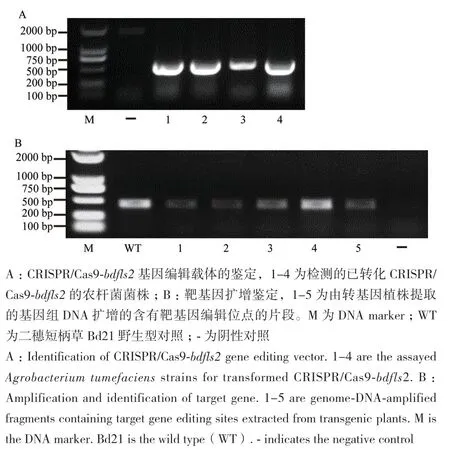
图2 编辑载体和编辑后靶基因的鉴定Fig. 2 Identification of gene editing vector and edited target gene
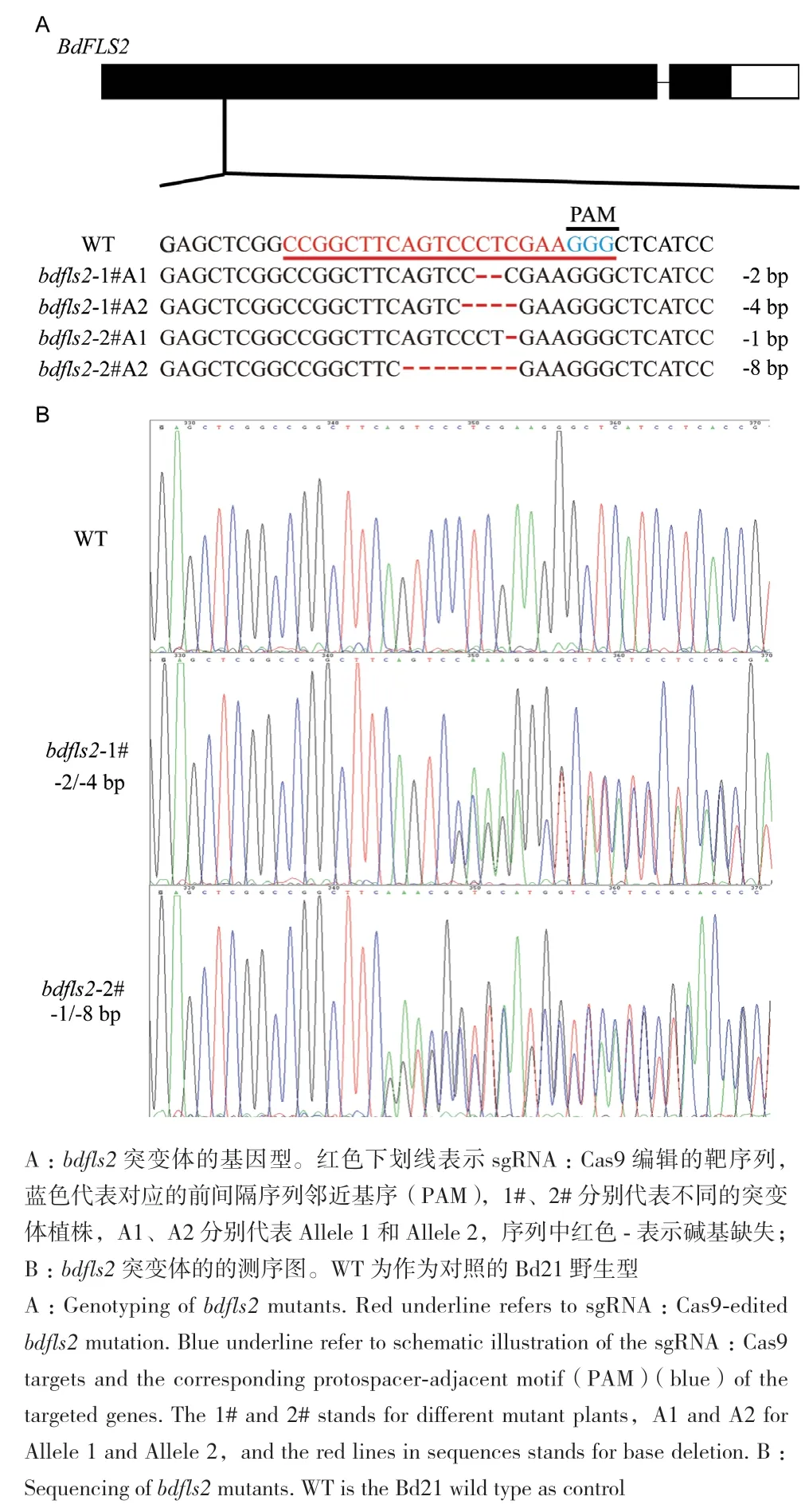
图3 二穗短柄草bdfls2 突变体基因型检测Fig. 3 Genotyping of bdfls2 mutants in B. distachyon
2.2 bdfls2突变体在病原相关分子模式flg22诱导下的ROS检测
为了检测二穗短柄草BdFLS2 是否参与了植物抗病的PTI 过程,我们用5 μmol/L flg22 去处理二穗短柄草野生型(WT)和bdfls2 突变体植物叶片。活性氧爆发是植物细胞一个早期的应对PAMP的反应,因此我们首先检测了flg22 处理后激发的活性氧(ROS)的变化。发现在野生型中flg22 能明显诱导的活性氧的爆发,且在15 min左右相对水处理的对照有显著峰值产生,此后下降并于24 min后趋于平稳。而bdfls2 突变体在flg22处理后则与未诱导的水处理野生型的曲线基本一致,无明显的活性氧爆发发生(图4)。以上结果表明,BdFLS2 参与了二穗短柄草识别flg22激活PTI的过程。
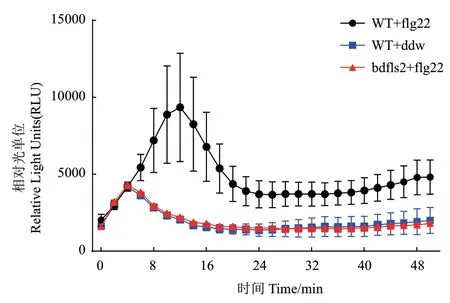
图4 二穗短柄草野生型和bdfls2 突变体在flg22处理下的ROS检测Fig. 4 ROS burst of wild-type B. distachyon and bdfls2 mutants under flg22 treatment
2.3 bdfls2突变体在病原相关分子模式flg22诱导下的抗病相关基因检测
抗病相关基因表达的检测是PTI研究中常用的一种检测手段[27],为了进一步证明BdFLS2 参与了二穗短柄草识别flg22激活PTI的过程,我们通过RT-PCR的方法检测了抗病相关基因表达情况。用5 μmol/L flg22分别处理二穗短柄草野生型(WT)和bdfls2 突变体植物叶片,并检测未处理的对照及处理1、3、6 h后不同时间的抗病相关基因BdChit8和PR2的的表达情况,发现在bdfls2 突变体中两种抗病基因在flg22处理后无显著变化,而在野生型中在处理后3 h显著增加,并在6 h呈现显著的峰值(图5-A)。同时我们利用另一种可以激发植物PTI的被广泛研究的真菌类PAMP 几丁质(chitin)进行了相同的检测实验,如图5-B所示,发现在100 μg/mL chitin 处理下bdfls2 突变体植物的抗病相关基因有显著的变化,其中BdChit8的变化模式野生型基本一致。以上结果表明,BdFLS2 参与了二穗短柄草特异性识别flg22激活PTI的过程。
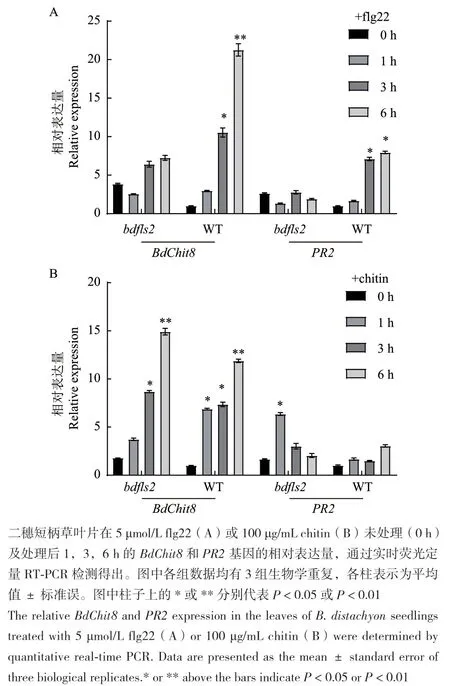
图5 实时荧光定量RT-PCR 对PAMPs诱导的防卫基因的检测Fig. 5 Detection of defense gene expression induced upon different PAMPs treatment by real-time quantitative RT-PCR
3 讨论
相对于早期研究基因功能时常用的T-DNA插入技术无法定向编辑研究中的目的基因,以及尽管可以进行靶向编辑但操作及构建较为复杂的锌指核酸内切酶(ZFNs)和转录激活因子样效应因子核酸酶(TALENs)这两种基因编辑技术。CRISPR/Cas9系统操作简便,可编辑区域大,靶向编辑效率高。同时随着CRISPR/Cas系统研究的日益深入,诸如单碱基编辑以及多位点编辑等技术势必都能够更好地应用到提高作物产量、改良作物品质、培育抗病及抗逆境胁迫新品种等领域中[16-17]。本研究利用该技术成功地对二穗短柄草的单一目的基因FLS2进行了编辑,并在第一代便获得了完全的基因敲除突变体,可见通过该方法可以大大缩短突变体材料获得的时间。而在冷季型草坪草领域基因编辑目前主要仍受限于材料的遗传转化再生体系仍不完善,直接在目的材料上进行直接的遗传操作耗费巨大,也因此利用好已有的模式植物二穗短柄草进行相关研究,在获得一定基础后进而定向扩展到相应草坪草植物的基因编辑育种中势必能取得更好的突破。
在PAMPs处理植物后防卫基因响应的测定中,我们同时发现bdfls2突变体植株的某些防卫基因在flg22诱导下仍会显著变化,这表明除BdFLS2外可能还有其他的模式识别受体可以识别flg22并激活PTI响应。而在chitin的诱导下其防卫基因PR2的表达模式也与野生型有显著差别(图5-B),这表明在敲除BdFLS2后可能由于其他模式识别受体参与相关信号的识别传递发生了改变从而导致了这一变化。所以对于本研究中获得的bdfls2突变体植株,可作为研究FLS2相关植物免疫通路的模式植物,更好地研究FLS下游信号通路的具体传导过程,对于开发相关的细菌型病害的抗病策略或新抗病品种的开发都有着重要意义。同时关于flg22的最新研究表明flg22的种类也会与不同种类的FLS2有特异性的识别关系[28],而本研究中使用的只是此前广泛应用于拟南芥研究当中并在水稻PTI研究中被证明可以激发PTI相应的单一一种flg22,所以要更深入有效地进行草坪草相关的抗病研究可能仍需要针对当前草坪草生长环境中天然存在的特异性的细菌病害所含的flg22进行相关研究,从而获得更实际的研究结果。
4 结论
本研究利用基于CRISPR/Cas9系统的基因编辑技术成功获得了二穗短柄草bdfls2的基因敲除突变体。通过检测突变体相应的PTI响应指标,发现bdfls2突变体植株ROS爆发和相关防卫基因的表达相较于未诱导的野生型均无明显变化,表明获得的bdfls2突变体确实未参与相应的PAMP的识别和诱导PTI响应的过程中。证明利用该技术在模式植物二穗短柄草中可以较快速地定向获得新的突变体并进行相应的功能研究,也为研究冷季型草坪草植物的先天免疫奠定了重要的遗传材料基础。

