肠道菌群及免疫调节与儿童哮喘关系的研究进展
崔天怡,刘佳蕊,吕彬,高秀梅,赵鑫*
支气管哮喘(以下简称哮喘)在全球范围发病率较高,且通常情况下,哮喘患者常从幼儿期开始出现症状[1]。儿童哮喘伴随反复发作的喘息、咳嗽、气促、胸闷等临床表现,以慢性气道炎症和气道高反应性为主要特征[2]。哮喘与免疫调节密切相关,个体易感性、病毒感染、过敏原暴露等因素导致免疫失衡引发哮喘[3],而且免疫细胞在哮喘的发展过程中起着关键作用。儿童哮喘具有多种不同的临床和病理生理特征。值得注意的是,哮喘患儿的肠道微生物组成与健康儿童相比有显著差异。临床研究表明,3 月龄哮喘患儿的粪便样本中毛螺菌属(Lachnospira)、韦荣氏菌属(Veillonella)、粪杆菌属(Faecalibacterium)和罗斯氏菌属(Roseburia)的相对丰度显著降低,并伴有乙酸盐合成减少和肠肝代谢产物失调[4]。另一项队列研究证实,粪便样本中链球菌(Streptococcus)和拟杆菌(Bacteroides)的相对丰度增加,且双歧杆菌(Bifidobacterium)和瘤胃球菌(Ruminococcus)相对丰度降低的3 月龄儿童,在其5 岁时患特应性喘息的风险更高[5]。肠道中双歧杆菌、阿克曼菌属(Akkermansia)和粪杆菌属相对丰度较低,且念珠菌(Candida)和红酵母(Rhodotorula)相对丰度较高的儿童发生特应性哮喘的风险升高[6]。在生命早期,免疫系统的成熟与微生物群的形成同时发生。由于肠道微生物对于调节免疫细胞功能和抵抗致病菌有重要影响,因此婴幼儿期的肠道微生物定植与失调同包括哮喘在内的众多呼吸系统疾病的发生密切相关。此外,肠道菌群失调诱发肠道损伤及黏膜免疫功能失调,加速了哮喘的发生与发展。因此,本文概述了哮喘儿童的肠道菌群特征和基于“肠-肺轴”的免疫调节机制,并探讨菌群精准化治疗哮喘在未来的应用前景。
1 哮喘中的免疫调节依赖于肠道菌群
多项临床和基础研究已证实了肠上皮细胞和肠固有免疫细胞通过吸收内皮细胞的信号,形成局部细胞因子微环境,从而导致远端呼吸道免疫反应的改变[7-11]。儿童哮喘涉及先天和获得性免疫反应,以下将具体阐述肠道菌群对儿童免疫系统的影响及其与儿童哮喘的关系(图1)。
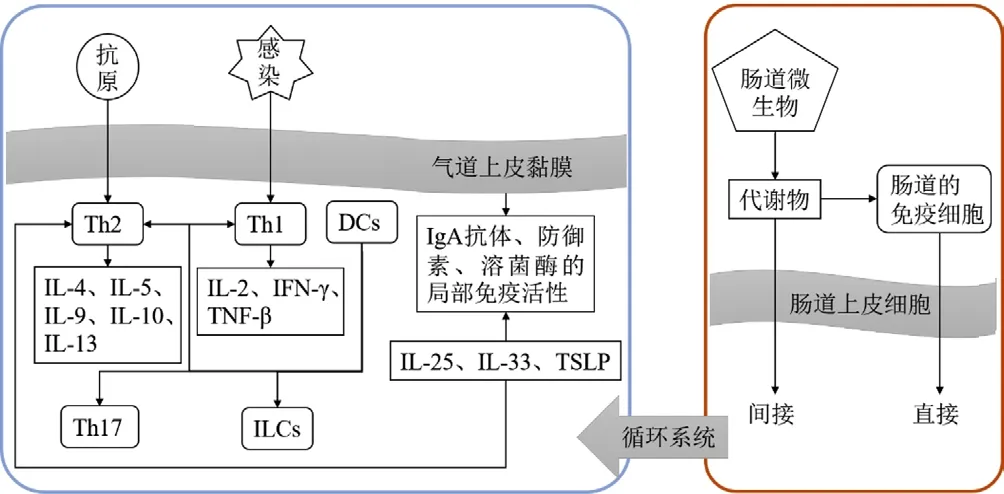
图1 肠道微生物参与调节哮喘的免疫反应Figure 1 Gut microbiota regulate the immune response in asthma
1.1 肠道菌群调节T 淋巴细胞群 T 淋巴细胞包括辅助型T淋巴细胞(Th 细胞)和调节性T 淋巴细胞(Treg 细胞),具有调节机体免疫活动、维持对自身抗原的耐受性以及阻碍自身免疫性疾病发生发展的功效[12]。过敏性哮喘的慢性炎症多由常见的、非致病性的过敏原产生的Th2 型免疫反应增强所致[12-13],且免疫球蛋白E(IgE)水平升高[13-14]。Th2 细胞产生的细胞因子白介素4(IL-4)、白介素5(IL-5)、白介素9(IL-9)等通过刺激B 淋巴细胞产生嗜酸粒细胞和IgE 抗体,进而促进肥大细胞释放组胺、5-羟色胺和白三烯,造成支气管收缩及过敏反应[15]。Th1 细胞分泌的细胞因子白介素2(IL-2)、干扰素γ(IFN-γ)、肿瘤坏死因子β(TNF-β)等促进巨噬细胞介导的免疫应答过程[16]。研究表明,Th1/Th2 平衡及Treg 细胞的免疫功能受肠道微生物的调节,如肠道分节丝状菌(segmented filamentous bacteria,SFB)直接刺激Th17 分化[17]、梭状芽孢杆菌(Clostridium spp.)参与诱导Treg 产生[18]、拟杆菌参与调节Th1/Th2 平衡[19]。因此,从肠道菌群入手对T淋巴细胞的免疫反应调节有助于缓解哮喘。
1.2 肠道菌群调节气道上皮细胞和树突状细胞(DCs) 气道上皮细胞在协调先天和获得性免疫方面起着重要作用,而先天免疫和获得性免疫参与了哮喘的发展[20]。上皮细胞调控免疫球蛋白A(IgA)抗体、防御素和溶菌酶的局部免疫活性,这些免疫活性也受白介素33(IL-33)、白介素25(IL-25)和胸腺基质淋巴生成素(TSLP)的调节,后者刺激Th2 型炎症并促进哮喘发生。另一项相关研究证实了抗TSLP 抗体能够抑制由上皮细胞驱动的Th2 炎性反应,该抗体可使过敏原诱导的支气管收缩减少,并降低呼出气一氧化氮(NO)水平和痰中嗜酸粒细胞的数量,上皮细胞还产生其他调节细胞因子,如白介素10(IL-10)和转化生长因子β(TGF-β)[21]。肠道菌群通过代谢L-酪氨酸使甲酚硫酸盐(PCS)水平升高,该作用促进了表皮生长因子受体(EGFR)和Toll 样受体4(TLR4)信号解偶联,从而减少了气道上皮细胞CC 族趋化因子(CCL20)的产生,保护宿主抵抗过敏性气道炎症[22]。该研究提示肠道菌群代谢产物可作用于远端气道上皮细胞从而减少过敏性哮喘反应。
DCs 是先天免疫和获得性免疫之间的重要纽带,其影响过敏性哮喘的发展。DCs 呈现给免疫系统的微生物片段可以促进许多调节和适应性反应,包括Th1、Th2 和Th17 细胞通路[23-24]。最近的研究证实了肺DCs 在哮喘中的作用,DCs 可以激活几种免疫细胞类型,如T 淋巴细胞和固有淋巴样细胞(ILCs),这些细胞能够提供针对共生菌的环境信号[25]。
1.3 “肠-肺轴”免疫细胞迁移依赖于微生物群 “肠-肺轴”的通讯机制也涉及免疫细胞,如2 型固有淋巴样细胞(ILC2)、3 型固有淋巴样细胞(ILC3)和Th17 细胞,通过血液循环从肠道直接迁移到呼吸道,参与哮喘的发病过程[26]。研究表明,通过给一只小鼠腹腔注射细胞因子IL-25,激活其肠道的炎症性ILC2,将ILC2 移植至正常小鼠体内可观察到ILC2 细胞向肺部迁移[26-27],但若是小鼠在注射IL-25 后服用抗生素并感染巴西拟青霉(Penicillium),则迁移现象并不明显[27],该实验证实了免疫细胞迁移可以依赖于微生物群。免疫细胞在肠道和肺部之间的转移可能会增强宿主抵抗感染的能力,例如,肠道DCs 调控表达白介素22(IL-22)的ILC3 迁移到肺部并介导对炎症的保护,该过程需要依赖于肠道共生菌的参与[28]。然而,这样的串扰也可能在疾病中发生,因为SFB特异性Th17 细胞带有双重T 淋巴细胞抗原受体,一个是SFB特异性的,另一个是自身抗原特异性的,其迁移到呼吸道并且会促进肺部病理性损伤加重[29]。
2 肠道菌群代谢物参与免疫调节机制
2.1 脂多糖或肽聚糖 具有表达模式识别受体(如Toll 受体或核苷酸结合结构域、富含亮氨酸重复的受体)的宿主细胞——可溶性肠道微生物代谢物肽聚糖或脂多糖(LPS),经循环运输是肠道微生物和呼吸系统沟通的主要方式。经抗生素干预的小鼠直肠内注射LPS,可恢复其对流感病毒肺部感染的免疫反应能力[30]。LPS 失活小鼠在尘螨中产生Th2 细胞反应的能力降低,这表明具备生物活性的LPS 对哮喘具有预防作用[31]。不过,当研究人员给耗尽肠道微生物群的小鼠肠内注射LPS 时,这种预防作用就消失了[31]。这些实验反映了肠道微生物衍生的LPS 影响呼吸道对过敏原反应的能力。
2.2 短链脂肪酸 经微生物群代谢产生的短链脂肪酸(SCFAs),包括丁酸、丙酸和醋酸,释放至肠腔后,会在肠道形成局部免疫反应[32-33]。临床研究表明,1 岁时粪便中丁酸酯和丙酸酯含量较高的儿童患过敏性哮喘的概率显著降低,并且在其成长到3~6 岁时患哮喘的可能性较小[34]。不同于胃肠道的SCFAs 经门静脉输送到肝脏进行代谢,未代谢的SCFAs 进入外周循环和身体远端部位会影响免疫细胞的发育。研究证实,口服丙酸可以通过削弱对DCs 的招募,从而抑制Th2 细胞功能,进而减轻小鼠过敏性气道炎症[35]。在经万古霉素干预的口服丁酸盐、丙酸盐和醋酸混合物的小鼠中,也被证实DCs 功能减弱与肺部过敏反应相关[36]。在哮喘的小鼠模型中,喂食小鼠醋酸有利于Treg 细胞的分化[37]。另外,有研究结果提示SCFAs 可减轻鸡卵白蛋白(OVA)和屋尘螨(HDM)诱导的气道炎症模型的炎性反应[36]。此外,在妊娠和断奶期间小鼠口服SCFAs 可以保护后代免受过敏引起的肺部炎症,尤其是服用丁酸酯后,可有效诱导后代肺部的Treg 细胞增加[34]。
最新的证据表明“肺-肠轴”是双向的[38],例如LPS刺激小鼠肺脏可以导致肠道细菌数量显著增加[39],并且细菌性肺炎会导致肠道损伤[40]并减少肠上皮细胞增殖。此外,来自肠道细菌的SCFAs 通过与G 蛋白受体结合或通过羟甲基戊二酰辅酶A(HMGCoA)还原酶抑制甲羟戊酸途径来抑制先天免疫应答,发挥对肺部炎性反应的抑制作用[41]。其他已知具有免疫调节作用的肠道微生物代谢物,包括胆汁酸、吲哚衍生物(膳食色氨酸代谢产物)、烟碱、多胺(l-精氨酸代谢产物)、尿素A、丙酮酸和乳酸,在维持肠道内稳态中均有重要作用[42-45]。然而,这些肠道微生物代谢物是否影响呼吸系统健康仍有待确定。
3 益生菌改善哮喘的前景分析
应用益生菌对呼吸系统疾病的预防和治疗已有文献报道[46-47]。使用益生菌或益生元防治儿童哮喘已开展了多项随机对照试验(RCT)。2020 年一项荟萃分析显示,应用益生菌可以显著降低特应性哮喘婴儿的喘息发生率[48]。此外,应用双歧杆菌和乳酸乳球菌(Lactococcus lactis)能够诱导产生IL-10,并参与抑制Th2 细胞因子IL-5 和白介素13(IL-13)的表达[49-51],这些免疫细胞因子的改变有助于预防或治疗过敏性哮喘。然而,也有研究表明在产前或产后使用乳杆菌(Lactobacillus)和双歧杆菌对儿童哮喘发生率无显著影响[49,52-62]。动物研究中,口服鼠李糖乳杆菌(Lactobacillus rhamnosus)[63-64]、罗伊氏乳杆菌(Lactobacillusreuteri)[65]、副干酪乳杆菌(Lactobacillus paracasei)[66]和双歧杆菌[63]已被证实能够减轻哮喘小鼠的肺部损伤,其主要机制是通过促进Treg 细胞和Th1 细胞的活性,从而发挥保护性免疫作用[63,67]。在OVA 诱导的小鼠哮喘模型中,益生菌降低了血清中特异性IgE 水平,减少了支气管肺泡灌洗液和血清中炎性Th2 细胞数量[68]。使用乳酸乳球菌NZ9000 减少了OVA诱导的哮喘大鼠支气管肺泡腔中嗜酸粒细胞的浸润,并降低了肺组织中IL-4 和IL-5 的表达以及血清中特异性IgE 的水平[69]。此外,益生菌对呼吸道病毒感染的保护作用在大量动物模型中已被证实,其主要机制是通过诱导相关抗体的产生[70]、提高自然杀伤细胞的活性[71]、分泌Ⅰ型干扰素和INF-γ[71-72],以及诱导生成具有抗炎作用的细胞因子如IL-10[73],发挥免疫调节作用。尽管诸多研究证明了,肠道菌群在调节免疫反应和预防过敏性哮喘方面具有较大潜力,但应用益生菌进行哮喘治疗的可行性以及有效性仍需深入探索。
4 展望
近20 年的研究使人们对肠道微生物在肺部疾病中的作用有了一定的认识,并明确了儿童哮喘发生发展与肠道微生物的密切关系,例如毛螺菌、瘤胃球菌、韦荣氏菌、粪杆菌和罗斯氏菌、双歧杆菌、阿克曼菌和粪杆菌在儿童肠道内丰度相对较低,且念珠菌和红酵母相对丰度较高时儿童特应性哮喘风险升高[4,6]。肠道菌群结构特征的改变将导致包括LPS、短链脂肪酸、氨基酸和胆汁酸在内的肠道细菌代谢产物含量变化,而这些代谢产物均已被证实能够作为内源性小分子参与哮喘疾病的发生,主要调控机制涉及了Th1/Th2 平衡、肺部免疫因子释放以及调节型T 淋巴细胞肺部迁移。但目前仍未开发出具体的预防和治疗策略,提示仍需通过更为深入的研究来发掘儿童哮喘和肠道微生物的深层联系。此外,肠道微生物的代谢物在儿童过敏性哮喘中的应用也值得研究和探讨。虽然使用益生菌具有防治过敏性哮喘的巨大潜力,但只有明确哮喘发生时肠道菌群的具体变化和调控机制,以及益生菌菌株和益生元类型,才能够合理的使用益生菌对抗哮喘导致的特定菌群失调。
作者贡献:崔天怡进行文章构思与设计,文献查询,论文撰写;刘佳蕊、吕彬进行了论文的修订,英文摘要的修订;高秀梅进行了文章质量控制;赵鑫负责文章审校,对文章整体负责,监督管理。
本文无利益冲突。

