EGFR-TKIs 联合抗血管生成药物治疗晚期 EGFR 突变型非小细胞肺癌患者疗效的Meta 分析
李勇,龙勇,赵冲,张冠卿,苏彦河
据最新研究统计,2020 年全球约有220 万新发癌症患者,新发肺癌患者占11.4%;全球每年180 万人死于癌症,肺癌死亡人数占20%[1]。非小细胞肺癌(NSCLC)约占肺部恶性肿瘤的85%,且大多数患者确诊时已处于中晚期,5 年生存率不足20%[2-3]。表皮生长因子受体(EGFR)突变在NSCLC 患者中相对常见,亚洲高达30%~50%的患者EGFR 突变阳性,最常见的EGFR突变类型为19外显子缺失和21外显子突变[4]。EGFR 酪氨酸激酶抑制剂(EGFR-TKIs)的疗效已被证明优于复发化疗或晚期肺癌化疗,显著提高了患者的无进展生存期(PFS)和总生存期(OS),因此EGFR-TKIs 已成为EGFR突变型晚期NSCLC 患者标准的治疗药物[5-6]。然而,绝大部分接受EGFR-TKIs治疗的患者最终会出现获得性耐药的情况,并且20%~30%的NSCLC 患者表现出对EGFR-TKIs 的原发性耐药[7]。相关研究证实,肿瘤实体组织中过度表达的血管内皮生长因子受体(VEGFR)和血管内皮生长因子(VEGF)可诱导新生血管,在促进肿瘤生长、转移等方面起到重要作用[8]。抗血管生成药物(VEGFR 单抗)可抑制VEGFR 与VEGF 识别、结合,使现有肿瘤血管退化,且可逆转肿瘤微环境的免疫抑制状态并抑制肿瘤血管的生成[9]。由于EGFR-TKIs 和VEGFR 单抗作用于肿瘤生长至关重要的两种不同途径,因此EGFR-TKIs 联合VEGFR 单抗治疗策略可能使晚期肺癌患者获益。日本的一项Ⅱ期临床研究表明,厄洛替尼联合贝伐珠单抗能够显著延长EGFR 突变晚期肺癌患者的PFS(16.4 个月vs 9.8 个月)[10]。然而美国的一项Ⅱ期临床研究发现,联合用药并没有使患者的PFS 获益(17.9 个月 vs 13.5 个月)[11],同时ZHAO 等[12]和SAITO 等[13]研究表明,联合用药并没有使19 外显子突变患者在PFS 方面获益。因此,联合用药在治疗晚期NSCLC 的疗效上存在争议。本研究对相关最新研究报道进行合并分析,以确定EGFR-TKIs 联合VEGFR 单抗治疗晚期NSCLC 的临床疗效和安全性。
1 资料与方法
1.1 文献检索策略 检索中国知网、维普网、万方数据知识服务平台、EMBase、PubMed 和The Cochrane Library 中有关联合用药治疗晚期EGFR 突变型NSCLC 患者的相关文献,检索时限均为建库至2021 年7 月,采用主题词和自由词相结合的方式进行计算机检索。中文检索词:“抗血管生成药物”“贝伐珠单抗”“安罗替尼”“阿帕替尼”“表皮生长因子受体酪氨酸激酶抑制剂”“靶向药”“吉非替尼”“厄洛替尼”“阿法替尼”“奥西替尼”“肺癌”“肺恶性肿瘤”“非小细胞肺癌”;英文检索词:“Angiogenesis Inhibitors”“bevacizumab”“An lotinib”“Apatinib”“EGFR-TKI”“Gefitinib”“Icotinib”“Afatinib”“Osimertinib”“lung tumor”“NSCLC”“non small-cell lung cancer”。
1.2 纳入标准与排除标准 纳入标准:(1)研究对象:患者经病理检查确诊为晚期NSCLC,且EGFR 基因突变阳性;(2)研究类型:随机对照试验(RCT);(3)联合给药组:EGFR-TKIs 联合VEGFR 单抗;(4)单药组:EGFR-TKIs;(5)结局指标:PFS、OS、客观缓解率(ORR)、疾病控制率(DCR)、3 级以上不良事件(AE)。排除标准:(1)重复发表文献、综述、个案报道、会议摘要等;(2)回顾性研究、单臂实验、动物实验;(3)既往接受过其他治疗方案、无法获取PFS、OS 等关键信息。
1.3 数据提取及质量评价 由两名研究者分别通过阅读全文对文章的关键信息进行提取,提取内容包括第一作者、国家、研究类型、疾病分期、治疗方案、性别、中位随访时间、病理类型、平均年龄、基因突变类型、结局指标;由两名研究者分别独立通过Cochrane 风险偏倚评价工具完成文章偏倚风险质量评价,如遇分歧则由其他研究者进行分析,最终共同协商讨论解决。Cochrane风险偏倚评价工具主要包括7个项目:随机序列产生、分配隐藏、研究和受试者设盲、结果盲法评价、数据完整性、选择性报告、其他偏倚。
1.4 统计学方法 利用STATA 15.0 统计软件进行Meta 分析。生存分析采用风险比(HR)及95%置信区间(CI)作为效应分析统计量,二分类变量采用相对危险度(RR)及95%CI 作为效应分析统计量。采用χ2检验对纳入研究进行异质性分析,并利用I2量化异质性:若P>0.1 且I2≤50%,则认为各研究间异质性较低,采用固定效应模型;若P ≤0.1 且I2>50%,则认为各研究间异质性较高,采用随机效应模型;对于异质性较大的效应量,采用敏感性分析评价研究可靠度;采用Egger's 法分析文献的发表偏倚。以P<0.05 为差异有统计学意义。
2 结果
2.1 文献筛选流程及检索结果 初步检索共获得相关文献2 230 篇,其中重复文献775 篇,根据纳入、排除标准去重、初筛和全文筛选,最终纳入文献9 篇[10-18],患者1 553 例(文献[10,14,17]采用同一研究样本)。文献筛选流程见图1。2.2 纳入文献基本特征 纳入9 篇文献[10-18]均为RCT,其中4 篇[12-13,16,18]为Ⅲ期临床研究,5 篇[10-11,14-15,17]为Ⅱ期临床研究;6 篇[10-11,13-14,17-18]为贝伐珠单抗联合厄洛替尼,1 篇[12]为阿帕替尼联合吉非替尼,1 篇[15]为贝伐珠单抗联合吉非替尼,1 篇[16]为雷莫芦单抗联合厄洛替尼。按照Cochrane 风险偏倚评价工具对文章进行质量评价,主要包括:随机序列产生、隐蔽分组、盲法、结果数据完整性、选择性报告研究结果、其他偏倚来源。质量评价结果以“低风险”“有一定风险”和“高风险”表示,本研究中“低风险”和“有一定风险”所占比例高于“高风险”。本研究纳入文献质量较高。纳入文献的基本特征见表 1,文献偏倚风险评估见图 2。

表1 纳入文献的基本特征Table 1 Basic characteristics of the included randomized controlled trials
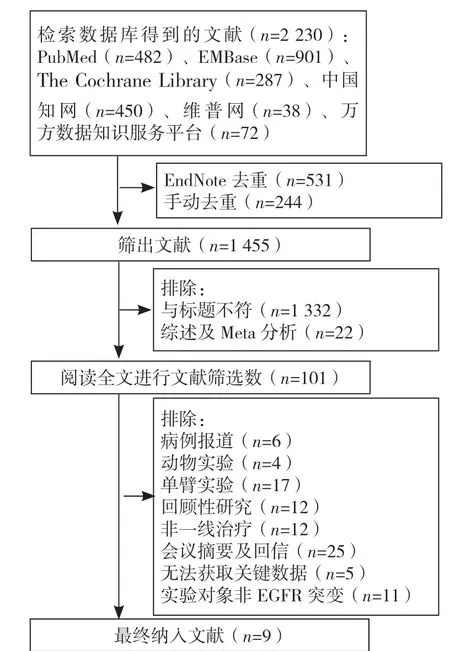
图1 文献筛选流程图Figure 1 Flow chart of literature screening
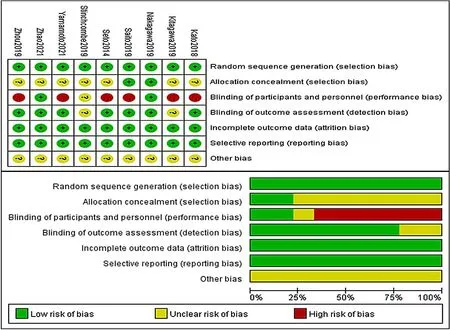
图2 文献偏倚风险评估Figure 2 Bias risk assessment of the included randomized controlled trials
2.3 Meta 分析结果
2.3.1 PFS 共6 篇文献[10-13,16,18]报道PFS。行异质性检验,I2=0%,P=0.608,采用固定效应模型进行Meta 分析,结果显示,联合给药组PFS 较单药组延长,差异有统计学意义〔HR=0.61,95%CI(0.54,0.70),P<0.001〕,见图3A;将联合给药组与单药组PFS 按年龄、性别、基因突变位点、疾病分期、ECOG 评分、是否吸烟、是否发生脑转移、是否发生肝转移、是否发生胸腔积液的临床特征进行亚组分析,结果显示,两组在年龄≥65 岁和是否发生脑转移亚组的差异无统计学意义(P>0.05);联合给药组PFS 在年龄<65 岁、不同性别、基因突变位点情况、疾病分期情况、ECOG 评分情况、吸烟情况、发生肝转移情况、胸腔积液发生情况较单药组延长,差异有统计学意义(P<0.05),见表2。
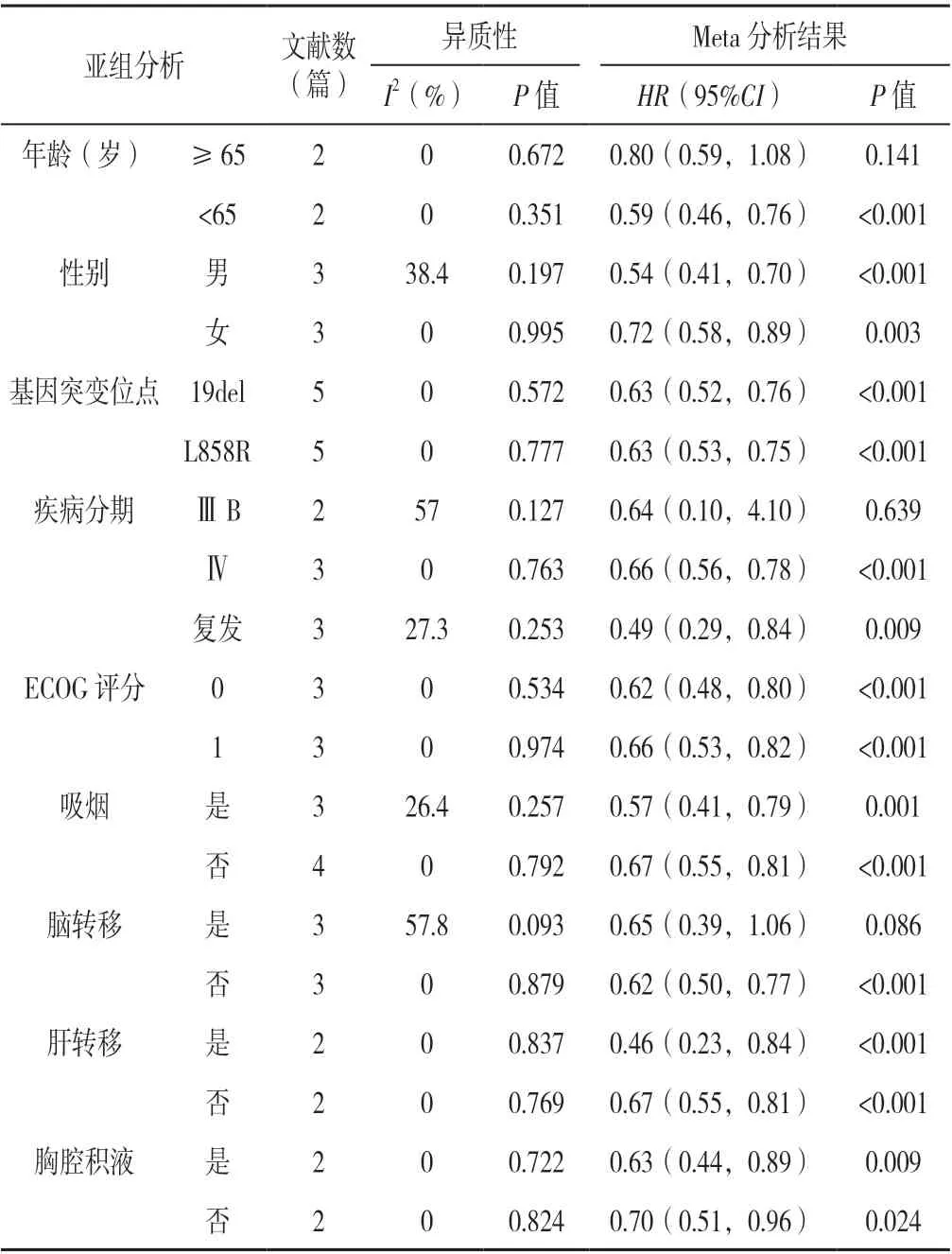
表2 联合给药组和单药组无进展生存期的亚组分析Table 2 Subgroup analysis of progression-free survival between combination therapy group and monotherapy group
2.3.2 OS 共4 篇文献[10-12,16]报道OS。行异质性检验,I2=0%,P=0.452,采用固定效应模型。结果显示,联合给药组与单药组OS 比较,差异无统计学意义〔HR=0.95,95%CI(0.76,1.21),P=0.697〕,见图3B。

图3 联合给药组和单药组无进展生存期(A)和总生存期(B)比较的森林图Figure 3 Forest plot of the progression-free survival(A)and overall survival(B)between combination therapy group and monotherapy group
2.3.3 ORR 共7 篇文献[11-13,15-18]报道ORR。行异质性检验,I2=0%,P=0.991,采用固定效应模型进行Meta 分析,结果显示,联合给药组ORR 与单药组相比,差异无统计学意义〔RR=1.04,95%CI(0.99,1.10),P=0.139〕,见图4A。
2.3.4 DCR 共5 篇文献[12-13,16-18]报道DCR。行异质性检验,I2=47.7%,P=0.105,采用固定效应模型进行Meta 分析,结果显示,联合给药组DCR 与单药组相比,差异无统计学意义〔RR=1.00,95%CI(0.97,1.03),P=0.920〕,见图4B。
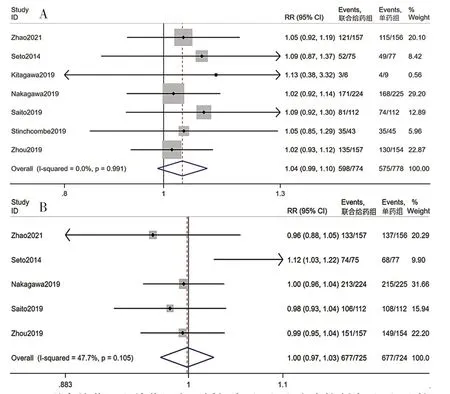
图4 联合给药组和单药组客观缓解率(A)和疾病控制率(B)比较的森林图Figure 4 Forest plot of the objective response rate(A)and disease control rate(B)between combination therapy group and monotherapy group
2.3.5 3 级以上AE 发生率 共6 篇文献[11-14,16,18]报道3 级以上AE 发生率。行异质性检验,I2=77.4%,P<0.001,采用随机效应模型进行Meta 分析,结果显示,联合给药组3 级以上AE 发生率高于单药组,差异有统计学意义〔RR=1.77,95%CI(1.62,1.94),P<0.001〕,见图5;联合给药组高血压、腹泻、蛋白尿发生率较单药组升高,差异有统计学意义(P<0.05);两组出血、皮疹、食欲减退、白细胞计数降低、转氨酶升高发生率比较,差异无统计学意义(P>0.05),见表3。
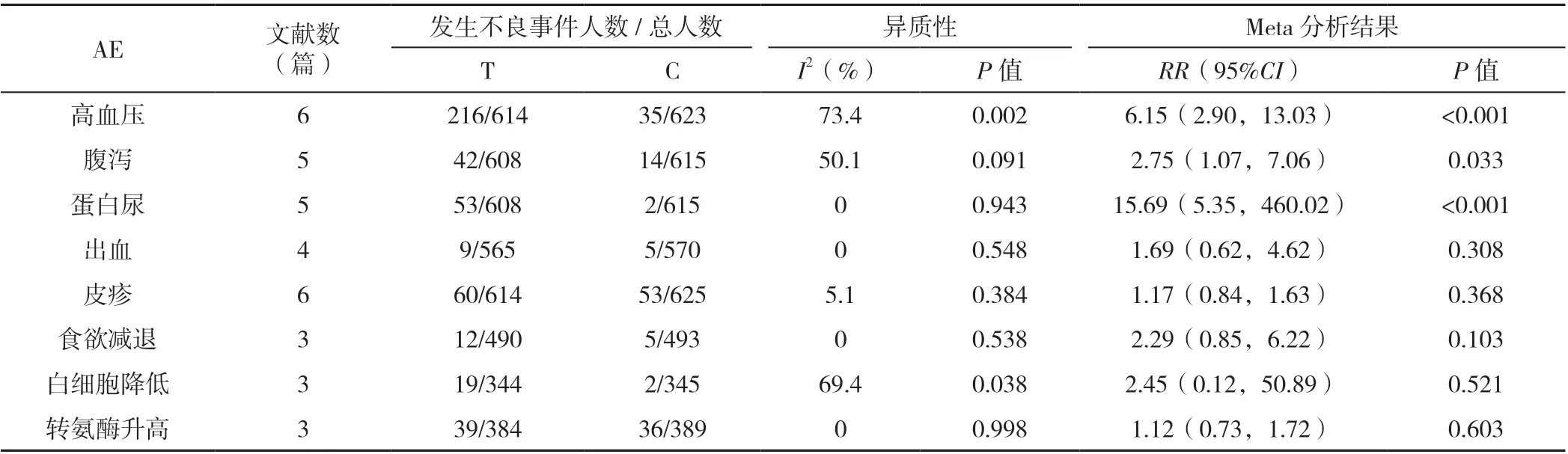
表3 3 级以上不良事件发生率Table 3 Incidence of adverse events above grade 3 in advanced EGFR-mutant NSCLC patients
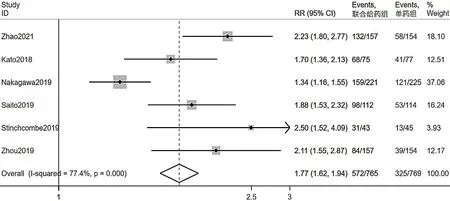
图5 联合给药组和单药组3 级以上不良事件发生率比较的森林图Figure 5 Forest plot of adverse eventsabove grade 3 between combination therapy group and monotherapy group
2.4 发表偏倚及敏感性分析 因本研究分析的结局指标所纳入的文献数有限(n<10),所以未用Egger's 法进行发表偏倚评价。对异质性明显的结局指标进行敏感性分析发现,逐一剔除单个研究并未对结果产生影响,提示各结局指标结论稳定可靠。
3 讨论
EGFR-TKIs 能延长晚期EGFR 突变型NSCLC 患者生存周期的优点已被研究证实[5-6],然而随着治疗周期的延长,绝大多数接受该疗法治疗24 个月的患者均出现耐药症状从而导致疾病发展[19],常见的耐药机制包括MET 基因扩增[20]、TP53 突变[21]、T790M 突变[22]、PD-L1 高表达[23]等,耐药具体机制尚未阐明,耐药个体化治疗相关研究正在开展。EGFR 激活主要导致肿瘤细胞增殖、浸润、转移和新生血管生成。VEGF 和VEGF 受体是肿瘤血管生成的关键调节因子[8,24-25]。EGFR 和VEGF 信号通路既独立又密切相关,其均可诱导Ras/Raf/MEK 信号转导通路的激活[26]。在EGFR 突变(EGFR-mutant)的NSCLC 细胞中,激活的EGFR 可以通过上调HIF1α 来诱导VEGF 的表达[27],同时高水平的VEGF可以通过激活MAPK、P13K/Akt 通路,代替EGFR 发挥促进肿瘤细胞生长和增殖的作用。EGFR 的激活不仅体现在实体肿瘤细胞上,也可体现在肿瘤新生血管内皮细胞上[28]。EGFRTKIs 抑制EGFR 磷酸化时,耐药细胞的VEGF 水平增加,高水平的VEGF 作用于上调的磷酸化ERK(pERK)和磷酸化AKT(pAKT)而诱导EGFR 获得性耐药[29]。基于以上理论知识,EGFR-TKIs 联合VEGFR 单抗治疗策略使NSCLC 中的两种信号传导均得到充分抑制,EGFR/VEGF 通路的双重抑制可能推迟耐药性产生。
分析EGFR-TKIs 联合VEGFR 单抗治疗策略的最新研究数据及研究成果后发现,共有4 项RCT[10-12,16]报道了OS 相关数据,其余3 项RCT[13,15,18]的OS 数据未成熟,合并后显示,患者在OS 上并未从联合治疗方案中获益。然而,EGFRTKIs 联合VEGFR 单抗方案显著延长了患者的PFS,同时按照年龄、性别、基因突变位点、疾病分期、ECOG 评分、是否吸烟、是否发生脑转移、是否发生肝转移、是否发生胸腔积液等临床特征对PFS 进行亚组分型发现,年龄≥65 岁和发生脑转移的患者未能从联合给药组中获益,其余亚组分型结果与总合并结果一致。然而FENG 等[30]研究表明,贝伐珠单抗联合EGFR-TKIs 组的颅内控制率高于EGFR-TKIs 单药组(80% vs 43%),且新发脑转移(38% vs 71%)更少,颅内病变的疾病进展时间(TTPD)延长(49.1 个月vs 12.9 个月)。JIANG 等[31]对EGFR 突变伴脑转移的晚期患者的回顾性研究表明,联合用药不仅能提高患者的PFS,还与更好的颅内ORR 有关。由于本研究中年龄≥65 岁亚组(2 项研究[12,16])和发生脑转移亚组(3 项研究[12-13,18])所纳入的研究数量有限,样本量偏少,可能对结果产生偏倚,因此对于以上亚组分析结果需要谨慎,可能需要进一步的临床研究加以验证。
凌丰宇等[32]Meta 分析显示,联合用药不仅能延长患者PFS,还能改善患者疾病的ORR 和DCR。然而本研究显示,患者接受联合治疗方案后DCR 和ORR 并未得到明显缓解。胥昕怡等[33]和DENG 等[34]荟萃分析也显示,联合方案能够使患者在PFS 上获益,但并未改善患者的DCR 和ORR,本研究结果与之相符,出现不同的原因可能是凌丰宇等[32]Meta分析共包含7 项RCT 试验(5 项来自中国,2 项来自日本),其中所纳入的5 篇中文研究质量较差,RCT 试验设计程序缺乏严谨性,这些可能会导致结果存在偏倚,缺乏可靠性。在安全性方面,本研究分析发现,联合给药组中3 级以上AE 发生率高于单药组,AE 具体分析结果显示,联合给药组高血压、腹泻、蛋白尿发生率要高于单药组,但是出血风险(发生任何出血事件)、皮疹、食欲减退、白细胞减低、肝功能受损等发生率未见明显区别。
本研究局限性:(1)所纳入的RCT 数量有限,可能导致结果偏倚;(2)除STINCHCOMBE 研究[11]中85%的患者为白人外,其他纳入研究的对象均来自中国和日本等东亚国家,可能存在人种偏倚;(3)因所分析的结局指标文献有限,未进行发表偏倚分析。
综上所述,尽管接受联合用药方案的患者并未在OS、ORR 以及DCR 等因素上获益,且同时伴随着严重的AE 风险增大,但联合用药方案在延长晚期EGFR 突变型NSCLC 患者PFS 方面的优势不容忽视。现如今有更多关于联合用药治疗晚期EGFR 突变型NSCLC 患者的前瞻性研究正在进行,相信联合用药方案最终能给患者带来更多的获益。
作者贡献:李勇进行文章的构思、设计与撰写;赵冲、张冠卿进行相关文献资料的检索和筛选,并对纳入文献进行质量评价;李勇、赵冲、张冠卿进行数据处理及绘制相关图表;龙勇、苏彦河负责文章的质量控制及审校,对文章整体负责。
本文无利益冲突。

