木犀草素通过减少心肌细胞凋亡和自噬减轻缺血再灌注大鼠心肌损伤
赵思宇 邵 珣
(舟山市岱山县中医院药剂科,舟山 316200)
缺血性心脏病早期及时再灌注是改善患者临床结局的有效方法[1]。心肌再灌注通过血管成形术或溶栓治疗迅速恢复血液供应,但会导致继发性级联损伤,即缺血再灌注 (ischemia-reperfusion, IR)损伤,从而加剧缺血性损伤,并进一步扩大梗死面积[2]。心肌IR损伤的发病机制涉及多个分子过程,例如活性氧 (reactive oxygen species, ROS) 积累和炎症细胞因子流入等。现代医学对于IR的干预方法包括缺血后适应和药物治疗,虽然对IR有不同程度的保护作用,但效果并不理想[3]。近年来,中医药在IR领域取得了一定的成果[4-5],成为了中西医结合研究的切入点之一。木犀草素(Luteolin,Lut)是从多种天然药材和果蔬中分离得到的黄酮类化合物,具有抗炎、抗氧化、抗肿瘤和抗病毒等多种药理活性。研究表明,木犀草素能降低冠心病患者的死亡率,抑制糖尿病心肌病的心肌损害,并对心血管有保护作用[6]。然而,木犀草素在心肌IR中的保护作用机制尚未完全阐明,故本研究观察木犀草素对大鼠心肌IR损伤的作用,并探讨其可能机制。
1 材料和方法
1.1 动物与试剂
健康雄性Sprague-Dawley(SD)大鼠,约12周龄,450~500 g,由温州医科大学动物实验中心(SYXK(浙)2018-0017)提供。所有动物被饲养在恒温(22℃±2℃)、湿度(45%±5%)、昼夜周期为12 h的笼子里,并随机给予标准的啮齿动物食物和水。木犀草素(纯度>98%)、戊巴比妥钠购自Sigma-Aldrich,木犀草素溶解在二甲亚砜(DMSO)中后,用PBS稀释。所有生化指标试剂盒购买于南京建成生物工程研究所。血浆白细胞介素-6(IL-6)、白细胞介素-1(IL-1)β和心肌肌钙蛋白T(cTnT)大鼠特异性酶联免疫吸附测定试剂盒购自武汉伊莱瑞特生物科技股份有限公司。LC3、p-AKT、AKT、p-mTOR、mTOR、p-STAT3、STAT3、Bax抗体购自Cell Signal Technology,p62、Bcl-2和caspase-9抗体购自Abcam,TUNEL试剂盒购自南京凯基生物公司。
1.2 动物模型建立及分组
将18只大鼠随机分为假手术(Sham)组、模型组(IR组)和木犀草素组(Lut组),每组6只。Lut组大鼠在IR前每天经胃灌服木犀草素溶液20 mg/kg,连续7 d,Sham组和IR组大鼠在IR前每天经胃灌服等量溶剂7 d。第8天,大鼠术前禁食12 h,腹膜注射3%戊巴比妥钠麻醉,仰卧固定在手术台上,连接四肢皮下心电图,监测动物心电图,剪断颈部毛皮,暴露气管,插管,连接小动物呼吸机(呼吸频率45~60次/分)。在胸骨左侧2~3 cm处切开皮肤,肌肉分别钝性分离,左侧切断第3~5根肋骨,暴露心。左冠状动脉前降支位于左心耳,在前降支下方约1~2 mm处插针,拔出第3~0根缝线,Sham组只穿线不结扎150 min。IR组同Sham组,用3~0丝线穿入冠状动脉左前降支,在左冠状动脉前降支上放置一根长约1.0 cm的聚乙烯塑料细管结扎。心电图显示Ⅱ导联ST段抬高,动脉闭塞下心肌呈紫色。30 min后切断缝线,开放血管,恢复供血(再灌注)120 min。造模过程中,结扎30 min,Ⅱ导联ST段抬高,再灌注120 min心电图显示II导联部分压低,部分心肌由紫色变为暗红色,造模成功。Lut组手术方式与模型组相同。所有实验动物测量左心室相关指标:左室收缩末期压(LVSP)、左室舒张末期压(LVEDP)、+dp/dt max、-dp/dt max。
1.3 血浆促炎细胞因子及心肌损伤标志物检测
血浆IL-6、IL-1β和cTnT的水平按市售大鼠特异性酶联免疫吸附测定试剂盒的说明进行分析。血浆肌酸激酶同工酶(CK-MB)采用全自动分析仪检测。血浆超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)按南京建成生物工程研究所比色试剂盒检测说明书测定。
1.4 心肌组织活性氧(ROS)检测
二氢乙锭(dihydroethidium, DHE)用于测定ROS的产生。将不同组未固定组织的玻片与DHE(10 μmol/L)在磷酸盐缓冲液(PBS)中室温孵育30 min。然后,对载玻片进行清洗、固定、安装,并进行荧光显微镜分析。
1.5 心肌组织凋亡检测及透射电子显微镜分析
心组织固定在4%多聚甲醛中,石蜡包埋,5 μm厚切片,根据试剂盒说明采用TUNEL法检测心肌组织细胞凋亡。 TUNEL阳性细胞核百分比=TUNEL阳性核数/总核数×100。心组织样本固定,梯度乙醇脱水,1 μm切片,柠檬酸铅和乙酸铀染色后,用日立透射电子显微镜(HT7700)观察切片。
1.6 免疫印迹检测
用含有蛋白酶抑制剂的裂解缓冲液从心肌组织中分离蛋白质,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移到聚偏二氟乙烯(PVDF)膜上。使用一抗LC3、p-AKT、AKT、p-mTOR、mTOR、p-STAT3、STAT3、Bax、p62、Bcl-2和caspase-9孵育过夜。随后,将膜与HRP偶联二抗在室温下孵育1 h,使用增强的化学发光法检测蛋白质条带。GAPDH作为内参,用Image J软件量化各条带,目的条带与内参条带比值为各蛋白表达量。
1.7 统计学处理
使用SPSS 20.0进行统计学分析。符合正态分布的资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,然后进行Tukey’s检验。P<0.05为差异有统计学意义。
2 结果
2.1 木犀草素预处理对缺血再灌注大鼠炎症反应和心肌损伤的影响
所有大鼠均在手术过程中存活。实验大鼠的炎症反应和心肌损伤指标如表1所示。与Sham组比较,IR组血浆IL-6、IL-1β、CK-MB和cTnT水平均显著升高(P<0.05)。与IR组比较,Lut组预处理显著降低了IL-6、IL-1β、CK-MB和cTnT水平(P<0.05)
表1 各组大鼠血浆促炎细胞因子和心肌损伤标志物水平比较(±s)

表1 各组大鼠血浆促炎细胞因子和心肌损伤标志物水平比较(±s)
#P<0.05, ###P<0.001 vs Sham组; *P<0.05, ***P<0.001 vs IR组
组别IL-6(pg/m L)IL-1β(pg/m L)CK-MB(U/L)cTnT(pg/mL)Sham组1.13±0.545.16±3.5816.87±3.6621.09±4.68 IR组158.23±58.09###43.41±38.31#845.91±194.34###539.65±118.20###Lut组83.74±47.26*3.49±3.48*57.98±30.68***284.23±265.96*
2.2 木犀草素预处理对缺血再灌注大鼠ROS的影响
与Sham组比较,IR组血浆MDA水平显著上升,而SOD水平则显著降低(P<0.05,表2)。与IR组比较,Lut组预处理显著降低MDA,提高了SOD、GSH-Px水平。此外, Sham组检测到较弱的荧光(19.22%),IR组的荧光强度(38.71%)显著增强,而Lut组的荧光强度(24.15%)较IR组显著降低(图1,P<0.05)。
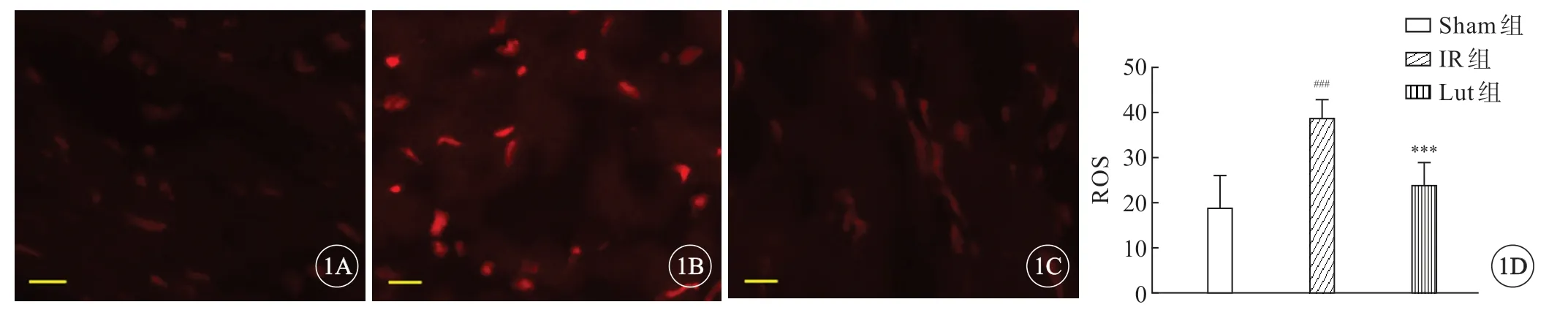
图1 木犀草素预处理对缺血再灌注大鼠ROS的影响,标尺=20 μm。A:Sham 组; B:IR 组;C:Lut组;D:半定量分析。###P<0.001 vs Sham 组; ***P<0.001 vs IR 组.
表2 各组大鼠血浆氧化应激标志物水平比较(±s)

表2 各组大鼠血浆氧化应激标志物水平比较(±s)
##P<0.01, ###P<0.001 vs Sham 组; *P<0.05, **P<0.01 vs IR 组
组别SOD(U/m L)GSH-Px(U/L)MDA(nmol/m L)Sham组29.68±8.43771.79±154.554.38±0.74 IR组14.47±1.62##803.08±137.3413.00±3.62###Lut组25.87±9.75*1135.9±105.23**8.90±2.84*
2.3 木犀草素预处理对缺血再灌注大鼠心肌细胞凋亡的影响
结果(图2A)显示,在 Sham组的心肌组织中检测到很少的凋亡心肌细胞(1.13%),但在 IR组中观察到大量 TUNEL 阳性心肌细胞(6.82%),2组间差异有统计学意义(P<0.001),Lut组TUNEL阳性细胞(1.64%)较IR组显著减少(P<0.01)。此外,免疫印迹检测凋亡标志物结果显示,Lut组显著降低IR诱导的促凋亡蛋白Bax,裂解caspase-9的表达,增加抗凋亡蛋白Bcl-2的表达,降低Bax/Bcl-2比值(P<0.05,图2B)。

图2 木犀草素预处理对缺血再灌注大鼠心肌细胞凋亡的影响。A:TUNEL评估心室组织中的心肌细胞凋亡,标尺=20 μm;B:免疫印迹评估 Bax、Bcl-2 和裂解 caspase-9 的蛋白水平。#P<0.05, ###P<0.001 vs Sham 组; *P<0.05, **P<0.01, ***P<0.001 vs IR 组.
2.4 木犀草素对缺血再灌注大鼠心肌细胞自噬的影响
电镜分析结果显示(图3),与Sham组比较,IR组心肌细胞自噬体数量增加,Lut组自噬体数量明显减少。此外,免疫印迹结果显示Lut组可以显著降低自噬标志物LC3的水平,同时增加p62的水平(P<0.05,图3B)。

图3 木犀草素对缺血再灌注大鼠心肌细胞自噬的影响
2.5 木犀草素对缺血再灌注大鼠AKT/mTOR/STAT3信号通路的影响
与Sham组比较,IR组显著降低了AKT和mTOR的磷酸化(P<0.05),而STAT3的磷酸化差异无统计学意义(P>0.05)。此外,与IR组比较,Lut组显著增加AKT、mTOR和STAT3的磷酸化水平(均P<0.05,图4)。

图4 木犀草素对缺血再灌注大鼠AKT(A)、mTOR(B)、STAT3(C)信号通路的影响
3 讨论
木犀草素可能对心血管疾病有保护作用,包括动脉粥样硬化、心肌缺血再灌注损伤、高血压、心肌肥厚和心力衰竭等[6]。研究表明,IR 损伤会在数小时内诱导自由基形成和炎症,导致氧化剂和炎症介质的过量产生[7]。氧化应激和炎症是心肌 IR损伤发病机制中的重要过程[8]。此外,心肌 IR 会引起炎症细胞因子(如IL-6 和 IL-1β)过量产生,IL-6 和 IL-1β 是主要来自冠状血管内皮的促炎因子,通过促进内皮细胞和中性粒细胞粘附而加重心肌损伤[9]。据报道,木犀草素通过抑制炎症和氧化应激在心血管疾病中起到保护作用[6]。刘方圆等[10]的研究结果也提示,木犀草素降低心肌梗死小鼠中的炎症细胞因子TNF-α、IL-6 和 IL-1β。此外,体外实验证明,木犀草素降低由缺氧-复氧培养所引起的H9c2心肌细胞的氧化应激水平,保护心肌细胞免受缺氧-复氧损伤[11]。本研究结果表明,木犀草素预处理可显著降低IR所致心肌损伤的CKMB、cTnT、MDA、IL-1β和IL-6水平,同时增加SOD和GSH-Px水平,提示木犀草素预处理可能是预防IR心肌损伤的有效治疗方法。
缺血引发心肌细胞凋亡,然后通过再灌注扩大并部分导致心脏死亡[12]。据报道,IR 损伤显著诱导心肌细胞凋亡,增加Bax和降低Bcl-2蛋白表达[10]。而Lut可通过上调Bcl-2/Bax来减少心肌细胞凋亡[10]。本研究中,TUNEL染色和凋亡标志物的检测表明,Lut处理后凋亡细胞数量减少,裂解caspase-9表达下调,Bcl-2 的表达降低和Bax 表达增加。此外,自噬是一种重要的降解过程,参与依赖溶酶体的受损细胞内胞浆蛋白和细胞器的周转,对于维持正常的细胞功能至关重要[13]。IR可通过改变心肌自噬而导致心肌损伤。本研究观察到IR显著增加了自噬小体的积累,提高了LC3水平,同时降低了p62水平。研究还表明,木犀草素可以显著降低自噬小体的数量和LC3水平,提高p62水平。这与之前的研究结果一致,木犀草素可抑制LPS诱导的大鼠心肌自噬体的形成,并下调LC3Ⅱ蛋白表达[13]。
木犀草素可通过激活重要的信号通路减少氧化应激和细胞凋亡,从而对IR损伤具有保护作用。木犀草素预处理通过清除细胞外ROS 和调节细胞凋亡来减轻皮肤 IR 损伤,其机制部分是通过激活 PI3K/AKT 通路[14]。此外,木犀草素可通过激活 Akt来减少氧化应激并减轻心IR 损伤[15]。AKT激活可以降低促凋亡蛋白Bax的水平,增加抗凋亡蛋白Bcl-2的产生,可抑制 IR 损伤中的细胞凋亡[14,16]。本研究表明,木犀草素可以减少IR大鼠心肌细胞内ROS的生成和抑制凋亡和自噬,这些变化可能受AKT和STAT3通路的调节。STAT3的激活可以导致STAT二聚体的形成,该二聚体移位到细胞核中,促进抗氧化基因的表达,从而导致氧化应激。另一方面,已证明 STAT3 在IR损伤、细胞凋亡、肥大、心力衰竭和产后心肌病中发挥作用,STAT3的激活减少IR损伤后心肌细胞凋亡[17]。以上结果表明木犀草素在大鼠心肌IR中可以作为一种抗凋亡药物用于心脏保护。此外,木犀草素可以增加p-mTOR水平,并对脑缺血再灌注具有保护作用[18]。mTOR介导的自噬是缺血性心脏病发病过程中经典的自噬激活途径之一,与心肌细胞存活调控机制密切相关[19]。本研究结果显示p-mTOR在IR组下调,而在Lut组显著上调,提示mTOR信号转导参与了木犀草素抵抗IR诱导的自噬。因此,木犀草素可以通过减轻IR中的自噬,从而减轻心肌损伤。
综上所述,木犀草素可显著降低心肌损伤标志物(CK-MB和cTnT)、氧化应激标志物(MDA)和促炎细胞因子(IL-6和IL-1β)水平,增加了氧化应激标志物SOD和GSH-Px的水平,其机制可能是通过AKT和STAT3途径抑制体外循环心肌细胞超氧化物生成和凋亡,以及通过mTOR途径抑制IR大鼠心肌细胞自噬。木犀草素可能通过抑制氧化损伤、细胞凋亡和自噬而成为心肌IR大鼠中的保护因子。

