黄芪总黄酮对肝硬化大鼠肝组织病理、代谢指标及NF-κB表达的影响
张 峰 李 燕 李伟华
(济南市人民医院病理科,济南 271100)
肝硬化(hepatic cirrhosis)是由各种慢性肝病发展到肝纤维化后逐渐演变的过程[1]。机体肝硬化之后导致各种严重的不良后果[2-3]。肝硬化的形成是一个循序渐进的过程,最终肝变形变硬形成肝硬化[5-6]。肝功能受损或病情发展严重到肝硬化时,血液中谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(alanine transaminase,ALT)、总胆红素(total bilirubin,TBIL)水平均升高。当肝受到刺激时,机体做出一系列反应,过度应答会出现全身变化,活化的巨噬细胞会释放大量肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素6(IL-6)等细胞因子,κ基因结合核因子(nuclear factor-κ-gene binding,NFκB)水平也会随之升高。还可诱导炎性因子IL-6的产生,参与肝内炎性损伤过程[6]。中药在治疗各种疾病方面都起到良好的作用。黄芪味甘性温是临床常用中药材之一,具有固表补气、升阳举陷、利尿消肿等作用[7-8]。现代药理研究发现,黄芪具有保护腹膜、肝脏、心脑血管等功效,对肺功能及利尿等方面有一定的改善效果[9]。因此本研究探讨黄芪总黄酮对肝硬化大鼠肝组织病理、代谢指标以及NF-κB的影响。
1 材料和方法
1.1 实验大鼠与试剂
35只SD大鼠,购买于南京君科生物工程公司,体质量190~210 g,分7笼饲养,室温24℃±1℃,湿度45%~50%,大鼠活动饮水自由。
黄芪总黄酮购于浩翔生物(宝鸡);四氯化碳购于亿德瑞生物公司(大连);美他多辛片购买于震元制药公司(浙江);TRIzol试剂盒购买于百泰克生物公司(无锡);酶联免疫试剂盒购买于艾博因生物科技(江西);一抗、二抗购买于西格生物科技(上海);全自动生化仪购买于赛谱分析仪器公司(滕州)。
1.3 动物分组与肝硬化动物模型建立
将35只健康大鼠随机分为健康组、肝硬化组、低浓度黄芪总黄酮组(低浓度组)、高浓度黄芪总黄酮组(高浓度组)、美他多辛组,每组7只。除健康组外,给予其他组大鼠初次注射40%四氯化碳(carbon tetrachloride,CCl4)花生油溶液(0.3 mL/100 g)皮下注射,以后注射CCl4剂量依体质量变化调整,每周2次[10],一共注射21 d。观察大鼠肝肿胀度,取肝组织H-E染色。对比健康组及造模组指标,确定造模是否成功。
1.4 干预方法
建模后,肝硬化组每天给予四氯化碳花生油等量的橄榄油,每周2次,以后橄榄油剂量依体质量变化调整。肝硬化组用普通饲料及蒸馏水进行饲养。低浓度组给予黄芪总黄酮0.5 mg/kg灌胃;高浓度组给予黄芪总黄酮2.0 mg/kg灌胃;美他多辛组给予美他多辛片溶液0.15 mL/10 g灌胃。上述药物均1次/日,各组治疗2周后停止给药,健康组和肝硬化组给予同体积的生理盐水。
1.5 ELISA法检测大鼠肝功能AST、ALT、TBIL水平和血清 TNF-α、IL-6、IL-8、NF-κB、NF-κB p65水平
采大鼠腹腔静脉血,离心机离心(离心转数4 000 r/min,离心时间15 min)收集血清,应用全自动生化仪检测AST、ALT、TBIL 等水平,严格按照试剂盒说明书操作。
大鼠尾部取血2 mL,立即离心(3 500 r/min)取上清液,注入无菌试管中(肝素抗凝),室温静置1 h放入4℃冰箱,取血清采用ELISA检测TNF-α、IL-6、IL-8、NF-κB、NF-κB p65水平。
1.6 H-E染色检验大鼠肝组织病理形态
用戊巴比妥钠麻醉大鼠,处死后分离大鼠肝,取各组大鼠肝组织常规脱水,浸蜡,石蜡包埋,常规切片,二甲苯脱蜡,梯度乙醇水化,染色,脱蜡、水合,透明封片,光镜下观察大鼠肝组织形态学变化。
1.7 TUNEL法检测肝细胞凋亡情况
收集处理完的肝细胞,脱蜡后病理切片,严格按照细胞凋亡试剂盒操作,加入5 μL Annexin V-FITC和5 μL PI 2种染料染色混匀。再用筛网过滤,在室温条件下避光孵育30 min,然后用PBS洗涤3次,每次5 min,再滴加DAPI避光孵育 5 min,PBS再次清洗4次,每次5 min,用吸水纸吸去切片上的液体,之后用含抗荧光淬灭剂的封片液封片,在荧光显微镜下观察采集图像。
1.8 Realtime PCR 法检测大鼠肝组织中NF-κB p65、TNF-α mRNA表达
采用TRIzol法提取总RNA,无核酸酶溶解。将提取的RNA转录为cDNA,引物序列见表1。PCR反应条件:42℃ 60 min,72℃作用5 min,4℃终点。每个细胞设置6个复孔,以β- actin为内参,反应条件为95℃预作用3 min,95℃作用5 s,58℃退火,40个循环。采用2-△△CT法计算基因的相对表达量。

表1 引物序列
1.9 免疫印迹检测大鼠肝组织中NF-κB、TNF-α蛋白表达水平
各组大鼠肝组织加入少量胰蛋白酶消化后,加入蛋白裂解液快速混匀,离心后保留上清液,放置于75℃水浴10 min使蛋白变性后放入上样孔中,每组取5 μg蛋白进行电泳实验。将蛋白转移到PVDF膜TBS浸泡10 min,反复PBS冲洗,每次5 min,加入一抗NF-κB、TNF-α抗体(1∶500 )孵育过夜,后放入二抗辣根过氧化物酶标记羊抗兔IgG,(1∶2 000)杂交冲洗。浸入ECL工作液,成像系统对印迹条带的光密度进行分析。β-actin 作为内参,ECL化学发光试系统JY-Clear分析蛋白值。
1.10 统计学处理
采用SPSS 23.0统计学软件进行分析,各组大鼠AST、ALT、TBIL、炎性因子,各组大鼠TNF-α、NF-κB蛋白表达量等比较采用单因素方差分析,计量资料采用±s,以P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠肝功能AST、ALT、TBIL水平比较
与健康组相比,肝硬化组大鼠AST、ALT、TBIL水平明显升高(P<0.05)。与肝硬化组相比,低、高浓度组,美他多辛组各指标均显著下降(P<0.05)。与美他多辛组相比,低、高浓度组降低明显(P>0.05),低、高浓度组间差异无统计学意义(P>0.05)(表2)。
2.2 各组大鼠血清中TNF-α、IL- 6、IL-8、NF-κB水平比较
与健康组相比,肝硬化组TNF-α、IL- 6、IL-8、NF-κB水平明显升高(P<0.05)。与肝硬化组相比,低、高浓度组,美他多辛组水平明显降低(P<0.05)。与美他多辛组相比,低、高浓度组降低明明显(P<0.05),低、高浓度组相比无差异(P>0.05)(表2) 。
表2 各组大鼠血清ALT、AST、TBIL、TNF-α、IL-6、IL-8水平比较(n=7, ±s)
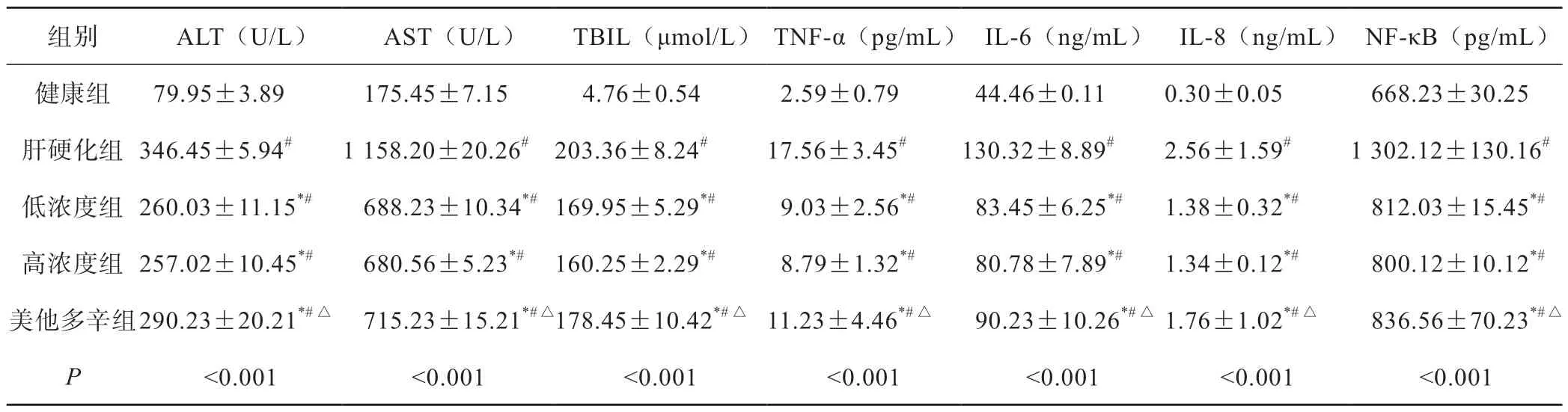
表2 各组大鼠血清ALT、AST、TBIL、TNF-α、IL-6、IL-8水平比较(n=7, ±s)
#P<0.05 vs 健康组;*P<0.05 vs肝硬化组;△P<0.05 vs 高浓度组
组别ALT(U/L)AST(U/L)TBIL(μmol/L)TNF-α(pg/mL)IL-6(ng/mL)IL-8(ng/mL)NF-κB(pg/mL)健康组 79.95±3.89 175.45±7.15 4.76±0.54 2.59±0.79 44.46±0.110.30±0.05 668.23±30.25肝硬化组346.45±5.94#1 158.20±20.26#203.36±8.24#17.56±3.45#130.32±8.89#2.56±1.59#1 302.12±130.16#低浓度组260.03±11.15*# 688.23±10.34*#169.95±5.29*# 9.03±2.56*# 83.45±6.25*#1.38±0.32*# 812.03±15.45*#高浓度组257.02±10.45*# 680.56±5.23*#160.25±2.29*# 8.79±1.32*# 80.78±7.89*#1.34±0.12*# 800.12±10.12*#美他多辛组290.23±20.21*#△ 715.23±15.21*#△178.45±10.42*#△11.23±4.46*#△ 90.23±10.26*#△1.76±1.02*#△ 836.56±70.23*#△P<0.001<0.001<0.001<0.001<0.001<0.001<0.001
2.3 各组大鼠肝组织病理形态学比较
健康组大鼠肝细胞结构完整、排列整齐,未见明显的细胞变性坏死及其他明显病理变化;肝硬化组大鼠肝汇管区、小叶间可见大量增生胶原纤维,肝组织出现明显的条索样改变,肝细胞出现明显脂肪变性;低浓度组、高浓度组、美他多辛组大鼠较肝硬化组肝组织纤维增生明显改善,肝小叶破坏得到改善(图1)。
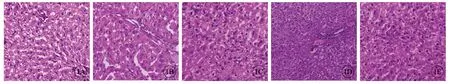
图1 H-E染色观察各组大鼠肝组织病理形态学比较,×200。A:健康组;B:肝硬化组;C:低浓度组;D:高浓度组;E:美他多辛组.
2.4 各组大鼠肝细胞凋亡情况比较
与健康组大鼠肝细胞凋亡数量(5±3)个比较,肝硬化组可见大量肝细胞凋亡(47±8)个。与肝硬化组相比,低浓度组、高浓度组和美他多辛组,肝细胞凋亡数均明显降低(P<0.05)。与美他多辛组大鼠肝细胞凋亡数量(28±8)个相比,低浓度组大鼠肝细胞凋亡数量(13±5)个和高浓度组大鼠肝细胞凋亡数量(14±3)个降低明显(P<0.05),高浓度组与低浓度组间差异无统计学意义(P>0.05)(图2)。
2.5 各组大鼠肝组织NF-κB、TNF-α、NF-κB p65蛋白表达水平比较
与健康组相比,肝硬化组大鼠肝组织中NF-κB、TNF-α及NF-κB p65蛋白表达水平明显升高(P<0.05)。与肝硬化组相比,低浓度组、高浓度组、美他多辛组大鼠肝组织中NF-κB、TNF-α、NF-κB p65蛋白表达水平明显下降(P<0.05)。与美他多辛组相比,低、高浓度组组NF-κB、TNF-α及NFκB p65蛋白表达水平降低明显(P<0.05),低、高浓度组相比无差异(P>0.05),说明黄芪总黄酮有较好的抗炎效果(图4、5)。

图4 各组大鼠炎性因子表达水平
2.6 各组大鼠肝组织中炎症因子NF-κB、NF-κB p65、TNF-αmRNA 表达水平比较
与健康组相比,肝硬化组肝组织中NF-κB、NF-κBp65及TNF-α mRNA 水平升高(P<0.05)。与肝硬化组相比,低、高浓度组,美他多辛组肝组织中NF-κB、NF-κBp65、TNF-αmRNA表达水平明显下降(P<0.05)。与美他多辛组相比,低、高浓度组降低明显(P<0.05),低、高浓度组相比无显著差异(P>0.05)(表3)。
表3 各组大鼠 NF-κB、NF-κB p65和TNF-α mRNA表达水平(n=7, ±s)
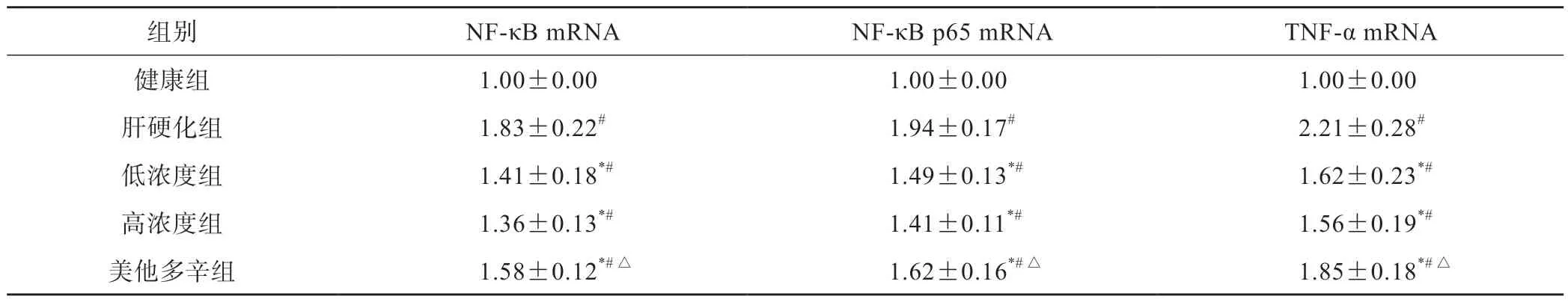
表3 各组大鼠 NF-κB、NF-κB p65和TNF-α mRNA表达水平(n=7, ±s)
#P<0.05 vs健康组;*P<0.05 vs 肝硬化组;△P<0.05 vs高浓度组
组别NF-κB mRNANF-κB p65 mRNATNF-α mRNA健康组1.00±0.001.00±0.001.00±0.00肝硬化组1.83±0.22#1.94±0.17#2.21±0.28#低浓度组1.41±0.18*#1.49±0.13*#1.62±0.23*#高浓度组1.36±0.13*#1.41±0.11*#1.56±0.19*#美他多辛组1.58±0.12*#△1.62±0.16*#△1.85±0.18*#△

图5 各组大鼠TNF-α、NF-κB和NF-κB p65表达水平
3 讨论
随着生活水平的提高,人们的生活习惯和饮食结构都发生了很大的改变,我国的肝硬化发病率也逐年增高。临床上导致肝硬化的原因很多,慢性肝病、长时间大量饮酒、滥用药物或者各种病毒感染均可导致肝硬化[11]。目前治疗肝硬化主要是给予抗病毒、保护肝脏、降酶等治疗,但是会存在一定不良反应[12-13]。随着中医药学的发展,自古黄芪无论是单味药应用还是联合应用都有良好的药用价值[14-17]。本研究探讨黄芪总黄酮对肝硬化大鼠肝组织病理、代谢指标及NF-κB的影响。
肝硬化的发病机制比较复杂,是多因素共同作用造成的,其中炎性反应是造成肝硬化发生的因素之一。炎症反应发生后产生细胞因子和趋化因子,导致各种免疫细胞调控组织进行损伤修复,IL-6、IL-8、TNF-α、NF-κB等均参与其中[18]。TNF-α是一种主要由活化的单核/巨噬细胞产生的重要促炎因子,与肝细胞表面受体结合,激活中性粒细胞,释放大量氧自由基直接造成肝细胞的损伤。TNF-α既可以导致肝细胞坏死,也可诱导其凋亡[21]。TNF-α还可以激活细胞因子级联反应,刺激IL-1和IL-8等的产生,进一步加重肝细胞的损伤或凋亡[20]。NF-κB是细胞中重要的转录因子,NF-κB是一种调控炎症反应的多向因子,参与多种炎性反应的过程。当细胞静息时,NF-κB处于非活性状态,当肝细胞受到刺激时即可激活NF-κB,使其发生转录。有研究表明CCl4诱导肝硬化过程中,CCl4可以改变肠黏膜的通透性,使内毒素增多,诱导NF-κB等转录因子核转位,从而释放TNF-α、IL-8、IL-6等大量炎症因子,从而造成肝细胞的损伤[21]。
有研究表明黄芪对肝纤维化、肝硬化有一定的治疗作用[22]。黄芪中含有多糖、皂苷类、黄酮类等多种成分,其中黄芪总黄酮具有清除自由基、抗病毒、抑制血管通透性等作用。黄芪总黄酮还能降低肝组织羟脯氨酸含量、减轻假小叶的形成,抗肝纤维化的作用。有研究表明,黄芪总黄酮通过调控LPS诱导的小鼠腹腔巨噬细胞p38MAPK信号通路以及相关蛋白表达,从而抑制IL-6、TNF-α、NF-κB的生成,发挥抗炎免疫作用[23]。张国欣等[24]将肝缺血再灌注损伤大鼠分成3组,其中黄芪组与模型组相比,黄芪组大鼠肝组织的IL-8、TNF-α、NF-κB的水平指标明显下降,说明黄芪可以抑制肝硬化大鼠TNF-α、IL-8和NF-κB的表达。本研究显示与健康组相比,肝硬化组TNF-α、IL- 6、IL-8和NF-κB水平明显升高,干预后,高浓度组大鼠各指标明显下降,说明黄芪总黄酮具有抗炎的效果。本研究与上述研究一致。
肝是人体代谢器官,肝硬化发生后会导致体内的各个指标代谢紊乱,同时肝血液生化指标也可以反映出肝损伤严重程度,其中主要反映肝细胞炎症损害的重要酶类有AST、ALT。而TBIL异常时,肝细胞损害对胆红素的摄取以及排泄功能降低。但肝受损害时,AST及ALT、TBIL指标升高。有研究显示肝硬化患者经过治疗后血糖、血脂、转氨酶等各指标均降低,肝硬化得到了一定程度的控制。中医认为黄芪具有升阳举陷、益气固表等功效,而现代医学研究表明黄芪具有保护肝脏、增强免疫力及抗菌等功效。有学者认为黄芪可能是通过调控p38MAPK 信号通路,降低血液生化中各个指标,从而对肝起到了保护作用[25]。鲍家卉等[26]报道,低、中、高浓度黄芪提取物均可以降低血清中谷丙转氨酶、谷草转氨酶以及肝中甘油三酯的含量,减轻了小鼠肝纤维化程度,对小鼠肝起到一定的保护作用。段文彪等[27]研究表明,鳖甲煎丸能显著改善肝硬化大鼠的肝损害,恢复肝功能。本研究经过干预后,与肝硬化组相比,高、低浓度组肝硬化大鼠血清中的AST、ALT、TBIL的水平明显下降。本研究与上述研究一致。
综上所述,通过探讨黄芪总黄酮对肝硬化大鼠肝组织病理、代谢指标及NF-κB的影响,表明黄芪总黄酮可以降低肝硬化大鼠的代谢指标,降低NF-κB的水平,从而达到治疗肝硬化的目的。

