富马酸替诺福韦二吡呋酯联合聚乙二醇化干扰素对肝硬化大鼠肝细胞凋亡、免疫功能及内毒素水平的影响*
闪海霞 卢瑞杰 颜成果 王 英 和青森 范崇桂
(南阳市中心医院感染性疾病科,南阳 473000)
在国内,肝硬化以乙型肝炎病毒为主[1]。该病早期无特异性特征,不易发现,一经确诊,多数已为晚期,治疗难度大,并伴有多种并发症产生[2-3]。肝硬化产生后会使肠道内的细菌过度生长,导致内毒素增加,加之肠黏膜机械屏障、免疫及生物屏障等功能破坏,内毒素吸收增多,肝对内毒素清除能力下降,从而加剧肝损伤[4]。因此改善肠黏膜损伤对阻止肝硬化发展具有一定的作用。目前,干扰素被广泛应用于慢性乙肝的治疗中,且效果较为显著,它具有抗病毒和免疫调节的双重作用,但其疗效有限,众多学者认为多种有效的抗病毒药的有效组合,是治疗慢性乙型肝炎的重要方案[5]。富马酸替诺福韦二吡呋酯(tenofovir disoproxil fumarate,TDF)是抗病毒药物的一种,常用于治疗慢性乙肝病毒[6]。因此采用TDF联合聚乙二醇化α干扰素-2b(PEGIFNα-2b)对肝硬化(代偿期)大鼠肝细胞凋亡、免疫功能及内毒素水平的影响进行研究。
1 材料和方法
1.1 实验动物与分组
SPF级健康SD大鼠55只,体质量220~300 g,由长沙天勤公司提供[生产许可证号:SCXK(湘)-2019-0001],常规饲养,自由取食、水。随机分为对照组(健康大鼠常规饲养)、模型组(肝硬化模型组)、TDF治疗组(肝硬化模型+TDF)、干扰素治疗组(肝硬化模型+PEG-IFNα-2b)、联合治疗组(肝硬化模型+TDF+PEG-IFNα-2b),每组11只。
1.2 实验试剂
TDF(成都倍特公司);PEG-IFNα-2b(厦门特宝生物工程股份有限公司);核苷酸混合缓冲液(珠海泛海公司);无热源肝素钠抗凝真空采血管(苏州灵岩公司);流式细胞仪(常州必达公司);枸橼酸修复液(南京巴傲得公司);乌拉坦(武汉梦奇公司)。
1.3 模型建立及实验动物分组
采用四氯化碳复合因素方法制造肝硬化模型[7],造模持续8周时间。建模成功次日对照组与模型组大鼠无处理,TDF治疗组大鼠给予27 mg·kg-1·d-1TDF灌胃;干扰素治疗组大鼠给予PEGIFNα-2b皮下注射16.2 μg/kg;联合治疗组大鼠给予PEG-IFNα-2b皮下注射16.2 μg/kg及27 mg·kg-1·d-1TDF灌胃,各药物干预组连续治疗12周,每周1次。
1.4 组织提取
各组于取材前12 h禁食水,末次给药后脱颈处死大鼠,于腹主动脉采集血液,后注入大量生理盐水灌流,剥离肝,取大鼠距回盲部15~20 cm处回肠组织,剔除周围多余组织,将肝组织与肠组织置于多聚甲醛液中固定备用。
1.5 鲨试剂显色基质法检测各组大鼠血清内毒素水平
各组大鼠用乌拉坦(25 %)麻醉后,用无热源肝素钠抗凝真空采血管取大鼠腹主动脉血2 mL,离心10 min(3 000 r/min),取上层血浆,鲨试剂显色基质法检测内毒素水平,实验严格按照说明书进行。
1.6 H-E染色检测各组大鼠肝及肠组织病理形态
取各组大鼠肝组织及肠组织各50 mg,4%多聚甲醛溶液固定,梯度乙醇脱水,石蜡包埋,常规切片,厚度为4 μm,后进行H-E染色。显微镜下观察病理形态。
1.7 脱氧核苷酸末端转移酶介导缺口末端标记法检测各组大鼠肝细胞凋亡
石蜡切片常规脱蜡至水,3%双氧水甲醇中浸泡10 min,PBS冲洗5 min×3次;蛋白酶K(15 μg/mL)37℃温箱中孵育7 min;20%胎牛血清室温下封闭20 min;用滤纸吸去残留液后滴加反应液50 μL(TdT3 μL,荧光素连接的核苷酸混合缓冲液47 μL,阴性对照片不加TdT),37℃温箱中孵育45 min,PBS冲洗5 min×3;20%山羊血清室温下封闭20 min,加POD转换剂(原液1∶2稀释),置于37℃温箱中孵育30 min,显微镜下DAB显色,苏木精复染,脱水,透明,封片。阳性部位在细胞核,显棕黄色或棕褐色。计数5个高倍镜视野下100个肝细胞核中阳性细胞的个数,取其均值为肝细胞凋亡指数(AI)。
1.8 流式细胞术检测各组大鼠肝组织免疫功能指标CD3+、CD4+、CD8+ T淋巴细胞数
取大鼠肝组织50 mg,剪碎,PBS清洗后收集清洗液80目筛网过滤,再用PBS洗涤离心重悬,接种于培养皿中,收集细胞,传代培养,将各组第3代肝细胞接种于5孔板中,48 h后收集细胞,PBS清洗,加入10%山羊血清4℃无光孵育0.5 h,PBS清洗,加入CD3、CD4、CD8抗体(1∶100),遮光孵育15 min,缓冲液洗涤。重悬后,检测指标表达。
1.9 免疫组织化学检测各组大鼠肝组织Bax、Bcl-2蛋白水平
取各组大鼠肝组织于10%甲醛溶液中固定,石蜡包埋,4 μm厚切片。切片,常规脱蜡至水,甲醇浸泡10 min。枸橼酸修复液微波炉中高火修复至冒泡后再低火修复20 min,冷却至室温,加Bax、Bc1-2一抗,置于4℃冰箱过夜。次日PBS冲洗5 min×3次,滴加二抗(两步法),37℃孵育30 min,PBS冲洗,DAB显色,苏木精复染,脱水,透明,中性树胶封片,显微镜下观察。Bax、Bcl-2蛋白表达阳性部位在细胞质,显棕黄色。每张标本切片随机选择5个高倍视野区域,计数阳性细胞数和总细胞数,计算阳性表达率。
1.10 统计学处理
采用SPSS 17.0统计学软件进行分析,符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血浆内毒素水平检测
对照组大鼠内毒素水平低于模型组(P<0.05),模型组内毒素水平高于TDF治疗组与干扰素治疗组(P<0.05)。TDF治疗组与干扰素治疗组内毒素水平比较无差异(P>0.05),联合治疗组内毒素水平低于干扰素治疗组及TDF治疗组(P<0.05)(图1)。

图1 各组大鼠内毒素水平对比
2.2 各组大鼠肝组织形态
H-E染色结果显示,对照组大鼠肝组织结构完整(图2A)。模型组大鼠肝细胞排列紊乱并发生坏死,有明显炎症细胞浸润(图2B)。与模型组肝组织病变相比,TDF治疗组(图2C)、干扰素治疗组(图2D)与联合治疗组(图2E)肝组织结构较为完整,肝细胞坏死减少,汇管区炎症细胞浸润也较模型组减轻,且以联合治疗组效果较为显著(图2,见封三)。
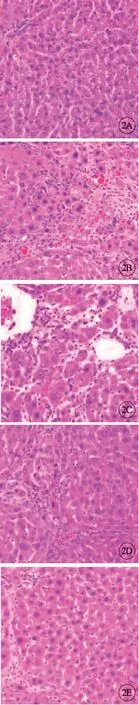
图2 各组大鼠肝组织形态对比,×200。A:对照组;B:模型组;C:TDF治疗组;D:干扰素治疗组;E:联合治疗组.
对照组大鼠回肠上皮结构完整(图3A);模型组大鼠回肠黏膜上皮细胞坏死,大量绒毛脱落,上皮下囊状间隙扩大,中央乳糜管扩张,固有层裸露,并伴有毛细血管扩张、充血(图3B);TDF治疗组(图3C)与干扰素治疗组(图3D)大鼠回肠黏膜上皮结构较完整,少数绒毛顶端脱落,上皮下囊状间隙较模型组有所改善,固有层仍见水肿。联合治疗组(图3E)大鼠回肠黏膜上皮结构较完整,绒毛顶端上皮下可见囊状间隙,并伴有毛细血管充血(图3,见封三)。
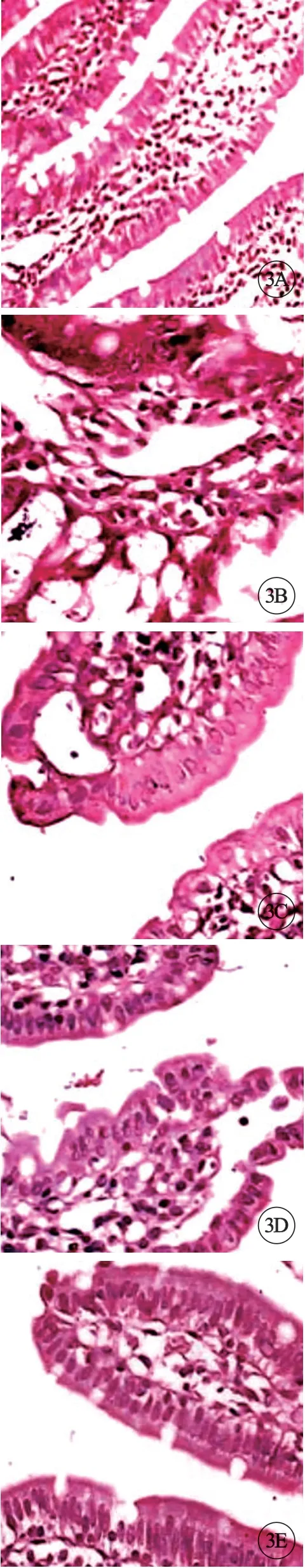
图3 各组大鼠肠组织形态对比,×200。。A:对照组;B:模型组;C:TDF治疗组;D:干扰素治疗组;E:联合治疗组.
2.3 各组大鼠肝细胞凋亡指数比较
对照组大鼠肝细胞AI值低于模型组(P<0.05),模型组AI值高于TDF治疗组(P<0.05)。TDF治疗组与干扰素治疗组AI值比较无差异(P>0.05),联合治疗组大鼠肝细胞AI值低于TDF治疗组、干扰素治疗组(P<0.05)(图4,见封三)。
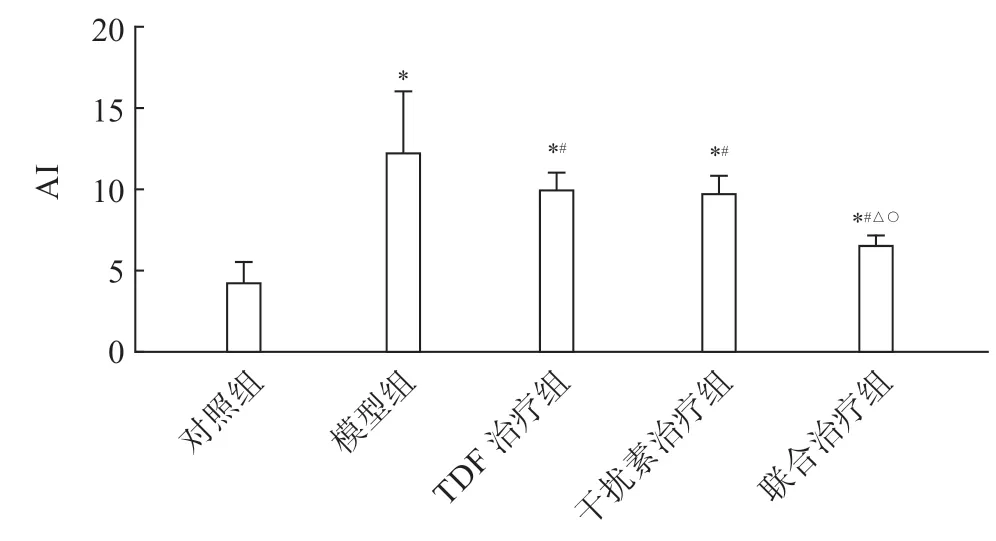
图4 各组大鼠肝细胞AI指数对比
2.4 各组大鼠免疫功能指标
与对照组相比,模型组大鼠肝组织中CD3+、CD4+T淋巴细胞数、CD4+/CD8+降低,CD8+T淋巴细胞数升高(P<0.05);与模型组相比,TDF治疗组、干扰素治疗组CD3+、CD4+T淋巴细胞数、CD4+/CD8+升高,CD8+T淋巴细胞数降低(P<0.05);TDF治疗组与干扰素治疗组大鼠免疫功能水平比较无差异(P>0.05);与干扰素治疗组及TDF治疗组相比,联合治疗组CD3+、CD4+T淋巴细胞数、CD4+/CD8+升高,CD8+T淋巴细胞数降低(P<0.05)(表1)。
表1 各组大鼠免疫功能指标对比(n=11, ±s)

表1 各组大鼠免疫功能指标对比(n=11, ±s)
*P<0.05 vs 对照组;#P<0.05 vs模型组;△P<0.05 vs TDF治疗组;£P<0.05 vs干扰素治疗组
组别CD3+ T淋巴细胞百分率(%)CD4+ T淋巴细胞百分率(%)CD8+ T淋巴细胞百分率(%)CD4+/CD8+对照组78.62±8.4158.31±5.9221.35±1.872.14±0.27模型组59.26±4.37*33.21±2.47*37.52±3.68*0.73±0.06*TDF治疗组65.24±6.06*#39.45±4.06*#30.41±3.12*#1.25±0.08*#干扰素治疗组66.37±5.18*#38.74±4.42*#29.68±3.54*#1.24±0.05*#联合治疗组70.45±6.72*#△£46.28±5.59*#△£26.41±2.79*#△£1.84±0.11*#△£
2.5 各组大鼠肝组织Bax、Bcl-2蛋白表达比较
与对照组相比,模型组Bax蛋白升高、Bcl-2蛋白降低(P<0.05)。与模型组相比,TDF治疗组与干扰素治疗组Bax蛋白降低、Bcl-2蛋白升高(P<0.05)。TDF治疗组与干扰素治疗组指标水平无差异(P>0.05)。与干扰素治疗组相比,联合治疗组TDF治疗组与干扰素治疗组Bax降低、Bcl-2升高(P<0.05)(图5,见封三,表2)。
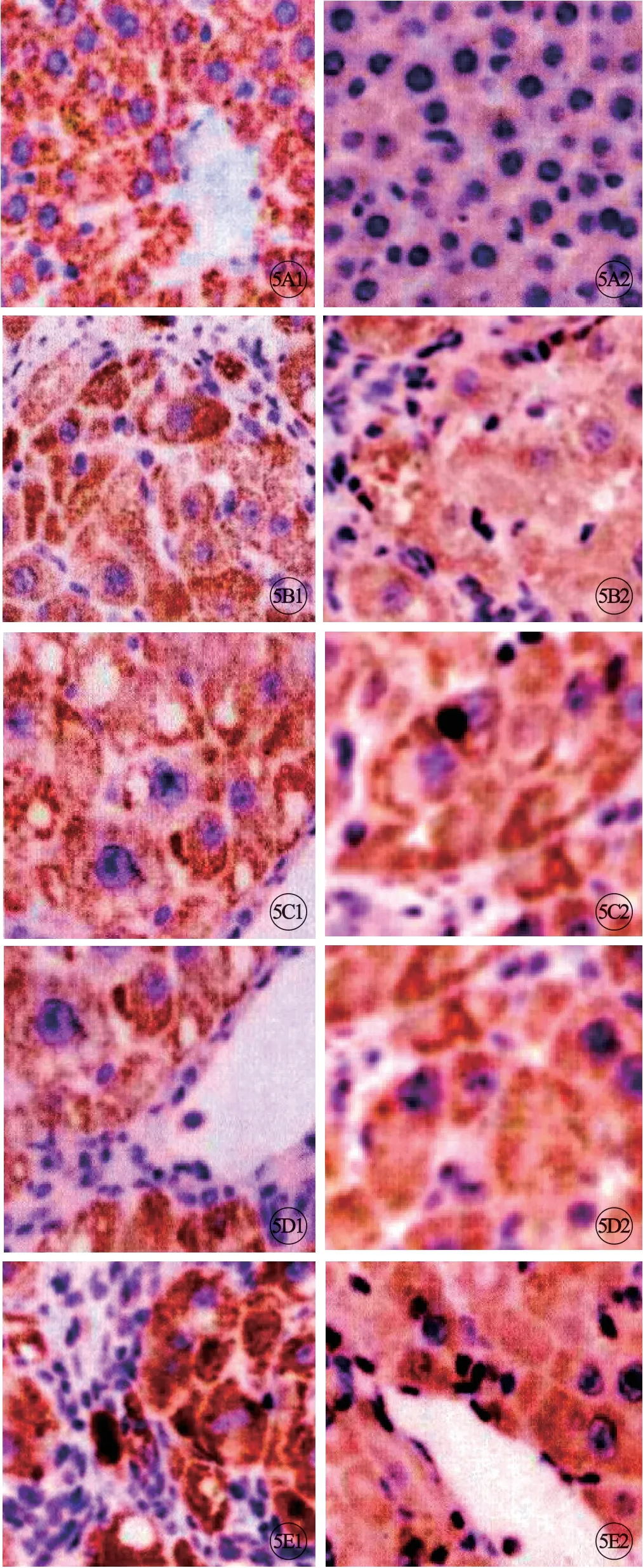
图5 各组大鼠Bax(A1~E1)、Bcl-2(A2~E2)水平对比。A:对照组;B:模型组;C:TDF治疗组;D:干扰素治疗组;E:联合治疗组.
表2 各组大鼠Bax、Bcl-2水平对比(n=11, ±s, %)

表2 各组大鼠Bax、Bcl-2水平对比(n=11, ±s, %)
*P<0.05 vs 对照组;#P<0.05 vs模型组;△P<0.05 vs TDF治疗组;£P<0.05 vs干扰素治疗组
组别BaxBcl-2对照组31.42±3.1538.46±2.87模型组87.65±7.41*32.15±2.19*TDF治疗组57.81±6.40*#48.43±4.12*#干扰素治疗组56.94±5.15*#49.38±3.74*#联合治疗组45.71±3.94*#△£57.26±4.85*#△£
3 讨论
在中国[8],肝硬化是消化系统的常见病,年发病率为17/10万,且多见于20~50岁的男性患者中,其中城市男性50~60岁的患病者的病死率高达112/10万。我国的肝硬化患者多为乙肝病毒感染所致,对于肝硬化的治疗仍至关重要。因此,本研究运用TDF联合PEG-IFNα-2b治疗肝硬化大鼠,并检测其对肝细胞凋亡、免疫功能及内毒素水平的影响。肝受到损伤因素影响后,原本存在于体内的肝细胞死亡程序可能被激活,进而引起肝细胞的程序性死亡(凋亡)。Bcl-2家族是目前研究较多的凋亡相关基因,Bax是该家族中促凋亡因子,常出现在肝细胞、血管平滑肌中。Bcl-2是抑凋亡因子,主要分布在细胞膜内表面、线粒体外膜等[9]。目前对于肝脏疾病的治疗,给予抗病毒持续治疗可阻止慢性肝病的发展,TDF是目前应用于慢性肝炎等疾病中较为广泛的抗病毒类药物,临床上已有多位研究者证实其通过改善患者肝功能水平,治疗乙型肝炎患者的病情严重程度。近年来干扰素对于肝硬化(代偿期)的治疗逐渐兴起,有研究表明[10],干扰素能够抑制成纤维细胞的增殖,降低转化生长因子β及I和Ⅲ型前胶原mRNA的表达,减少胶原的合成,从而具有抗纤维化作用,并已成功应用于肝纤维化等的治疗。本研究结果显示,与对照组相比,在经过TDF、PEG-IFNα-2b干预后,肝细胞凋亡及Bax降低、Bcl-2升高,且以两者联合治疗的效果更为显著。在刘浩等[11]对肝硬化大鼠的实验中提出,通过降低Bax、升高Bcl-2水平,减少肝细胞的凋亡,从而保护大鼠肝。Bcl-xl是Bcl-2家族成员之一,在夏六兵等[12]对肾癌细胞的研究中提出,PEG-IFNα-2b通过降低Bcl-xl,抑制环氧化酶-2的水平,加快肾癌细胞凋亡、抑制其增殖,减少肿瘤血管新生,改善病情严重程度。本研究与上述研究结果相似,因此笔者推测,联合治疗组效果更佳是由于联合了TDF所致,两者联合通过促进Bcl-2水平,抑制Bax表达,减少肝细胞凋亡。
机体在遭受手术或创伤后,会发生全身性的应激反应,这种应激反应除使机体蛋白质分解加速,产生负氮平衡外,还将造成机体的免疫抑制。机体免疫功能主要由T、B淋巴细胞控制,T细胞包括CD3+、CD4+、CD8+亚群,T淋巴细胞亚群在肝细胞损害,机体抗肿瘤免疫中起重要作用,为活跃的免疫活性细胞之一,不仅是细胞免疫的效应细胞,还有调节细胞免疫的作用[13]。免疫抑制表现为外周血中CD3+、CD4+T淋巴细胞数减少,这2个亚群均参与机体特异性细胞免疫反应,抑制淋巴细胞亚群CD8+增多,CD4+/CD8+比例降低[14]。CD8+T淋巴细胞数是机体发挥免疫抑制的关键,CD4+/CD8+是可客观体现肝癌术后患者免疫抑制程度的高低。PEG-IFNα-2b是重要的免疫调节剂,能够诱导Thl型细胞因子反应。它可以促进T细胞分泌Thl型细胞因子干扰素,并抑制其分泌白细胞介素5等Th2型细胞因子。已有研究证实[15],TDF联合PEGIFNα-2b通过改善肝功能,提高机体免疫水平,对乙型肝炎起到治疗的作用。本研究发现,与对照组相比,在经过TDF、PEG-IFNα-2b干预后,CD4+/CD8+水平升高,CD8+T淋巴细胞数水平降低。金国贤等[16]在运用中药治疗肝硬化肝癌大鼠的实验中提出,通过降低CD8+水平并提高CD3+、CD4+T淋巴细胞数、CD4+/CD8+水平后,改善了大鼠的免疫功能。马忠玉等[17]报道,PEG-IFNα-2b可有效抑制病毒复制,通过促进机体的免疫功能恢复,提高患儿的临床痊愈率。吴文豪等[18]对慢性乙型肝炎的研究中提出,中药联合TDF可有效改善肾功能,并通过降低CD8+T淋巴细胞数提高CD3+、CD4+T淋巴细胞数、CD4+/CD8+水平,提高机体免疫能力,预防肝纤维化。本研究与上述研究结果相似。
肝硬化时,患者肠道菌群紊乱,革兰阴性菌过度增殖,内毒素产生增多,通过受损黏膜进入体循环,形成内毒素血症。一方面,过表达的内毒素会损伤肠道黏膜,致使肠道菌群失衡,加重肝硬化损伤,另一方面,肠道过量的内毒素直接进入血液,可诱导一些炎症细胞因子的分泌,加剧对肝的损伤,对肝形成“二次打击”,进而加速了肝纤维化的发展。小肠黏膜的病理改变能够反应肝硬化内毒素血症的严重程度。因此调节肝硬化肠道微生态,将有助于改善肝硬化的进展和预后。付青青等[19]研究表明,去乳糖饮食联合重组人干扰素α1b可有效提高临床治疗效果,通过降低内毒素水平,减少肠粘膜损伤。本研究结果显示,与对照组相比,在经过TDF、PEG-IFNα-2b干预后,内毒素水平降低。寇永锋等[20]在肝硬化大鼠的研究显示,香胃联合方组通过改善肠黏膜损伤,降低内毒素水平,改善肝硬化严重程度。唐光群等[21]报道,聚乙二醇化干扰素可保护患儿的心肌功能,通过降低内毒素以及二胺氧化酶等水平,改善患儿肠粘膜损伤状态。本文研究与上述研究结果相似。对于TDF与内毒素或肠黏膜的关系,目前尚未见相关文献报道,因此推测,联合治疗组效果更佳可能是PEG-IFNα-2b联合TDF通过改善肠黏膜损伤,降低内毒素水平,缓解肝硬化病情严重程度所致。本研究H-E染色结果也可证实上述结论。
综上所述,TDF联合PEG-IFNα-2b通过提高免疫功能、降低内毒素水平以及减少肝细胞凋亡,改善肝硬化病情程度。