侧脑室注射microRNA-200c经PI3K/Akt/mTOR通路保护脑缺血再灌注损伤大鼠的机制*
黎玉环 熊光润 郑永强 李 敏
(宜昌市第二人民医院神经内科,宜昌 443000)
脑卒中是由于血管堵塞或破裂导致大脑供血不足引起脑损伤的一种急性脑血管疾病[1],包括缺血性和出血性两大类,其中缺血性脑卒中占80%以上[2]。缺血性脑卒中是一个复杂的生理病理过程,线粒体损伤、兴奋性氨基酸毒性、氧化应激、炎症反应等均会导致脑缺血损伤[3]。现阶段治疗急性脑出血的主要手段是在合适时间窗内溶栓,但此方案可能会进一步加重脑缺血所致的炎症及谷氨酸兴奋毒性,导致脑缺血再灌注损伤[4]。近十几年来,随着对缺血性脑损伤的不断探索,学者们发现,多种分子与缺血再灌注损伤过程中的炎症反应和神经元细胞凋亡有关[5]。磷酯酰肌醇-3-激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是细胞内经典的促炎、促肿瘤通路,被先前的研究发现可通过调控氧化应激、炎症反应、细胞凋亡等生理过程参与不同的神经保护机制[6]。MicroRNA-200c(miR-200c)作为小非编码RNA家族的一员,被证实与代谢性疾病以及恶性肿瘤疾病的进展有关[7]。李盖天[8]的研究表明,过表达miR-200c可通过调控PI3K/Akt信号通路抑制胃癌上皮间质转化过程,并影响胃癌细胞对阿霉素等药物的抵抗性。然而,目前尚不清楚miR-200c调控PI3K/Akt/mTOR通路在脑缺血再灌注损伤过程中的作用机制。本研究探讨侧脑室注射miR-200c对脑缺血再灌注损伤大鼠脑保护作用,并研究其潜在调控机制,为脑缺血再灌注损伤提供更多治疗靶点。
1 材料和方法
1.1 动物
40只雄性SD大鼠由武汉大学动物实验室提供[动物许可证号:SYXK(鄂)2017-0065],体质量220~260 g。所有大鼠均饲养于恒温的饲养笼中,保持相对湿度为55%左右,给予充足的光照和经紫外线消毒后的水源,适应性喂养1周。本次实验经本院动物保护委员会审查及批准。伦理编号:YC.20210114S0321510
1.2 模型制作及分组
40只大鼠随机分为假手术组、模型组、miRNC组和miR-200c组,每组10只。除假手术组外,模型组、miR-NC和miR-200c组均采用线栓法构建脑缺血再灌注损伤模型,具体操作如下:首先用10%的水合氯醛以腹腔注射的方式将各组大鼠进行麻醉,由颈部正中切开皮肤,分离肌肉组织后暴露颈动脉,夹紧颈总动脉近心端和颈内动脉远心端,中间剪断将直径为0.26 mm的鱼线沿颈内动脉方向轻柔插入,当遇到阻力时停止,并在颈内动脉近心端结扎动脉,缝合切口,线头留置约3 cm于体外。缺血2 h后拔出鱼线约10 min以达到再灌注的目的。假手术组大鼠插线深度维持在10 mm以下,其他处理与上述一致。手术过程顺利且出现大鼠死亡,当大鼠清醒后出现爬行追尾情况,提尾时左前肢内收屈曲视为模型制作成功,手术结束后,各组大鼠仍保持单笼常规饲养。
1.3 侧脑室注射载体
模型制作成功3 d后,假手术组大鼠不做任何处理,其余各组大鼠用10%水合氯醛以腹腔注射的方式将各组大鼠进行麻醉,将各组大鼠以俯卧位固定于脑立体定位仪上,切开头皮,暴露头骨,由前囱向右方及后方各平移3.5 mm,于颅骨处开孔后进针3.8 mm,模型组、miR-NC组和miR-200c组分别经侧脑室注射生理盐水、miR-NC和miR-200c,剂量均为2 μL,注射速率为0.25 μL/min,注射完毕后停留约10 min后缓慢拔出注射器,以防外溢,封闭颅骨处开孔。消毒后缝合头皮,小鼠清醒后仍保持单笼常规饲养。
1.4 神经行为学评分
模型制作成功24 h后依据改良的Longa法[9]对各组大鼠神经行为功能进行评分,总分为0~5分,得分越高,神经功能缺陷越严重。0分:大鼠行为正常,不存在神经功能缺陷;1分:大鼠右前爪无法完全伸展;2分:大鼠表现为向右单侧转圈;3分:大鼠表现为向右单侧倾倒及翻转;4分:大鼠不能行走或爬行,丧失意识;5分:大鼠死亡。
1.5 脑组织含水量
模型制作成功24 h处死小鼠,切除小脑、脑干,清洗后称重大脑湿重,干燥后称大脑干重,按照干湿重比值计算脑组织含水量。
1.6 脑梗死体积
模型制作成功24 h后取脑组织保存于-20℃冷冻30 min,采用2,3,5-三苯基氯化四氮唑染色法测定各组大鼠脑梗死体积,将冰冻过的脑组织制成厚度约为2 mm的冠状片,采用2%的2,3,5-三苯基氯化四氮唑溶液(上海齐源生物科技有限公司;货号:26-729)进行染色,福尔马林固定后拍照,采用Image-Pro Plus 6.0软件按照“脑梗死体积=(病灶体积/脑总体积)× 100%”计算各组大鼠的脑梗死体积。
1.7 荧光定量聚合酶链反应(qRT-PCR)检测
取各组大鼠脑组织,眼科剪剪碎后组织液进行裂解,TRIzol提取脑组织内的总RNA,并将其逆转录成cDNA,GeneAmp PCR仪(美国ABI公司;型号:9700型)检测各组大鼠脑组织中以U6作为标准化内参后miR-200c的相对mRNA表达水平,设置反应条件为:95℃ 10 min,95℃ 5 s,60℃ 20 s,共循环40次,95℃ 60 s、95℃ 30 s、95℃ 30 s解离。miR-200c上游引物:5'-CGTCTT ACCCAGCAGTGTTT-3',下游引物:5'-ATACTGCC GGGTAATGATGGA-3'。
1.8 氧化应激反应检测
采用分光光度法[10]测定大鼠脑组织中氧化应激指标超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPX)的水平。首先将各组大鼠脑组织从-20℃的冰箱内取出,低温条件下以生理盐水稀释,混匀后3 000 r/min高速离心20 min,收集上清液。以黄嘌呤氧化酶法检测上清液中SOD含量,硫代巴比妥酸法检测上清液中MDA含量,化学比色法检测上清液中GSH-PX含量,严格按照说明书要求操作。以上试剂盒均购自武汉伊莱瑞特生物科技股份有限公司。
1.9 炎症因子水平检测
采用酶联免疫吸附法[11]测定大鼠脑组织中炎症因子白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的水平。取1.8中收集的脑组织上清液,采用IL-6、IL-1β和TNF-α试剂盒分别检测IL-6、IL-1β、TNF-α的含量,严格按照说明书要求操作。以上试剂盒均购自武汉伊莱瑞特生物科技股份有限公司。
1.10 神经细胞凋亡及PI3K/Akt/mTOR通路检测
收集各组大鼠脑组织,在预冷的缓冲液中进行匀浆,高速离心后收集上清液。采用BCA法检测蛋白浓度,裂解液充分裂解后将各组蛋白质浓度调整为等量,SDS-PAGE凝胶电泳后转膜,与凋亡相关蛋白B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl2)、Bcl-2关联X蛋白(recombinant Bcl2 associated X protein,Bax)、半胱氨酸天冬氨酸蛋白酶3(cysteine aspartic protease-3,caspase 3)、PI3K、Akt和mTOR等一抗兔抗大鼠(1∶1 000,武汉三鹰生物技术有限公司)4℃孵育过夜,再与辣根过氧化物酶标记的二抗羊抗兔(1∶10 000,武汉三鹰生物技术有限公司)共同孵育1 h,采用GelDoc-2000 Imagine软件进行化学发光检测,以β-actin作为标准化内参对各组蛋白条带进行定量。
1.11 统计学处理
本次实验中采用SPSS 22.0软件进行数据分析,计量资料均以±s表示,组间比较采用t检验,多组间比较以单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 神经功能评分、脑含水量、脑梗死体积
与假手术组相比,其他3组神经功能评分、脑含水量和脑梗死体积均显著升高(P<0.05),miR-200c组神经功能评分、脑含水量和脑梗死体积显著低于模型组和miR-NC组(P<0.05)(表1)。
表1 各组大鼠神经功能评分、脑含水量、脑梗死体积差异(n=10,±s)

表1 各组大鼠神经功能评分、脑含水量、脑梗死体积差异(n=10,±s)
*P<0.05 vs假手术组; #P<0.05 vs模型组;△P<0.05 vs miR-NC组
组别神经功能评分(分)脑含水量(%)脑梗死体积(%)假手术组072.43±1.590模型组3.02±0.68*87.68±2.43*32.07±4.33*miR-NC组2.89±0.71*85.94±2.26*30.88±3.56*miR-200c组2.04±0.36*#△75.36±1.63*#△16.49±2.11*#△P<0.001<0.001<0.001
2.2 大鼠脑组织中miR-200c表达
与假手术组、模型组和miR-NC组相比,miR-200c组miR-200c表达显著上调(P<0.05)(图1)。

图1 各组大鼠脑组织内miR-200c表达
2.3 神经细胞凋亡相关分子表达
与假手术组相比,其他3组Bax、caspase 3蛋白表达显著上调,Bcl2蛋白表达显著下调(P<0.05);miR-200c组Bax、caspase 3蛋白表达显著低于模型组和miR-NC组,Bcl2蛋白表达显著高于模型组和miR-NC组(P<0.05)(图2)。

图2 各组大鼠神经细胞凋亡相关分子表达差异
2.4 氧化应激反应
与假手术组相比,其他3组SOD和GSH-PX含量显著降低,MDA含量显著升高(P<0.05);miR-200c组SOD和GSH-PX含量较模型组和miR-NC组显著升高,MDA含量显著降低(P<0.05)(表2)。
表2 各组大鼠氧化应激指标差异(n=10,±s,pg/mL)
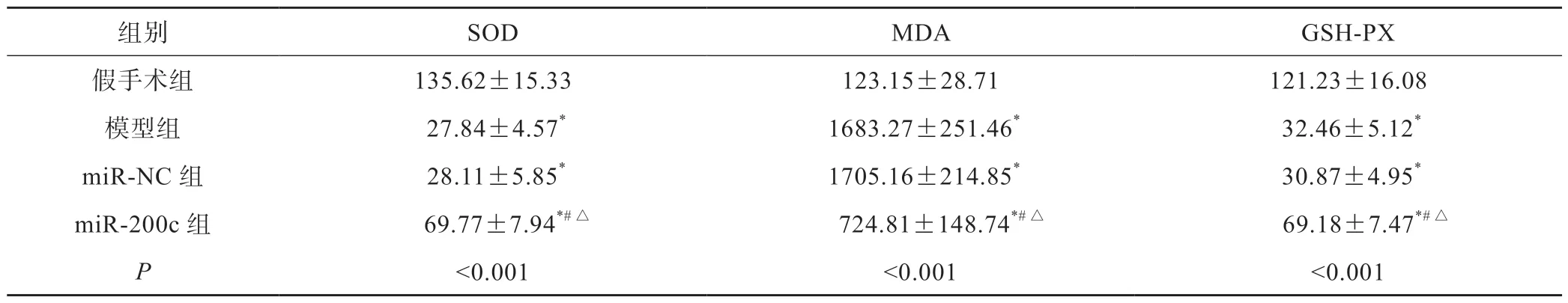
表2 各组大鼠氧化应激指标差异(n=10,±s,pg/mL)
*P<0.05 vs假手术组; #P<0.05 vs模型组;△P<0.05 vs miR-NC组
组别SODMDAGSH-PX假手术组135.62±15.33123.15±28.71121.23±16.08模型组 27.84±4.57* 1683.27±251.46* 32.46±5.12*miR-NC组 28.11±5.85* 1705.16±214.85* 30.87±4.95*miR-200c组 69.77±7.94*#△ 724.81±148.74*#△ 69.18±7.47*#△P<0.001<0.001<0.001
2.5 炎症因子水平
与假手术组相比,其他3组IL-6、IL-1β、TNF-α含量显著增多(P<0.05),miR-200c组IL-6、IL-1β、 TNF-α含量显著低于模型组和miR-NC组(P<0.05)(表3)。
表3 各组大鼠炎症指标差异(n=10,±s,pg/mL)

表3 各组大鼠炎症指标差异(n=10,±s,pg/mL)
*P<0.05 vs假手术组; #P<0.05 vs模型组;△P<0.05 vs miR-NC组
组别IL-6IL-1βTNF-α假手术组12.46±1.4718.45±2.1516.31±1.25模型组34.27±4.02*42.16±4.45*37.34±3.84*miR-NC组35.43±3.72*41.73±4.29*38.02±3.75*miR-200c组25.04±2.61*#△29.05±3.22*#△22.45±2.86*#△P<0.001<0.001<0.001
2.6 PI3K/Akt/mTOR通路分子表达
与假手术组相比,其他3组PI3K/Akt/mTOR通路被显著抑制(P<0.05),miR-200c组PI3K/Akt/mTOR的活化水平显著高于模型组和miR-NC组(P<0.05)(图3)。

图3 各组大鼠PI3K/Akt/mTOR通路分子表达差异
3 讨论
本研究采用线栓法构建大鼠脑缺血再灌注损伤模型,观察侧脑室注射miR-200c对模型大鼠神经损伤的保护作用及潜在机制,结果显示模型大鼠神经功能评分、脑含水量和脑梗死体积显著升高,表明该方法建模成功。侧脑室注射miR-200c后,miR-200c通过调控PI3K/Akt/mTOR通路显著改善模型大鼠的脑损伤,为脑缺血再灌注损伤的诊断和治疗提供新的分子靶点。
本研究结果显示,miR-200c通过调控PI3K/Akt/mTOR通路显著减轻脑组织内氧化应激反应和炎症反应,抑制神经细胞凋亡,发挥显著的脑保护作用。与既往国外文献结论并不完全一致,Tang等[12]研究表明,缓激肽1受体拮抗剂可阻断缓激肽1受体,抑制小胶质细胞微囊泡miR-200c向神经细胞进行信号传递,进而发挥神经保护作用。究其原因,可能与miR-200c靶向的下游分子不同有关,本研究中miR-200c作用于PI3K/Akt/mTOR信号通路,上调其表达,减少促氧化应激指标MDA的含量,增加抗氧化应激指标SOD和GSH-PX的含量,同时抑制炎症因子IL-1β、TNF-α的水平,改善神经功能评分、脑含水量和脑梗死体积,下调促凋亡蛋白Bax和caspase 3的表达,上调抑凋亡蛋白Bcl2的表达,减轻神经细胞凋亡[13],为脑缺血再灌注导致的脑损伤提供新的有效治疗和改善方案,对于脑卒中患者的临床治疗而言意义重大。
PI3K/Akt/mTOR信号通路是广泛存在于细胞内参与影响细胞生成、分化、增殖、迁移、侵袭和凋亡的经典通路,参与多种恶性肿瘤疾病、急慢性炎症疾病和损伤疾病的发生发展[14-15]。有研究显示,miR-200c可通过调控PI3K/Akt通路促进乳腺癌细胞的体外增殖、迁移和侵袭,与乳腺癌细胞的恶性生物学行为有关[16]。关于miR-200调控PI3K/Akt在神经元及脑组织中发挥的效应也有国外学者曾报道过。Du等[17]研究表明,miR-200c-3p在癫痫大鼠海马组织中高表达,miR-200c-3p通过激活Akt信号通路降低海马组织中炎症介质的含量,减轻氧化应激反应,抑制癫痫大鼠马海神经元凋亡,减轻神经元损伤,这与本研究结果较为相符。本研究结果也显示,侧脑室注射miR-200c通过激活PI3K/Akt/mTOR信号通路的磷酸化水平,显著抑制脑缺血再灌注大鼠氧化应激反应和炎症反应,抑制神经细胞凋亡,降低神经功能评分、脑含水量和脑梗死体积。其机制可能与miR-200c对PI3K/Akt/mTOR通路的调控作用有关,miR-200c通过酪氨酸激酶激活PI3K的磷酸化,并在丙酮酸脱氢酶激酶同工酶1的作用下活化Akt信号[18],再与磷酸化的结节性硬化复合物2结合,增强脑中富含的Ras同源蛋白活性,上调mTOR的磷酸化水平[19],发挥显著的神经保护作用。本研究结果进一步说明miR-200c上调PI3K/Akt/mTOR信号级联在脑缺血再灌注脑保护中发挥关键的生物学效应。
综上所述,miR-200c可通过激活PI3K/Akt/mTOR信号通路,显著抑制脑缺血再灌注大鼠脑组织内氧化应激反应和炎症反应,改善神经细胞凋亡,减轻模型大鼠神经功能评分、脑含水量和脑梗死体积,发挥显著的脑保护作用。本研究结果提示miR-200c和PI3K/Akt/mTOR信号通路在脑缺血再灌注患者的治疗中拥有广阔应用前景,临床可考虑将PI3K/Akt/mTOR通路作为改善缺血性脑卒中的重要靶点,以减少患者脑卒后脑损伤。