红芪多糖通过线粒体途径诱导皮肤鳞状细胞癌细胞SCL-1凋亡的研究
鲁青莲, 刘林莉, 蒋亚辉, 杨和荣, 孟 君, 邓玲俐, 房 慧
(四川省遂宁市中心医院皮肤科, 四川 遂宁 629000)
皮肤鳞状细胞癌简称皮肤鳞癌.是一种皮肤上皮的恶性增生,占皮肤癌的20%-50%[1]。其中大部分肿瘤通过手术切除可成功根除,但仍有部分肿瘤手术切除后表现较高的复发性、转移性甚至可至死亡[2]。临床治疗皮肤鳞癌常用全身化疗的方案,铂类抗癌药物的单独用药或联合用药是化疗的标准药物[3]。化疗药物的副作用、耐药性成为限制药物的治疗效果,因此迫切需要新安全药物。天然中草药是最佳的毒副作用小、安全有效的抗癌药物。最近发现,四脚草黄酮抑制皮肤鳞癌细胞蛋白酶体发挥抗癌作用[4],扁蓄苷通过抑制丝裂原活化蛋白激酶激酶(MEK)/NF-êB信号通路活性发挥抗皮肤鳞癌细胞增殖迁移侵袭功能[5]。红芪是一种豆科植物的干燥根部,与黄芪同科,功效也与黄芪相似。红芪的化学成分十分复杂,包括多糖、黄酮类、皂苷类、糖苷类等,其功效也十分广泛,如抗肿瘤、抗氧化、抗炎、抗衰老、免疫调节等[6,7]。红芪多糖是其有效成分之一,具有抗口腔鳞癌、胶质瘤、肝癌的治疗作用[8~10]。但是其在皮肤鳞癌中的作用尚未有研究报道。本研究拟以皮肤鳞癌细胞SCL-1为研究对象,观察红芪多糖对SCL-1细胞存活、凋亡的影响,揭示红芪多糖抑制SCL-1细胞增殖,促进凋亡的机制与激活线粒体凋亡途径有关,以期为皮肤鳞癌的临床治疗提供新的治疗药物。
1 材料与方法
1.1材料:人皮肤鳞癌细胞SCL-1购自美国菌种保藏中心;红芪多糖(纯度87.44%)来自本医院药理研究室;DMEM培养基购自美国Hyclone公司;胎牛血清购自杭州四季青;细胞计数试剂盒(CCK8)购自北京康为世纪公司;膜联蛋白V异硫氰酸荧光素-碘化丙锭(Annexin V-FITC/PI)细胞凋亡检测试剂盒购自日本TAKERA;线粒体膜电位检测试剂盒(JC-1)购自北京雷根生物公司;兔抗Cleaved PARP单抗、兔抗Cleaved Caspase-3单抗、兔抗Cleaved Caspase-9单抗、兔抗Cytochrome c单抗、兔抗Smac单抗、兔抗Bax单抗、兔抗Bak单体、HRP标记的二抗均购自上海艾博抗公司。
1.2方 法
1.2.1细胞培养:用DMEM培养基培养SCL-1细胞,同时混有10%胎牛血清、1%青链霉素双抗。培养条件为37℃、5%CO2的恒温细胞培养箱中常规培养。隔天更换一次细胞培养液。
1.2.2分组与处理:将正常培养的SCL-1细胞,添加不含红芪多糖的PBS缓冲液培养,标记为对照组。红芪多糖(25、50、100μg/mL,PBS溶液作为稀释液)处理的SCL-1细胞标记为25μg/mL组、50μg/mL组、100μg/mL组,筛选最适浓度50μg/mL处理的SCL-1细胞标记为HPS组。SCL-1细胞培养24h后,取红芪多糖(25、50、100μg/mL)100μL混入培养液作为新培养液,继续培养24、48、72h。
1.2.3CCK8法检测细胞增殖抑制率:收集对照组、25μg/mL组、50μg/mL组、100μg/mL组培养了24、48、72h的待检测细胞,调整5×104个/mL,取200μL置于96孔板。每孔加入20μL的CCK溶液,充分混匀。室温下避光孵育1.5h,上酶标仪,在490nm波长下检测细胞的吸光度(A490值)。细胞增殖抑制率=[1-A490实验组/A490对照组]×100%。
1.2.4流式细胞术检测细胞凋亡率[11]:收集培养48h的对照组、25μg/mL组、50μg/mL组、100μg/mL组细胞,使用PBS洗涤3次,调至5×105个/mL,再用500μL的结合缓冲液重悬细胞。取Annexin V-FITC(10μL)和PI(5μL)充分混合后,室温避光孵育30min。结束后在1h内上流式细胞仪进行细胞凋亡的检测分析。总凋亡率(%)=早期凋亡率+晚期凋亡率。
1.2.5JC-1染色法检测细胞线粒体膜电位:收集培养48h的对照组、HPS组细胞,用PBS液充分清洗,加入JC-1染色液500μL,轻微震荡混匀,置于37℃孵育20min。结束后,加入结合缓冲液重悬细胞,离心取沉淀细胞,再用PBS悬浮细胞。将悬浮的细胞加入流式细胞仪检测分析细胞线粒体膜电位。使用FL2通道红色荧光与FL1通道绿色荧光的比值表示线粒体膜电位。
1.2.6WB实验检测细胞浆和线粒体的Cleaved PARP、Cleaved Caspase-3、Cleaved Caspase-9、Cytochrome c、Smac、Bax、Bak的蛋白表达:收集培养48h的对照组、HPS组细胞,RIPA冰上裂解30 min,提取细胞总蛋白。或者按照胞质和线粒体蛋白质提取试剂盒要求操作提取蛋白。使用Bradford 法蛋白定量,沸水浴10 min进行蛋白变性。取60μg变性蛋白上清液用于SDS-PAGE电泳上样。配置的凝胶上层为10%的浓缩胶,下层为5%的分离胶。恒压电泳时,浓缩胶使用80 V-45 mA,电泳40~45 min,分离胶使用120 V-60 mA,电泳1.5h。结束后进行恒流转膜,200mA-100V。转膜时需在0℃低温条件下操作。转膜结束后,将膜用2.5%的脱脂奶粉37℃封闭处理1h。充分洗膜,浸入稀释过的一抗溶液(兔抗Cleaved PARP单抗,1∶800;兔抗Cleaved Caspase-3单抗,1∶1000;兔抗Cleaved Caspase-9单抗,1∶1500;兔抗Cytochrome c单抗1∶1000;兔抗Smac单抗,1∶500;兔抗Bax单抗,1∶1000;兔抗Bak单抗,1∶1000),4℃孵育12 h。取出膜充分清洗后再浸入稀释过的二抗溶液(HRP标记的二抗,1∶500),37℃孵育1.5 h。用ECL电化学发光试剂盒曝光显影、定影。Image J软件处理各组蛋白条带的灰度值,以目的条带与内参(GAPDH)条带的比值表示蛋白表达。

2 结 果
2.1红芪多糖对SCL-1细胞增殖的影响:与对照组相比,25μg/mL组、50μg/mL组、100μg/mL组细胞在24、48、72h的增殖抑制率均显著升高(P<0.05);与25μg/mL组相比,50μg/mL组、100μg/mL组细胞在24、48、72h时增殖抑制率均显著升高(P<0.05);与50μg/mL组相比,100μg/mL组细胞在24h的增殖抑制率显著升高(P<0.05),48、72h时增殖抑制率差异不显著(P>0.05)故选用红芪多糖处理48h的SCL-1细胞最合适。见表1。

表1 不同浓度红芪多糖调控SCL-1细胞的增殖
2.2红芪多糖对SCL-1细胞凋亡的影响:与对照组相比,25μg/mL组、50μg/mL组、100μg/mL组SCL-1细胞凋亡率均显著升高(P<0.05)。与25μg/mL组相比,50μg/mL组、100μg/mL组细胞凋亡率均显著升高(P<0.05);与50μg/mL组相比,100μg/mL组细胞凋亡率差异不显著(P>0.05)。故选用50μg/mL红芪多糖处理的SCL-1细胞最合适。见图1、表2。
2.3红芪多糖对SCL-1细胞线粒体膜电位的影响:与对照组相比,HPS组细胞线粒体膜电位显著降低(P<0.05)。见表3。

图1 不同浓度红芪多糖处理的SCL-1细胞凋亡图

表2 不同浓度红芪多糖处理的SCL-1细胞凋亡率

表3 红芪多糖对SCL-1细胞线粒体膜电位的调控
2.4红芪多糖对SCL-1细胞线粒体凋亡相关蛋白Cleaved PARP、Cleaved Caspase-3、Cleaved Caspase-9蛋白表达的影响:与对照组相比,HPS组细胞Cleaved PARP、Cleaved Caspase-3、Cleaved Caspase-9的蛋白表达均显著升高(P<0.05)。见图2、表4。
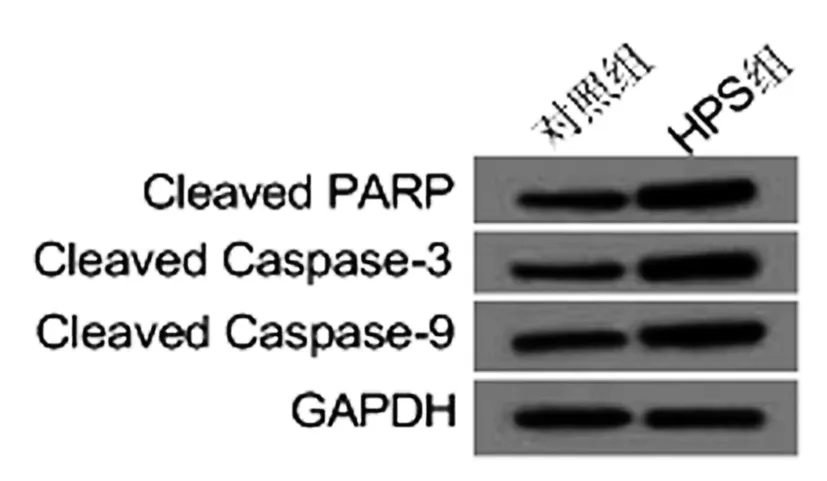
图2 红芪多糖处理的SCL-1细胞Cleaved PARP、Cleaved Caspase-3、Cleaved Caspase-9的蛋白图
2.5红芪多糖对SCL-1细胞线粒体释放Cytochrome c、Smac的影响:与对照组相比,HPS组细胞浆Cytochrome c、Smac的蛋白表达均显著升高(P<0.05)。见图3、表5。

表4 红芪多糖处理的SCL-1细胞Cleaved PARP Cleaved Caspase-3Cleaved Caspase-9的蛋白表达
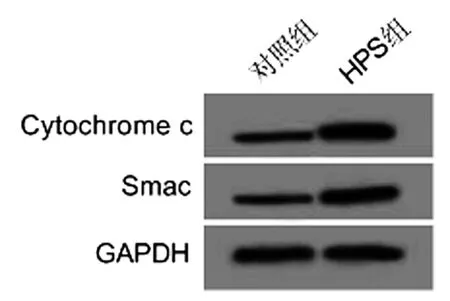
图3 红芪多糖处理的SCL-1细胞浆Cytochrome c、Smac的蛋白图

表5 红芪多糖处理的SCL-1细胞浆Cytochrome c Smac的蛋白表达量
2.6红芪多糖对SCL-1细胞Bax、Bak转位至线粒体的影响:与对照组相比,HPS组细胞浆Bax、Bak的蛋白表达差异不显著,线粒体Bax、Bak的蛋白表达均显著升高(P<0.05)。见图4、表6。

表6 红芪多糖处理的SCL-1细胞浆 线粒体中Bax Bak蛋白的表达量

图4 Bax、Bak在红芪多糖处理的SCL-1细胞浆、线粒体中的蛋白表达
3 讨 论
红芪多糖是中药红芪的多糖提取物,随着药理研究技术的不断提高,其在疾病中的新功能也不断被发现。曾素娟等[8]研究发现,红芪多糖、硒化红芪多糖呈浓度依赖性抑制口腔癌细胞的增殖,并通过激活死亡受体Fas/Fasl基因发挥促凋亡作用,揭示了红芪多糖在促进癌细胞凋亡的精准治疗中的潜在价值。Du等[9]发现,红芪多糖能够在体内和体外抑制胶质瘤细胞的增殖,促进其凋亡,并通过调节荷瘤小鼠免疫功能和肿瘤坏死因子-α(TNF-α)通路抑制肿瘤生长,展示了红芪多糖的抗胶质瘤功能。本研究发现,红芪多糖呈时间、浓度依赖性抑制皮肤鳞癌细胞SCL-1的增殖,促进其凋亡,这揭示了红芪多糖潜在的抗皮肤鳞癌功能。为了进一步探究红芪多糖的凋亡促进机制,实验检测了SCL-1细胞线粒体膜电位发现,红芪多糖处理的SCL-1细胞线粒体膜电位明显降低,这暗示红芪多糖的抗癌功能可能与线粒体相关。
据报道,在肝癌的研究中,中药落叶松脂素通过降低线粒体膜电位,诱导线粒体释放细胞色素C,激活线粒体介导的凋亡信号通路,进而发挥抑制肝癌细胞增殖,促进凋亡的抗癌作用[10]。虽然红芪多糖在皮肤鳞癌中的抗癌功能虽得到实验证实,但是其作用机制仍需继续探讨。鉴于落叶松脂素的抗肝癌线粒体凋亡途径,推测红芪多糖的抗皮肤鳞癌功能机制可能也与诱导线粒体介导的癌细胞凋亡有联系。通过凋亡(程序性细胞死亡)途径用于抵抗癌症已成为临床癌症治疗研究的焦点,开发高效的促凋亡药物成了肿瘤基础医学研究的重点。Bcl-2家族促凋亡和抗凋亡成员控制凋亡蛋白的平衡,维持线粒体膜的通透性[11]。抗凋亡蛋白(如Bcl-2、Bcl-xl)位于线粒体外膜,抑制细胞色素C、Smac释放,而促凋亡蛋白(如Bax、Bak)位于细胞浆,当细胞接收到外部凋亡信号,促凋亡蛋白会转移至线粒体,释放细胞色素C、Smac至细胞浆[12]。值得注意的是,在现有的细胞凋亡途径中,线粒体膜电位的降低代表了细胞凋亡的起始,该过程的发生早于DNA断裂、细胞膜磷脂酰丝氨酸外翻、Caspase-3蛋白酶的激活和细胞形态的改变[13]。大量研究报道,线粒体途径凋亡参与多种癌细胞的增殖、迁移侵袭、靶向效应、耐药性、放疗敏感性等,其中包括皮肤鳞癌。但是该途径在皮肤鳞癌中与红芪多糖之间的联系尚未有人研究。本研究检测了红芪多糖处理的SCL-1细胞的线粒体膜电位发现,红芪多糖可明显降低癌细胞的线粒体膜电位,升高线粒体凋亡相关蛋白Cleaved PARP、Cleaved Caspase-3、Cleaved Caspase-9的表达,促进线粒体释放Cytochrome c、Smac,促进Bax、Bak转移至线粒体,这些实验结果验证了红芪多糖治疗皮肤鳞癌的机制与线粒体凋亡途径之间的紧密联系,这也暗示了线粒体凋亡作为抗癌靶点的巨大潜力。本研究下一步计划展开红芪多糖在皮肤鳞癌动物模型中的深入研究,为红芪多糖提高皮肤鳞癌患者预后提供更充分的实验证据。
总之,红芪多糖具有抑制皮肤鳞癌细胞增殖,促进凋亡的抗癌作用,产生这种治疗效果的机制为激活癌细胞的线粒体凋亡途径紧密相关,为红芪多糖用于临床治疗皮肤鳞癌奠定理论基础。

