外周血CD4+CD25+调节性T细胞在妊娠合并ITP患者中的表达及意义*
李明亮,田 笑,马 昂,栾 亮,刘 静,刘婷婷
北部战区总医院检验科,辽宁沈阳 110016
妊娠合并原发免疫性血小板减少症(ITP)是产科较为常见的一种血液系统合并症,发病率为0.1%~0.2%,它可以引起凝血功能障碍进而导致产后出血,产后出血一旦发生就很难控制,严重后果可能导致产妇死亡,因此对妊娠合并ITP发病机制的研究相当重要。ITP是一种自身免疫性疾病,以骨髓中血小板生成减少、血小板自身抗体的产生、网状系统血小板清除这3种机制致病[1],以不明原因血小板减少及出血为主要临床表现。妊娠过程实际上是一次成功的“母胎耐受”,因此不论是妊娠还是ITP,两者均与机体自身免疫耐受密切相关,而 CD4+CD25+调节性T(Treg)细胞是一类具有免疫抑制作用的重要辅助性淋巴细胞亚群[2-3]。本试验通过对妊娠合并ITP患者外周血CD4+CD25+Treg细胞和血小板计数的测定及二者的相关性分析来初步探讨CD4+CD25+Treg细胞在妊娠合并ITP中的作用。
1 资料与方法
1.1一般资料 选取2020年1-12月在本院就诊的妊娠合并ITP患者100例作为试验组,其中急性ITP 患者36例,慢性ITP(把妊娠前即有ITP病史的患者定义为慢性ITP)患者64例。患者年龄21~42岁,中位年龄28岁,孕周8~32周。纳入标准:(1)至少两次血常规检测血小板计数<100×109/L;(2)无其他并发症;(3)无继发性血小板减少的因素存在;(4)无其他疾病史。排除标准:一切可以引起血小板减少的其他血液系统疾病;系统性红斑狼疮;抗心磷脂抗体综合征;重度子痫前期;严重的产科出血及贫血等。对照组为同期到本院产检的100例健康产检孕妇,年龄25~40岁,中位年龄29岁,孕周8~32周。本研究经医院伦理委员会通过,所有研究对象签署知情同意书。
1.2仪器和试剂
1.2.1仪器 美国BD FACS Calibur流式细胞仪、德国西门子ADVIA2120全自动血细胞分析仪、新康医疗器械有限公司XK96-A快速旋涡混匀器、离心机等。
1.2.2试剂 异硫氰酸荧光素(FITC)标记的鼠抗人CD4单克隆抗体、藻红蛋白(PE)标记的鼠抗人CD25单克隆抗体、PE标记的鼠抗人IgG1、经去离子水1∶10稀释至正常工作浓度的FACS溶血素、磷酸盐缓冲液,所有试剂均购自美国BD公司。
1.3方法
1.3.1标本采集与处理 试验组和对照组均用含有EDTA-K2的抗凝管采集清晨空腹静脉血,每人采集2管,每管约2 mL,采集后立即颠倒混匀10次,注意不要用力振荡,并于4 ℃冰箱保存,备用。其中一管用于检测血小板计数,另一管用于流式细胞仪分析。要求所有标本均无凝集、无乳糜、无溶血。
1.3.2血小板计数的检测 用德国西门子ADVIA2120全血细胞分析仪对两组标本进行全血细胞分析从而获得血小板计数结果。
1.3.3CD4+T细胞及CD4+CD25+Treg细胞的检测 用美国BD流式细胞仪检测CD4+T细胞及CD4+CD25+Treg细胞。具体步骤:(1)将待测标本从冰箱取出放置室温后,充分混匀,分别取50 μL于2个上样管中,一管作为样品检测管(T管),一管作为同型对照管(C管)。T管加入FITC标记的鼠抗人CD4单抗和PE标记的鼠抗人CD25单抗各10 μL,C管加入FITC标记的鼠抗人CD4单抗和PE标记的鼠抗人IgG1各10 μL。漩涡振荡混匀后,室温避光孵育15 min。(2)加500 μL溶血素后,漩涡振荡混匀,室温避光孵育15 min,裂解红细胞。(3)1 500 r/min离心5 min,弃上清液,加2 mL PBS清洗细胞,漩涡振荡混匀。(4)1 500 r/min离心5 min,弃上清液,加500 μLPBS重悬细胞,振荡混匀。(5)上机检测,调整电压和荧光补偿,每个上样管收集10 000个细胞,使用CellQuest软件进行分析。同样方法检测CD4+T细胞,只是不需要加入PE标记的鼠抗人CD25单克隆抗体。

2 结 果
2.1血小板计数结果 妊娠合并急性ITP患者血小板计数为(53.33±18.26)×109/L,妊娠合并慢性ITP患者血小板计数为(76.19±11.23)×109/L,对照组血小板计数为(193.36±46.27)×109/L。
2.2CD4+T细胞、CD4+CD25+Treg细胞测定结果 试验组 CD4+T细胞、CD4+CD25+Treg细胞及CD4+CD25+Treg细胞/CD4+T细胞比值均低于对照组,差异均有统计学意义(P<0.05),见表1。急性ITP患者的CD4+T细胞和CD4+CD25+Treg细胞低于慢性ITP患者,差异均有统计学意义(P<0.05);急性ITP患者的CD4+CD25+Treg细胞/CD4+T细胞比值低于慢性ITP患者,但差异无统计学意义(P>0.05),见表2。

表1 试验组和对照组CD4+T细胞、CD4+CD25+Treg细胞测定结果

表2 急性ITP和慢性ITP患者CD4+T细胞、CD4+CD25+Treg细胞测定结果
2.3CD4+CD25+Treg细胞与血小板计数的相关性分析 结果显示,试验组CD4+CD25+Treg细胞与血小板计数呈较强正相关(r=0.759,P<0.001),CD4+CD25+Treg细胞/CD4+T细胞比值与血小板计数呈中等程度正相关(r=0.539,P<0.001)。见图1、图2。
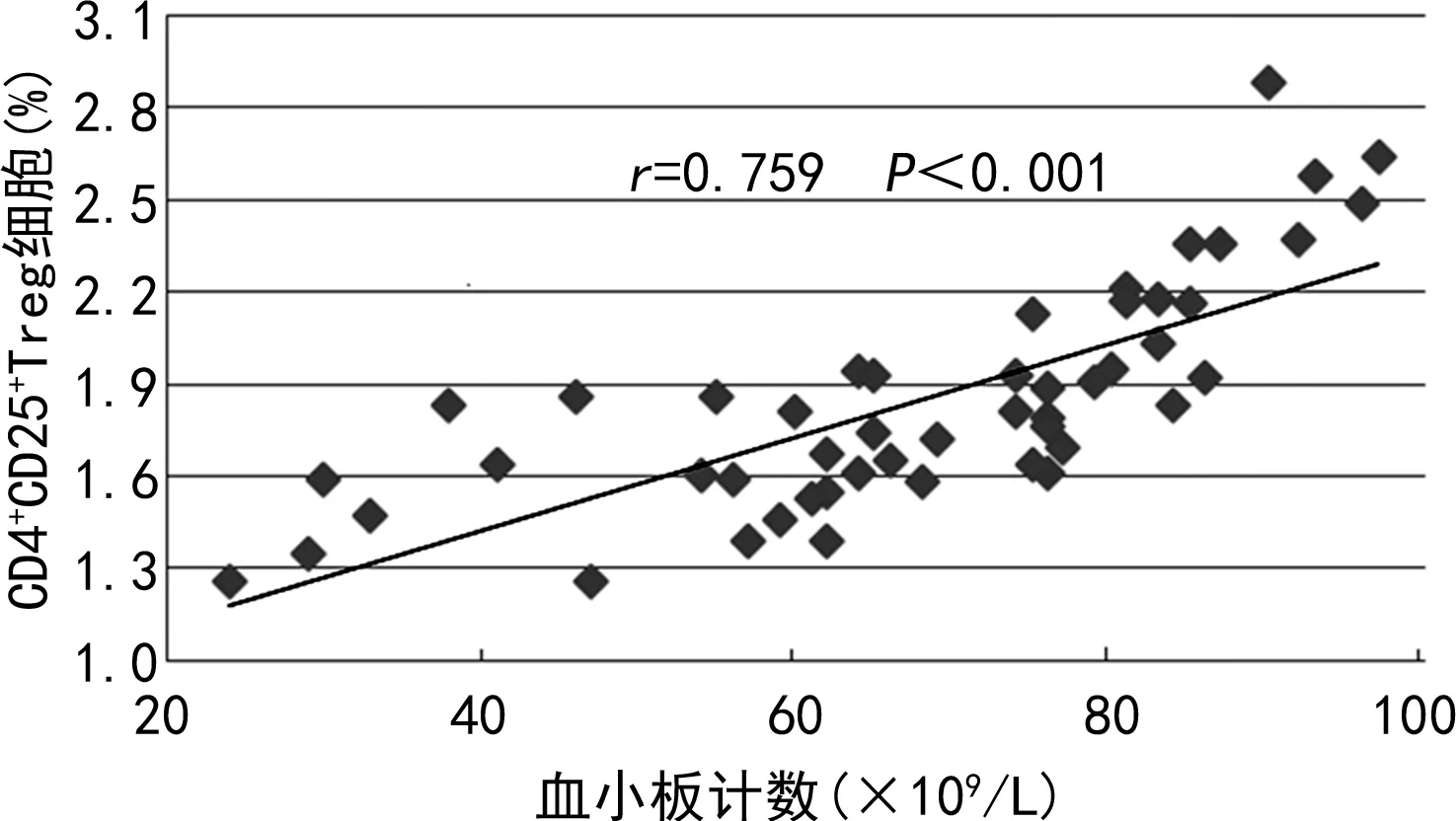
图1 试验组CD4+CD25+Treg细胞与血小板计数相关性分析
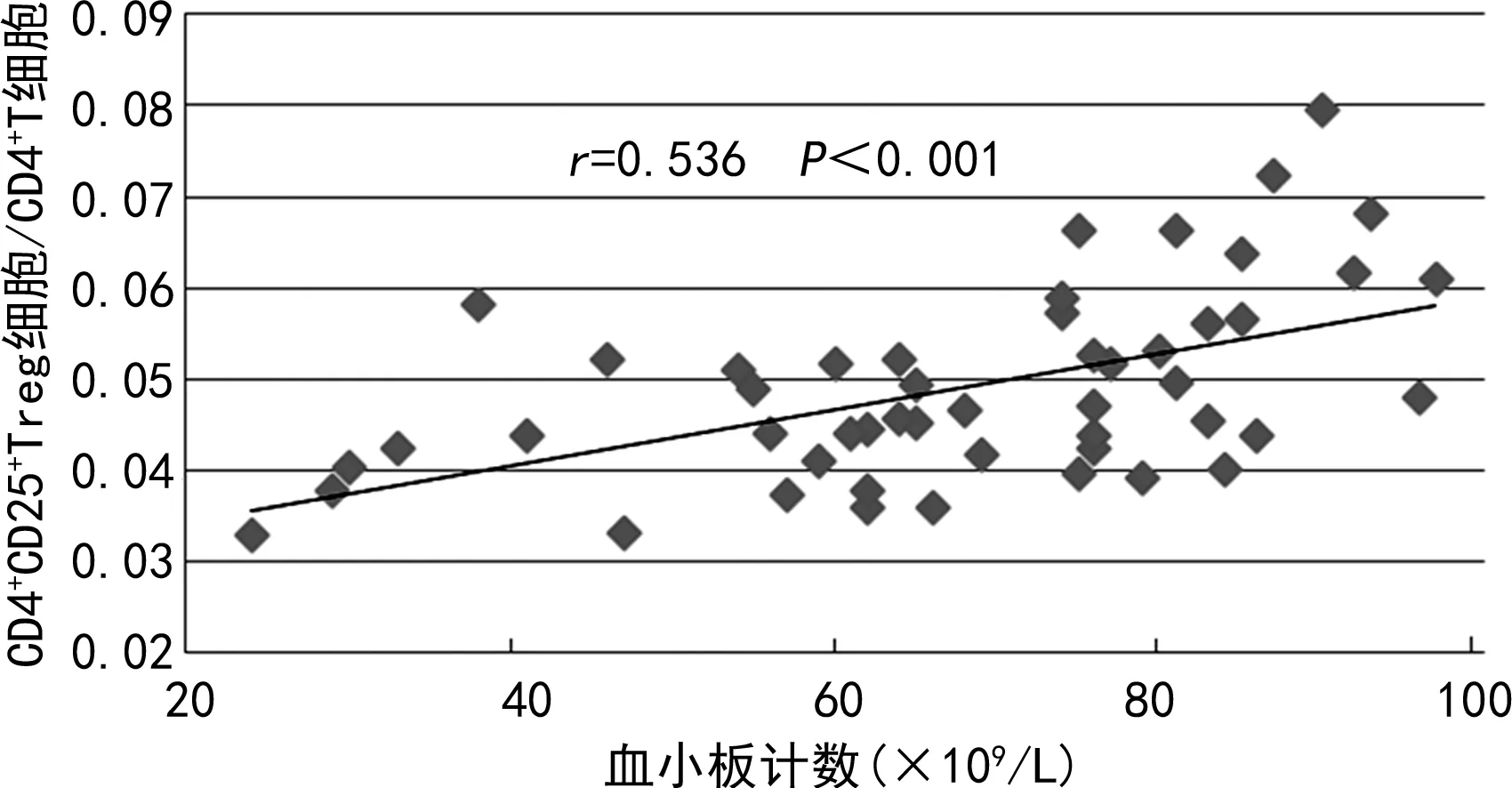
图2 试验组 CD4+CD25+Treg细胞/CD4+T细胞与血小板计数相关性分析
3 讨 论
ITP是一种由体液免疫和细胞免疫共同介导的自身免疫性疾病[4],患者体内常不明原因地产生血小板抗体,该抗体与血小板膜蛋白结合,导致血小板在单核-巨噬细胞系统(MPS)中过多过快地被破坏,引起血小板减少。妊娠是一种复杂的生理过程,从免疫学角度来看,类似于器官移植,携带父源性人类白细胞抗原的胎儿理应受到母体免疫系统的排斥,但事实上母体对胎儿形成了免疫耐受。由此可见,ITP存在免疫耐受异常,妊娠需要免疫耐受维持,二者均与机体免疫耐受密切相关。另外经过临床病例分析发现,部分ITP患者在妊娠期进行性加重或孕后发病,提示妊娠可能是诱导或加重血小板减少的一个因素[5-7]。
Treg细胞尤其是CD4+CD25+Treg细胞,是一类重要的具有独立免疫调节能力的T细胞亚群,具有免疫低反应性和免疫抑制性,高表达CD25,低表达CD127,特征性表达叉状头转录因子3(FOXP3),与多种自身免疫性疾病、器官移植耐受有关[8-10]。在妊娠过程中,母体外周血及胎儿脐带血中均存在CD4+CD25+Treg细胞,数量随着妊娠的进程发生变化,妊娠早期开始升高,中期达到峰值,分娩时降至最低,这种变化说明其参与母胎耐受[11]。还有研究发现,去除受精小鼠体内的CD4+CD25+Treg细胞,小鼠胚胎植入过程严重紊乱,导致胚胎无法植入,也说明了CD4+CD25+Treg细胞在妊娠过程中发挥重要的免疫功能[12]。
目前已经有研究表明对于非孕期的慢性ITP患者,血液中CD4+CD25+Treg细胞的数量和比例在其发病机制中发挥了重要作用[13]。然而,对于妊娠合并ITP的患者CD4+CD25+Treg细胞是否也是同样发挥着作用少见报道。在本试验中笔者对100例不同孕周、不同年龄的妊娠合并ITP患者按照急性、慢性进行了分组研究,通过数据的比对,发现试验组CD4+T细胞、CD4+CD25+Treg细胞及CD4+CD25+Treg细胞/CD4+T细胞比值均明显低于对照组(P<0.05),并且急性ITP患者的CD4+T细胞和CD4+CD25+Treg细胞低于慢性ITP患者(P<0.05),但是急性ITP患者的CD4+CD25+Treg细胞/CD4+T细胞比值与慢性ITP患者之间无明显差异(P>0.05),这就表明无论在急性还是慢性ITP中,CD4+CD25+Treg细胞同样发挥着非常重要的作用,并且CD4+CD25+Treg细胞比例与血小板计数呈较强的正相关,而CD4+CD25+Treg细胞/CD4+T细胞比值与血小板计数 呈中等程度正相关。这是因为受妊娠这一特殊状态的影响,ITP患者免疫功能的变化表现为细胞免疫更加活跃,其发生、发展与妊娠期间机体的免疫系统对自身抗原的识别和耐受异常相关[14-15]。这一现象提示CD4+CD25+Treg细胞数量减少后,导致免疫抑制功能减弱,对效应T细胞的免疫抑制功能不足,可能导致了妊娠期间ITP的发生[16]。有研究表明,其机制可能与表达于CD4+CD25+Treg细胞表面的FOXP3蛋白有关。当阻断 FOXP3表达后Treg细胞的免疫抑制功能明显下降,FOXP3 突变或缺乏将导致多种自身免疫性疾病,如系统性红斑狼疮、类风湿性关节炎、自身免疫性肝病[17-18]等,因此FOXP3是决定CD4+CD25+Treg细胞免疫抑制功能的关键性分子,FOXP3的突变或缺失将会导致Treg细胞的功能缺陷[19]。
本试验结果显示,妊娠合并ITP患者外周血CD4+CD25+Treg细胞数量较健康孕妇明显减少,且在急性ITP患者体内下降更明显,并且CD4+CD25+Treg细胞与血小板计数呈正相关,这就说明CD4+CD25+Treg细胞在妊娠合并ITP中起着重要的作用。