肺占位穿刺基于CT评估肺出血风险的临床研究
林雪芳 林添钰 丘建燊 雷娟 张芨 黄增亮 杨超 张鸿文
2020年全球癌症统计,肺癌是第二位常见的癌症,也是最主要的癌症死亡原因[1]。CT引导下经皮肺穿刺活检(CT-guided percutaneous transthoracic needle biopsy,PTNB)是目前临床对肺部占位性病变活检最常用的手段之一,诊断率可达83%~100%[2-4]。对于多灶病变的二次活检,还可借助PET-CT选择穿刺位点得到较高的诊断率[5]。随着肺癌筛查的普及和基因组技术的发展,PTNB对肺癌的诊断和治疗起着越来越重要的作用。
PTNB安全性较高,但可能出现一定并发症,常见为气胸和肺出血[6]。较严重肺出血可能危及患者的生命。因此,有必要评估PTNB肺出血的相关危险因素, 对选择合适穿刺病灶及穿刺位点,避免不必要的肺出血,尤其是致命性肺出血有重要意义。本文用回顾性分析的方法,基于CT来评估,探讨PTNB术后肺出血的相关危险因素。
资料与方法
该回顾性研究得到了联勤保障部队第九〇〇医院伦理委员会同意,并免除了患者的知情同意。
一、器械设备
GE64排螺旋CT扫描仪。GALLINI公司18G半自动切割活检针,17G同轴穿刺针。
二、研究对象
回顾性分析我院2018-01-01至2020-10-31共1174例患者(1226个病灶)行PTNB(男性814例,女性413例,年龄14~88岁,平均59.01±11.17岁,病灶大小6.0~133.5mm,中位数29.00mm)术后CT图像,评估肺出血情况。
三、方法
1 穿刺过程
(1)术前完善血常规、凝血功能、心电图等常规检查。停用抗凝药物1周。术前根据CT图像初步确定穿刺位点及路径,完善胸部增强CT检查。(2)根据病变部位选择体位。将体表定位栅置于病灶体表相对位置,行CT扫描(<1.5cm结节采取1.25mm层厚扫描),根据图像再次明确穿刺位点及路径,即在避开大血管、叶间裂、肺大疱、肋骨的情况下尽可能选择与病灶垂直或最短的路线。进行穿刺点体表标记及记录进针深度和角度。(3)常规消毒铺巾,2%利多卡因局部浸润麻醉至胸膜,采用17G同轴针根据设计路径进行穿刺,当病灶较小或路径上有血管走行时,需采用分步进针法。(4)行CT扫描明确穿刺针到达病灶后,予以18G活检枪进行活检。尽可能多角度多部位采集标本。(5)当采集足够标本或患者出现较多咯血、明显气胸时,予以停止活检。拔除穿刺针,覆盖无菌敷料后,立即行CT扫描明确有无并发症及其程度。(6)将标本均置于10%福尔马林的容器中予以送检。(7)有明显针道出血、咯血患者,予以止血治疗,少量气胸患者予以吸氧,较多气胸患者置入胸腔引流管进行气体引流。有出现并发症患者,均密切关注生命体征的变化。
2 数据采集
记录患者信息(年龄、性别),肺部情况(肺气肿、主肺动脉直径、主肺动脉直径/升主动脉直径比),病灶信息(部位、大小、密度、CT增强值、CT净增强值、病灶有无穿行血管),穿刺情况(有无气胸、肺出血、穿刺针在肺内停留时间、穿刺深度)、病理结果(恶性病变、良性病变、转移瘤、非诊断结果)。所有CT图像由影像科两位医师进行分析,当结果不一致时经协商讨论统一结果。
3 相关定义
(1)肺出血定义:穿刺活检后CT图像中出现新的高密度磨玻璃影或实变影。肺出血的严重程度根据既往相关研究改良进行分类[7],即根据CT图像测量肺出血面积,将肺出血分为:a.无出血;b.少量肺出血:针道出血横径≤2 cm;c.较严重肺出血:针道出血横径>2 cm、肺叶出血、血胸(图1)。

图1 A、C、E为穿刺前图像,B、D、F为穿刺后即刻CT图像。根据CT图像测量肺出血面积:少量肺出血:针道出血横径≤2 cm(如图B);较严重肺出血:针道出血横径>2 cm(如图D)、血胸(如图F)
(2)根据CT图像测量脏层、壁层胸膜的距离,将气胸分为:0级:无气胸,1级:<0.5cm,2级:0.5~2cm,3级:2~4cm,4级:≥4cm[8]。
(3)肺动脉高压(PAH)评估:主肺动脉直径(mPAD)/升主动脉直径(AAD)比,测量方法:选择主肺动脉分叉处最宽直径测量mPAD和AAD,计算mPAD/AAD比值(图2)[9]。

图2 在纵隔窗,选择主肺动脉分叉处最宽直径测量主肺动脉直径(mPAD)和升主动脉直径(AAD)
(4)CT值测量方法:选取穿刺层面,尽量避开钙化、坏死、囊变、明显血管处,测量CT强化最大值与平扫值,取净强化值(强化最大值-平扫值)。(5)病灶大小:病灶最大层面长径与短径的平均值。(6)穿刺针在肺内停留时间:穿刺针进入肺后立即行CT扫描的时间,与穿刺针拔除后CT扫描时间间隔。
四、统计分析
在单因素分析中,分类变量采用χ2、Fisher精确检验,连续变量采用t检验或Mann-Whitney U秩和检验。在多因素分析中,将单因素分析结果中P<0.1的变量纳入二元logistic回归模型,使用进入法分析肺出血及较严重肺出血的独立危险因素。采用统计软件(SPSS 26.0)进行分析,P<0.05有统计学意义。
结 果
术后出现肺出血发生率为63.5%(779/1226),其中较严重出血率为20.5%(251/1226)。出现5例血胸(0.5%),其中1例因进行性出血后,疾病快速进展死亡,其余4例患者血流动力学稳定,予以持续监护及药物止血治疗后均正常出院。气胸发生率为37.7%(462/1226),其中37例(3.0%)需要放置胸腔引流管。
一、单因素分析结果
女性、未预防性止血、病灶较小、病灶有血管穿行、混杂磨玻璃病灶(mGGO)/纯磨玻璃病灶(pGGO)、穿刺路径较长、针在肺内时间较长、CT净强化值较高、转移瘤/良性病变更容易出现肺出血(见表1)。
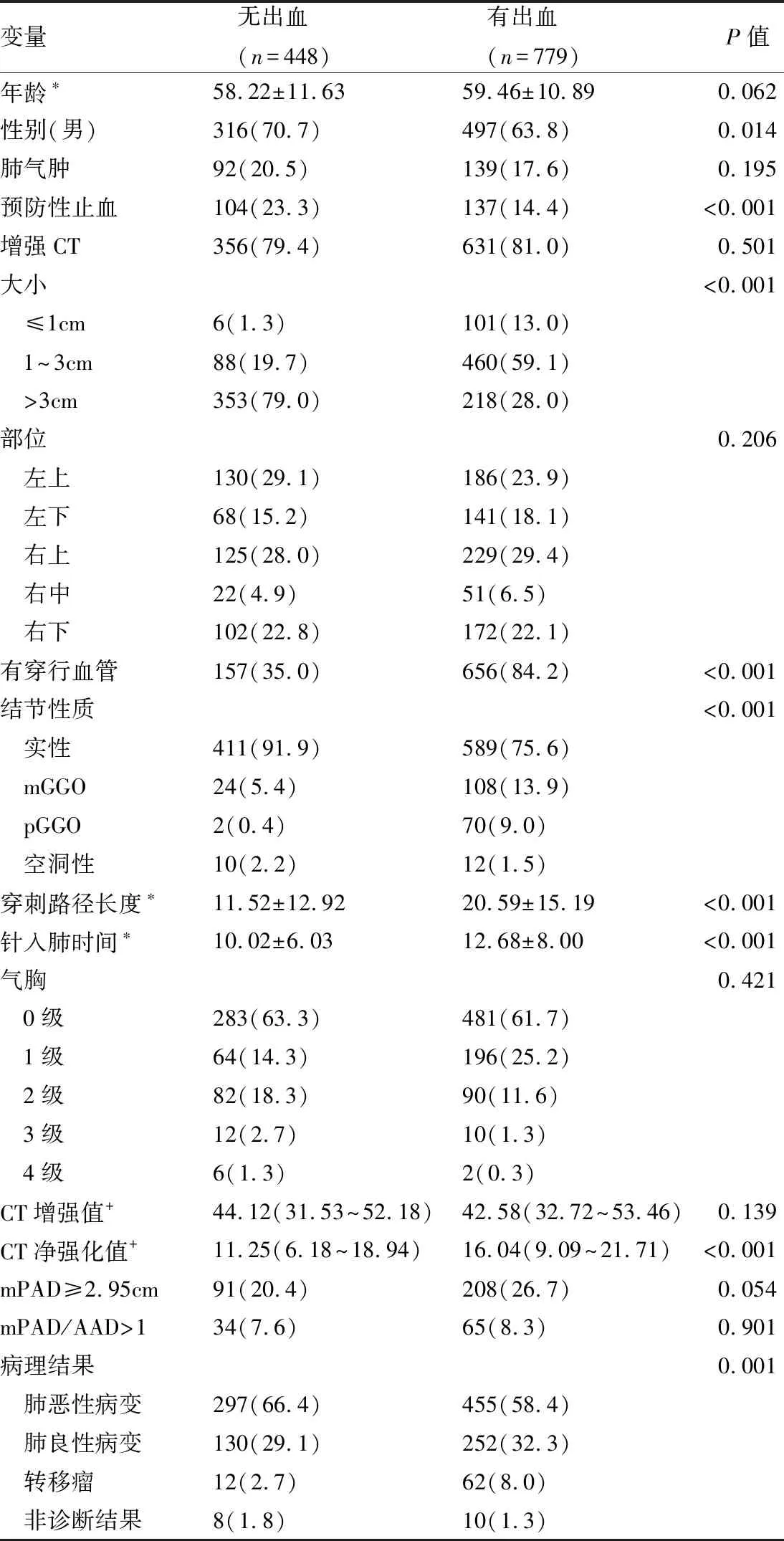
表1 肺出血危险因素分析结果
病灶较小、病灶有血管穿行、穿刺路径较长、mGGO/pGGO、无气胸、转移瘤更容易出现较严重肺出血(见表2)。

表2 较严重肺出血危险因素分析结果
二、多因素分析结果
年龄较大、病灶≤3cm、病灶有穿行血管、mGGO、pGGO、穿刺路径长、CT净增强值较大、穿刺针入肺时间长是肺出血独立危险因素。
病灶≤1cm、病灶有穿行血管、mGGO、pGGO、穿刺路径长是较严重肺出血的危险因素,预防性止血、2级气胸是较严重肺出血的保护因素(见表3)。
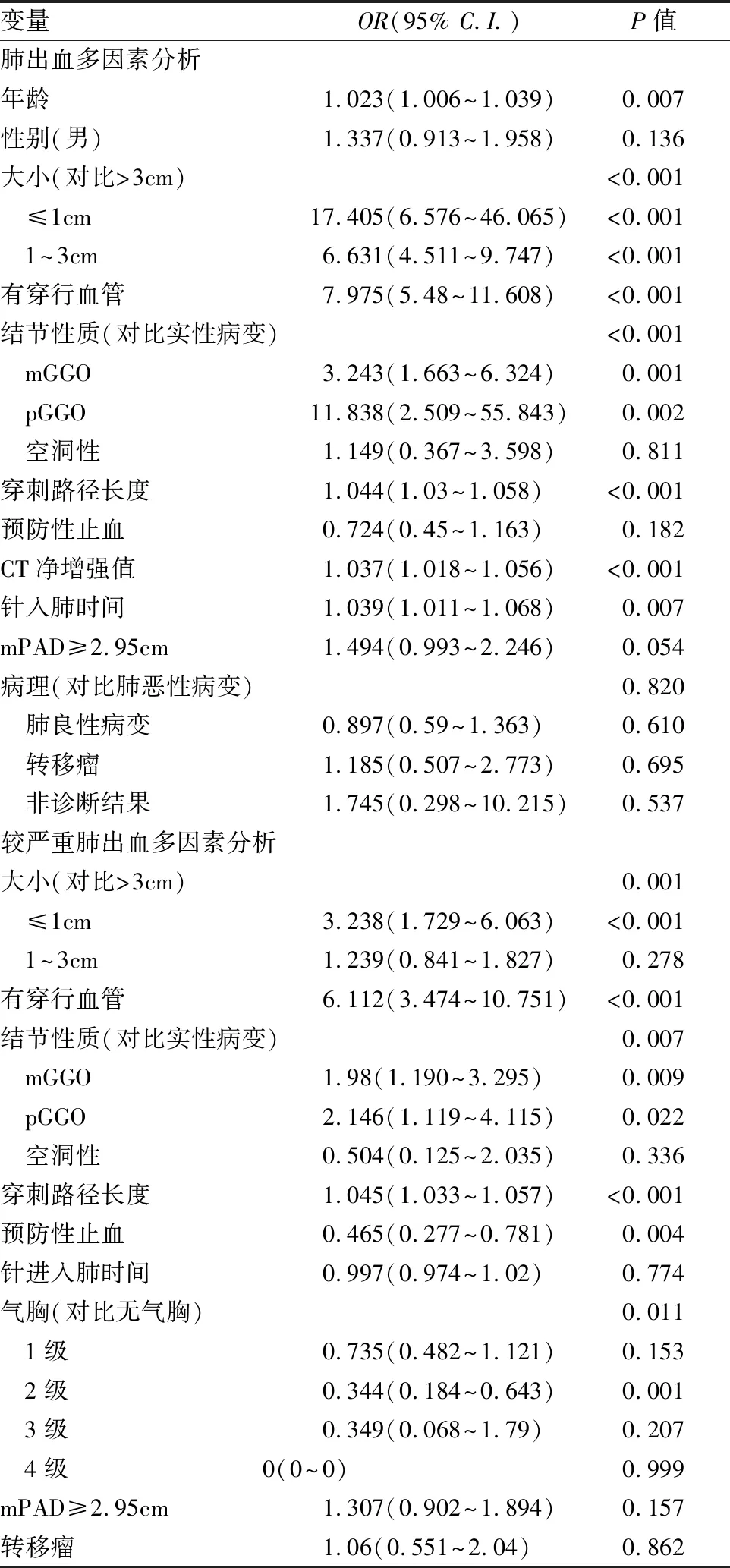
表3 肺出血危险因素的logistic回归多因素分析
讨 论
CT引导下经皮肺穿刺活检(PTNB)是诊断肺部占位性病变常用技术之一。PTNB安全性较高,但可能出现一定并发症, 肺出血是常见的并发症之一[6]。肺出血可表现为咯血、血胸,血胸有时仅有胸痛,可以不伴咯血,而危及患者生命。既往关于肺出血风险研究,大多讨论有关咯血相关风险,但咯血量多为估算,病史记录为事后记录,难以保证数据完整准确,不利于回顾性分析。本文基于CT评估肺出血量,相对客观,不依赖人为记录,避免遗漏血胸等较严重肺出血,有助于准确评估肺出血风险。
本项研究中,肺出血率为63.5%(779/1226),其中较严重出血率为20.5%(251/1226),这与既往报道的基于CT图像定义的肺出血率25.7%~65.6%相符[7, 10-12]。其中有五例血胸(0.5%),也与文献报道相近[13]。其中1例患者穿刺后出现进行性出血,经积极抢救治疗后出血逐渐停止,几天后因肺内病灶快速进展死亡。其影像表现为穿刺后新增的胸腔积液,无明显肺内出血,考虑其持续出血原因可能如下:1)肋间动脉出血;2)瘤内出血:该患者病理回报为肺转移性绒毛膜上皮癌,其特点是易侵蚀血管,本身有较高的出血倾向[14],且病灶紧靠胸膜,瘤内出血可沿针道直接破入胸腔内,从而导致其发生致命性出血。
本研究显示,病灶较小、穿刺路径较长、病灶周围有血管穿行是肺出血及较严重肺出血的独立危险因素,与以往研究[15-16]相似。≤1cm病灶的出血风险是>3cm病灶的17.405倍,发生较严重肺出血是>3cm病灶的3.238倍,这可能与小病灶穿刺难度高,调整次数多,穿刺时间较长,及周围包绕较多迂曲血管时较难避开有关。由于mGGO、pGGO病灶组织不够致密,压迫填塞的效果较差,特别要注意较严重肺出血风险。当病灶周围有穿行血管存在,出血风险明显增高,术前应仔细分析胸部增强CT,明确病灶血供及毗邻血管走行,穿刺活检应尽量使针尖平行血管。
选择病灶CT增强值较高的部位行穿刺活检,可以尽量避开坏死组织、有助于提高活检检出率。但CT强化程度还与病灶内血管数量、血管壁通透性等因素有关[17]。本研究提示选择CT增强值较高的部位进行活检,并不增加出血风险。进一步分析显示CT净增强值并不引起较严重肺出血,在CT净增强值较高部位取材相对安全。
肺动脉高压(PAH)是肺穿刺的相对禁忌症之一,PAH的高灌注状态可能会增加肺出血的风险。国外研究[18-19]利用胸部CT图像主肺动脉直径(mPAD)及其与升主动脉直径(AAD)的比值作为PAH的无创评估诊断标准,mPAD/AAD>1作为临界值的特异性、阳性预测值分别为92%、96%,mPAD>2.95cm的敏感度和特异度分别为70.8%和79.4%。本研究mPAD≥2.95cm、mPAD/AAD>1并无统计学差异,提示mPAD≥2.95cm、mPAD/AAD> 1,可能不是肺出血及较严重出血的危险因素,与Ryan Tai结果相似[12]。但这需要多中心研究进一步验证。
本研究显示,2级气胸(少量气胸)是较严重肺出血的一个保护因素,提示少量气胸可以产生一定的压力压缩肺组织,阻止进一步出血。
总之,在针对小而穿刺路径较长的病灶,周围穿行血管丰富的病灶,表现为GGO的肺内病灶行PTNB,应警惕和避免较严重肺出血。CT净增强值较高部位取材相对安全。肺动脉高压可能不是肺出血及较严重出血的危险因素。少量气胸可以缓解肺出血的进一步加重。

