蓝舌病毒NS4基因真核表达对IFN-β信号通路基因mRNA表达的影响
林俊泓,赵 瑶,陈玉娟,王 让,马鲜平,2*,易华山,2* (.西南大学 动物医学院,重庆 荣昌 402460;2.西南大学 医学研究院 免疫学研究中心,重庆 荣昌 402460)
蓝舌病(bluetongue,BT)是呼肠孤病毒科(Reoviridae)、环状病毒属(Orbivirus)的蓝舌病毒(bluetongue virus,BTV)感染反刍动物引起的非接触性传染病,通过库蠓叮咬传播,患病动物出现口鼻黏膜充血溃疡、唇部水肿、舌部发绀等症状,对绵羊的致死率较高[1-2]。1979年,张念祖等[3]首次在我国云南省发现并分离BTV。近年来,由于BT流行造成的严重经济损失,世界动物卫生组织(World Organization for Animal Health,OIE)将BT列为法定通报动物疫病,我国也将其列为一类动物疫病[4]。目前已有血清型BTV-1~27及若干候选新血清型(BTV-28、BTV-29、BTV-30、BTV-33、BTV-35),各型间交叉免疫的缺乏使动物较难获得有效疫苗保护[5-7]。除BTV-8等少数血清型外,山羊、牛等感染BTV后一般无明显临床症状,又成为BTV重要传染源[8]。
BTV是双链RNA(double-stranded RNA,dsRNA)病毒,成熟病毒粒子为二十面体对称的无囊膜圆形颗粒,由10个节段dsRNAs组成的基因组编码7种结构蛋白(VP1~VP7)和至少4种非结构蛋白(NS1、NS2、NS3/NS3A、NS4),其中NS1促进病毒蛋白质合成、NS2形成包涵体、NS3/NS3A调控BTV释放[9-11]。细胞对入侵的病毒通过模式识别受体(pattern-recognition receptors,PRRs)如维甲酸诱导基因Ⅰ(retinoic acid-inducible gene Ⅰ,RIG-Ⅰ)与黑色素瘤分化相关蛋白5(melanoma differentiation associated protein 5,MDA5)等识别并激活TANK结合激酶1(tank-binding kinase 1,TBK1)等,从而产生具有启动与增强抗原递呈、抑制病毒复制等广泛生物学活性的干扰素(inteferon,IFN)[12]。IFN激活Janus酪氨酸激酶-信号转导子和转录活化子(janus tyrosine kinases-signal transducers and activators of transcription,JAK-STAT)通路与后续胞核内的IFN刺激基因(interferon-stimulated genes,ISGs)如ISG15、泛素特异性蛋白酶18(ubiquitin-specific protease 18,USP18)等,发挥相应的抗病毒功能[13]。2011年,RATINIER等[14]在BTV Seg-9编码VP6的开放阅读框(open reading frame,ORF)中发现编码BTV NS4的ORF。NS4含77~79个氨基酸残基,在BTV-2、BTV-4、BTV-8等血清型中均高度保守[14-15]。RATINIER等[15]进一步构建BTV NS4缺失突变的研究表明NS4能拮抗IFN的产生,但不影响mRNA剪切或翻译,表明NS4可能作用于转录而非翻译水平。此外,NS4还与NS3共同作用通过靶向JAK-STAT通路中STAT1的SH2结构域并抑制其磷酸化、二聚化及核内转位[16]。鉴于上述NS4拮抗宿主天然免疫的研究,本研究构建表达BTV NS4基因的真核表达质粒,分析NS4-EGFP蛋白亚细胞定位特征及其对仙台病毒(Sendai virus,SeV)诱导的IFN通路基因mRNA转录的影响,为后续进一步研究NS4蛋白在BTV侵染宿主细胞过程拮抗IFN免疫应答的分子机制奠定基础。
1 材料与方法
1.1 细胞与质粒BTV NS4基因pMD-T-Simple-NS4质粒、pcDNA3.1-eGFP质粒和SeV由西南大学动物医学院兽医科学研究中心保存;HEK-293T细胞由重庆医科大学基础医学院刘太行博士惠赠。
1.2 主要试剂DNA Marker、NheⅠ、BamHⅠ、T4DNA连接酶均购自大连宝生物工程有限公司;质粒小提试剂盒、Axygen quick Gel Extraction Kit凝胶回收试剂盒购自Axygen公司;GFP Mouse Monoclonal Antibody、Flag Tag Mouse Monoclonal Antibody、辣根过氧化物酶标记山羊抗鼠IgG HRP(H+L)、胰酶、细胞裂解液、DAB显色试剂盒、0.1%TritonX-100、DAPI等购自碧云天生物技术公司;DMEM培养基(低糖)、胎牛血清、双抗(青链霉素)、PBS、EDTA购自Gibco公司;LipofectamineTM2000购自Invitrogen公司;细胞培养板购自Corning公司;TransStart Tip Green qPCR SuperMix试剂盒购自全式金公司;其他试剂均为进口或国产分析纯。倒置荧光显微镜LEICA DMi8购自德国LEICA公司。
1.3 引物的设计与合成参照NCBI中GenBank收录NS4基因序列(AFV68249.1)设计并合成引物NS4 F和NS4 R,在上下游引物5′端分别加入NheⅠ和BamHⅠ酶切位点(双下划线部分),在上游引物酶切位点后添加Kozak序列(虚线部分),在下游引物酶切位点后添加3×FLAG标签(下划线部分)。引物NS4 F:5′-CTAGCTAGCACCATGGATGGTGAGGGGACACAACAGA-3′;NS4 R:5′-GCCCTAGGCTTATCGTCGTCATCCTTGTAATC-GATCTTATCGTCGTCATCCTTGTAATCTCC-CTTATCGTCGTCATCCTTGTAATCCTACCC-ATCCTCCTCTGCTCG-3′。扩增NS4完整的ORF区,目的基因片段大小为321 bp。参照NCBI中GADPH(XM_027961471.1)、RIG-Ⅰ(XR_00-4673265.1)、MDA5(NM_022168.4)、VISA(NM_001206491.2)、TBK1(KU_182750.1)、IKKε(DQ_667176.1)、IRF3(XM_008966963.2)、TRAF3(NM_001199427.2)、TRAF6(XM_035012591.1)、IRF9(NM_001385400.1)、ISG15(NG_033033.2)、USP18(NM_017414.4)、IFN-α(NM_024013.3)、IFN-β(NM_002176.4)序列应用Primer-BLAST程序设计合成qRT-PCR引物(表1),引物由北京华大生物有限公司合成。

表1 引物序列及用途
1.4 NS4基因真核表达载体的构建以pMD-T-Simple-NS4为模板,NS4-F、NS4-R为引物PCR扩增NS4基因,反应总体系为25 μL。反应程序:95℃预变性5 min;95℃变性45 s,60℃退火45 s,72℃延伸1 min,35个循环;最后72℃延伸10 min,4℃保存。按照凝胶回收试剂盒说明书,对PCR产物进行回收纯化。回收产物经NheⅠ、BamHⅠ双酶切,并与同样酶切后凝胶回收的真核表达载体pcDNA3.1-eGFP连接、转化,挑取单克隆,提取重组质粒经PCR扩增鉴定及DNA测序、NCBI BLAST比对后,命名为pcDNA3.1-NS4-eGFP。
1.5 细胞培养与重组质粒的转染HEK-293T细胞在BSL2实验室用添加10% 胎牛血清和双抗(100 mg/L青霉素、链霉素)的DMEM培养基,37℃,50 mL/L CO2细胞培养箱中培养。2~3 d传代1次,试验操作均采用对数期生长细胞。转染前24 h将细胞铺于24孔板,使转染时细胞密度达到80%~90%时,按照LipofectamineTM2000说明书将构建的重组质粒pcDNA3.1-NS4-eGFP和真核表达载体pcDNA3.1-eGFP转染HEK-293T细胞,37℃,50 mL/L CO2细胞培养箱中培养。
1.6 Western blot分析及共聚焦显微镜观察将生长良好的HEK-293T细胞铺于24孔细胞培养板,待细胞密度达到80%左右时,分别转染pcDNA3.1-NS4-eGFP和pcDNA3.1-eGFP,转染24 h后,用倒置荧光显微镜观察转染情况。转染后24 h收集HEK-293T细胞,提取总蛋白,SDS-PAGE电泳后转至PVDF膜,5%封闭液37℃封闭1.5 h;鼠抗GFP抗体和鼠源FLAG抗体(一抗)1∶1 000稀释,室温孵育2 h;PBST洗膜6次,辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(二抗)以1∶5 000比例稀释,室温孵育1 h;PBST洗6次,显影,使用超高灵敏度化学发光检测仪FUSION FX-XT分析重组蛋白的表达情况。在24孔细胞培养板置入经75%酒精处理的爬片,铺生长良好的HEK-293T细胞,按前述操作转染24 h后,参考文献[17]的方法去培养基,用1×PBS洗3次,再用预冷的4%多聚甲醛室温固定20 min,随后进行室温DAPI染色10 min,1×PBS润洗2次后,应用共聚焦荧光显微镜观察摄像分析。
1.7 qRT-PCR分析SeV诱导的IFN相关基因mRNA表达将生长良好的HEK-293T细胞铺于6孔细胞培养板,待细胞密度达到80%左右时,分别将重组质粒pcDNA3.1-NS4-eGFP及pcDNA3.1-eGFP转染HEK-293T细胞,转染24 h后,用倒置荧光显微镜观察细胞荧光强度。接种20 HAU/mL SeV分别刺激24,48 h,收集细胞,吸去培养基后1×PBS清洗3次,提取细胞总mRNA,反转录,以cDNA为模板,以GADPH、RIG-Ⅰ、MDA5、VISA、TBK1、IKKε、IRF3、TRAF3、TRAF6、IRF9、ISG15、USP18、IFN-α、IFN-β基因引物参照全式金生物TransStart Tip Green qPCR SuperMix试剂盒操作说明进行qRT-PCR,反应体系为20 μL。应用ABI QuantStudio 3 Quantitative RT-PCR仪进行qRT-PCR反应,反应条件:94℃变性30 s,94℃退火30 s,60℃延伸30 s,共40个循环。

2 结果
2.1 NS4基因真核表达载体的构建构建的重组质粒pcDNA3.1-NS4-eGFP如图1A所示,经琼脂糖凝胶电泳检测及PCR扩增鉴定,在321 bp附近可见目的基因片段(图1B)。重组质粒菌液经重庆华大基因有限公司进行测序,测序结果进行在线BLAST和BioEdit软件分析比对,碱基均未发生突变,结果表明pcDNA3.1-NS4-eGFP重组质粒构建成功。
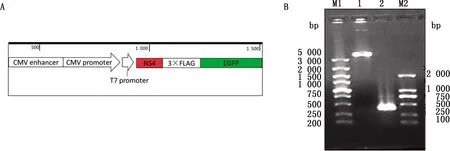
A.重组质粒示意图;B.重组质粒PCR扩增鉴定。M1.DL5000 DNA Marker;1.重组质粒电泳产物;2.NS4基因扩增产物;M2.DL2000 DNA Marker
2.2 NS4基因真核表达及亚细胞定位将pcDNA3.1-NS4-eGFP以及pcDNA3.1-eGFP转染至HEK-293T细胞,于36 h通过倒置荧光显微镜观察后裂解收集细胞总蛋白进行Western blot分析蛋白表达;将pcDNA3.1-NS4-eGFP以及pcDNA3.1-eGFP转染至HEK-293T细胞,36 h后通过荧光共聚焦显微镜观察NS4的亚细胞定位情况。结果显示,转染pcDNA3.1-NS4-eGFP、pcDNA3.1-eGFP质粒细胞中均呈强的绿色荧光蛋白信号(图2A);Western blot 结果表明,pcDNA3.1-eGFP空载体GFP蛋白约28 kDa,NS4-EGFP融合蛋白约40 kDa(图2B);共聚焦显微镜观察,NS4-EGFP融合蛋白在细胞质内主要沿细胞核膜分布,细胞核内主要集中于核仁部位(图2C)。结果表明构建的pcDNA3.1-NS4-eGFP真核表达载体可在HEK-293T细胞中瞬时表达BTV NS4-EGFP融合蛋白,NS4-EGFP融合蛋白在细胞核以及细胞质内均有分布。

A.NS4基因瞬时表达与倒置荧光显微镜观察;B.NS4基因瞬时表达与Western blot分析(1,2.pcDNA3.1-NS4-eGFP表达产物;3,4.pcDNA3.1-eGFP表达产物);C.NS4基因瞬时表达与共聚焦显微镜观察(1.NS4-EGFP融合蛋白;2.DAPI染色;3.叠加图;标尺示10 μm)
2.3 NS4基因瞬时表达对SeV诱导的RIG-Ⅰ、MDA5基因mRNA表达的影响将重组质粒pcDNA3.1-NS4-eGFP及pcDNA3.1-eGFP分别转染HEK-293T细胞24 h后,接种20 HAU/mL SeV分别刺激24,48 h后进行荧光显微镜观察和RIG-Ⅰ、MDA5基因mRNA表达分析。结果表明:重组质粒pcDNA3.1-NS4-eGFP及pcDNA3.1-eGFP转染HEK-293T细胞后SeV诱导24,48 h,随着诱导时间的延长,在HEK-293T细胞内均观察到由弱到强的绿色荧光信号(图3A)。分别以转染pcDNA3.1-NS4-eGFP及pcDNA3.1-eGFP空载体24 h后接种SeV刺激24,48 h的HEK-293T细胞cDNA为模板,以GADPH(内参基因)、RIG-Ⅰ、MDA5基因引物进行qRT-PCR分析。结果显示:在SeV诱导下,pcDNA3.1-NS4-eGFP组与对照组pcDNA3.1-eGFP相比细胞中RIG-Ⅰ、MDA5基因mRNA转录水平均极显著下调,特别在SeV诱导24 h后差异极显著(图3B,C)。
2.4 NS4基因表达对IFN相关基因mRNA表达的影响进一步以转染pcDNA3.1-NS4-eGFP及pcDNA3.1-eGFP空载体24 h后接种SeV刺激24,48 h的HEK-293T细胞cDNA为模板,以GADPH(内参基因)、VISA、TBK1、IKKε、TRAF3、TRAF6、IRF3、IFN-α、IFN-β、IRF9、ISG15、USP18基因引物进行qRT-PCR分析。结果显示:pcDNA3.1-NS4-eGFP组与对照组pcDNA3.1-eGFP细胞相比,VISA、IKKε基因在SeV诱导24 h后mRNA表达水平下调,且差异显著(0.01

A.重组质粒转染HEK-293T与SeV诱导后细胞荧光显微镜观察;B.qRT-PCR分析RIG-Ⅰ基因mRNA表达;C.qRT-PCR分析MDA5基因的mRNA表达。**.差异极显著(P<0.01);*.差异显著(0.01 A.SeV刺激24 h后相关基因qRT-PCR分析;B.SeV刺激48 h相关基因qRT-PCR分析 A.IFN-α基因的mRNA表达分析;B.IFN-β基因的mRNA表达分析 研究表明,BTV作为无囊膜dsRNA病毒,在复制过程中产生的至少4种非结构蛋白(NS1、NS2、NS3/NS3A、NS4)中,NS3/NS3A拮抗宿主干扰素应答从而促进BTV复制[16,18]。NS4基因在BTV不同血清型间的表达有差异,能与细胞内的脂滴相互作用而保护病毒dsDNA不被胞内DNA酶降解[14,19]。研究也发现,NS4蛋白在IFN-α/β受体缺陷(IFNAR-/-)的小鼠中表达量低,在一定剂量IFN处理的细胞中有利于BTV的复制,是细胞内IFN信号通路的拮抗剂[14-15]。本课题组在前期的研究中对NS4基因进行克隆及序列分析[20],为进一步探究NS4基因对IFN-β信号通路基因mRNA表达的影响,本研究成功构建BTV NS4基因真核表达载体,在HEK-293T细胞中NS4-EGFP融合蛋白亚细胞定位结果与RATINIER等[14]报道的NS4主要位于核仁中,与核仁标记物有较强的共定位特征相一致。本研究在此基础上观察NS4-EGFP融合蛋白在细胞质中主要沿细胞核膜分布,对NS4二级结构分析以及构建缺失突变体的研究发现其N端具有核定位信号(nuclear localization signal,NLS),C端有核输出信号(nuclear export signal,NES),参与核胞浆穿梭,N端的NLS可能与宿主天然免疫反应中核内激活的IFN刺激反应元件(IFN-stimulated response elements,ISREs)有关[14,20-21]。 天然免疫系统可以通过PRRs识别病原相关分子模式(pathogen associated molecule patterns,PAMPs),进而启动天然免疫应答,其中RIG-Ⅰ、MDA5识别病毒后与VISA作用,激活TBK1、IKKε和NF-κB,磷酸化IRF3和IRF7使其入核,产生IFN,激活JAK-STAT信号通路,形成ISGF3入核,从而激活一系列相关的ISGs发挥抗病毒作用[22-23]。SeV作为一种RNA病毒,是细胞IFN应答的有效诱导剂[24]。本试验将构建的NS4基因真核表达质粒pcDNA3.1-NS4-eGFP转染至HEK-293T细胞中,在SeV诱导作用下,NS4-EGFP融合蛋白对病毒诱导的RIG-Ⅰ、MDA5基因mRNA转录水平具有明显的下调作用,表明NS4-EGFP融合蛋白对SeV诱导的RIG-Ⅰ、MDA5基因转录具有重要调节作用。本研究进一步分析VISA、TBK1、IKKε、TRAF3、TRAF6、IRF3、IFN-α、IFN-β、IRF9、ISG15、USP18基因的mRNA表达水平,表明NS4基因的表达显著影响TBK1、TRAF6、IRF9、ISG15、USP18基因mRNA转录,这可能与SeV诱导的IFN应答上游基因RIG-Ⅰ、MDA5下调表达相关,进而下调SeV诱导的下游IFN-β基因的mRNA转录。这一发现与RATINIER等[15]对BTV构建NS4基因缺失突变的研究结果相一致,但本研究发现TBK1、TRAF6、IRF9、ISG15、USP18等基因参与NS4基因拮抗宿主细胞IFN-β信号通路的调控,为进一步研究NS4基因拮抗宿主细胞天然免疫应答的分子机制奠定了基础。 在天然免疫应答中产生的Ⅰ型IFN与相应的IFN细胞表面受体(IFNAR)结合,激活 JAK-STAT信号通路[25]。IFN-α与IFN-β同属于Ⅰ型IFN,可通过抑制病毒核酸转录及阻断细胞间信号传递等发挥抗病毒作用[26-27]。本研究结果表明NS4基因的表达对IFN-α基因mRNA转录水平的抑制差异不显著,但极显著影响IFN-β基因mRNA的转录,NS4蛋白在BTV调节宿主细胞RIG-Ⅰ、MDA5基因表达,依赖MyD88的途径从而诱导Ⅰ型IFN的产生或阻断JAK-STAT通路来逃避宿主细胞免疫应答中所发挥的作用仍需进一步研究[28-30]。本研究也发现在HEK-293T细胞中瞬时表达NS4基因24 h 后,添加SeV诱导48 h,TRAF6、IRF9、ISG15 mRNA转录水平极显著下调,但VISA、TBK1、IKKε、IRF3、TRAF3及USP18基因mRNA转录水平变化不明显,表明NS4基因拮抗病毒诱导的IFN信号通路时可能存在选择性,且细胞内存在相关基因的调节蛋白时,可能通过其他分子调控IFN-β基因表达。研究表明,猪流行性腹泻病毒的NSP7、羊口疮病毒的VIR、口蹄疫病毒的NSP2b以及同为呼肠孤病毒科的轮状病毒的NSP1等非结构蛋白均具有拮抗宿主IFN应答的作用[31-34]。本研究结果表明BTV NS4基因的表达,影响RIG-Ⅰ、MDA5、TBK1、TRAF6、IRF9、IFN-β与ISGs(ISG15、USP18)基因mRNA的转录水平,拮抗HEK-293T细胞内IFN信号通路,为后续进一步分析BTV NS4基因与IFN信号通路相关蛋白之间的互作及调控机制研究奠定了基础。

3 讨论
——一道江苏高考题的奥秘解读和拓展

