鉴别牛肠道病毒感染复合PCR方法的建立及初步应用
章 凡,常晓冉,王浴光,杨茗葳,米日古丽买吐送,董 坤,胡俊英,王新平,2* (.吉林大学 动物医学学院,吉林 长春 30062;2.吉林大学 人兽共患病研究所 教育部人兽共患病研究重点实验室,吉林 长春 30062)
肠道病毒(enterovirus,EV)为小核糖核酸病毒科肠道病毒属成员[1-2],其所引起的感染严重危害人类健康和畜牧业的发展。该病毒为无囊膜单股正链RNA病毒,病毒粒子大小为20~30 nm,具有典型的二十面体结构[3]。根据国际病毒分类委员会(ICTV)的最新分类,肠道病毒属分为12个肠道病毒种(A、B、C、D、E、F、G、H、I、J、K、L)与3个鼻病毒种(A、B、C)[4],其中E种(EV-E)和F种(EV-F)主要感染牛,G种主要感染猪, H、J种主要感染灵长类动物,I种主要感染单峰骆驼,K、L为新的肠道病毒种。
牛肠道病毒(bovine enterovirus,BEV)感染于1959年首次由MOLL等[5]报道,之后许多国家也先后报道有本病的发生与流行[6-11]。李英利等[12]于2011年报道从内蒙古腹泻犊牛体内分离到我国第1株EV-F,确定我国牛群存在EV-F感染。本实验室于2012年从吉林省长春市某牛场发病牛群中分离获得首株EV-E HY12毒株[1-2],进而确定国内牛群存在EV-E感染。由于EV-E和EV-F属于两个不同的肠道病毒种,两者间的核苷酸差异很大,属于不同的血清型/基因型,因而常规方法难以将其区别[12]。近年来研究发现,国内许多地区牛群存在EV-E或EV-F肠道病毒感染,且某些牛群存在不同肠道病毒种的混合感染[13-15]。虽然有关检测EV-E或EV-F的研究逐年增加,但鉴别EV-E和EV-F感染的方法尚未见有报道。因此,迫切需要建立一种快速鉴别EV-E和EV-F的方法。本研究根据GenBank收录的EV-E和EV-F的全基因组序列比对分析结果,合成了2对特异性引物,建立了鉴别EV-E和EV-F的复合PCR方法,并初步用于临床样品的检测。
1 材料与方法
1.1 病毒株和临床样品牛细小病毒、牛病毒性腹泻病毒、EV-E HY12毒株、EV-F SD-S67毒株等病毒由本实验室鉴定保存。待检牛粪便样本采自长春地区牛场,共计32份,样品按常规方法处理、保存。
1.2 主要试剂和仪器TRIZol试剂、反转录试剂盒、TaqDNA聚合酶、DL2000 DNA Marker均购自TaKaRa公司;DNA凝胶回收试剂盒购自天根生化科技有限公司; ETC811 基因扩增仪为北京东胜创新生物科技有限公司产品;EPS300 电泳仪、4600SF紫外成像仪为上海天能科技有限公司产品; NanoDrop2000紫外可见分光光度计购自美国Thermo Forma公司;D1524R高速冷冻离心机购自北京大龙兴创实验仪器有限公司。
1.3 引物设计与合成根据GenBank收录的EV-E(D00214、DQ092792、DQ092786、KU17-2420、JQ690748、KF748290)和EV-F(DQ0-92770、DQ092795、DQ092794、AY462106、LC038-188)的基因组序列,以Meg Align(DNAStar)软件进行序列分析,利用Premier 5.0软件设计、合成2对引物,预计扩增EV-E和EV-F的基因片段大小分别为604,288 bp。引物由生工生物科技有限公司合成,引物信息见表1。
1.4 EV-E和EV-F单一PCR方法的建立应用提取的EV-E和EV-F感染细胞的RNA,合成cDNA,并以合成的cDNA为模板,进行病毒基因片段的PCR扩增。PCR反应体系为25 μL,即于反应体系中加入2×rTaq酶12.5 μL,模板0.5 μL,上、下游引物至终浓度为10 μmol/L,最后以ddH2O补至25 μL。反应程序:95℃ 5 min;95℃ 30 s,51℃ 30 s,72℃ 30 s,共35个循环;最后72℃ 10 min。同时以未加模板作为阴性对照。在此基础上进行EV-E和EV-F单一PCR的特异性及敏感性试验,PCR扩增产物以1.0%琼脂糖凝胶进行电泳鉴定。
应用DNA凝胶回收试剂盒,纯化和回收目的产物,并将其克隆到pMD18-T载体中,构建重组质粒 pMD18-EV-E和pMD18-EV-F。鉴定出的阳性重组质粒序列测定后,以紫外分光光度计测定浓度,并计算其拷贝数,于-20℃保存备用。

表1 复合PCR引物信息
1.5 复合PCR检测方法的建立条件优化以单一PCR扩增的条件为参考,利用梯度PCR程序对复合PCR反应体系进行优化。以不同的退火温度(50~60℃)和反应体系(10~30 μL)等条件进行PCR扩增。
1.6 特异性试验应用优化后的复合PCR方法,对混合感染EV-E和EV-F病料的cDNA及实验室保存的阳性牛细小病毒、牛病毒性腹泻病毒的核酸进行检测。
1.7 敏感性试验以不同稀释浓度的阳性质粒为模板,进行PCR扩增,确定出PCR扩增特异性片段所需要的最低拷贝数,即PCR的敏感性。
1.8 重复性试验以混合的EV-E和EV-F的cDNA为模板,应用建立的PCR方法重复检测3次,确定该方法的可靠性和重复性。
1.9 应用性试验应用建立的复合PCR方法,检测吉林省长春地区疑似BEV感染的32份临床样本,并与ELISA检测结果进行比较,计算两者符合率。
2 结果
2.1 单一PCR扩增结果利用P1/P2和P3/P4引物分别对EV-E和EV-F阳性DNA模板进行PCR扩增,琼脂糖凝胶电泳后可检测到 604 bp(EV-E)和 288 bp(EV-F) 大小片段(图1,2)。特异性结果均仅能扩增出EV-E或EV-F。敏感性结果显示,扩增出的EV-E和EV-F最低拷贝数为 3.67×102,5.21×103拷贝/μL。序列测定结果显示,大小为 604,288 bp 的片段分别为EV-E和EV-F。

A.EV-E单一PCR扩增结果(1.阴性对照;2.EV-E 扩增产物);B.EV-E特异性试验(1.阴性对照;2.EV-E;3.BVDV);C.EV-E敏感性试验(1~10.3.67×109~0拷贝;11.阴性对照); M.DL2000 DNA Marker
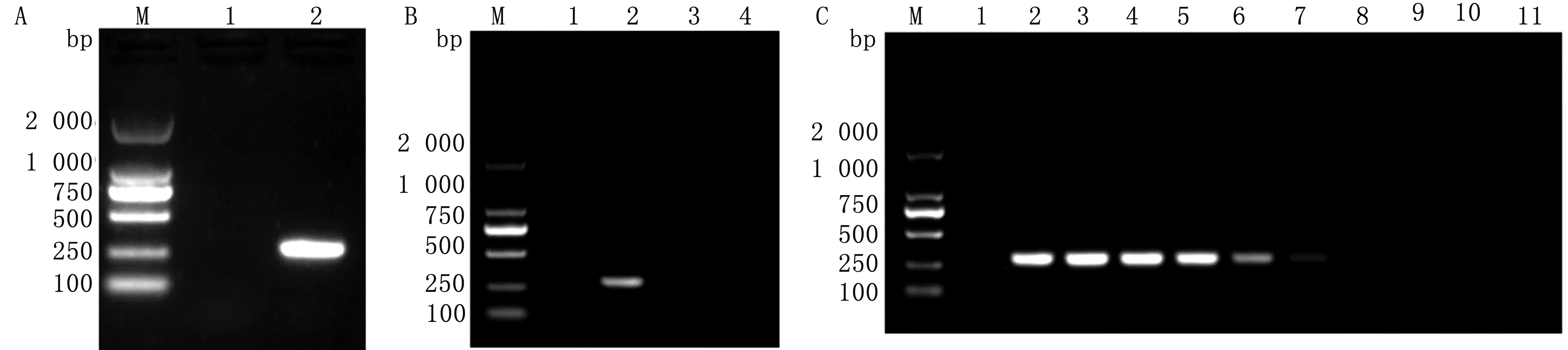
A.EV-F单一PCR扩增结果(1.阴性对照;2.EV-F扩增产物);B.EV-F特异性试验(1.阴性对照;2.EV-F;3.BVDV);C.EV-F敏感性试验(1~10.3.67×109~0拷贝;11.阴性对照);M.DL2000 DNA Marker
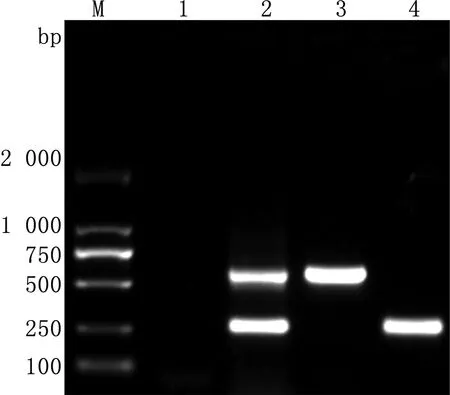
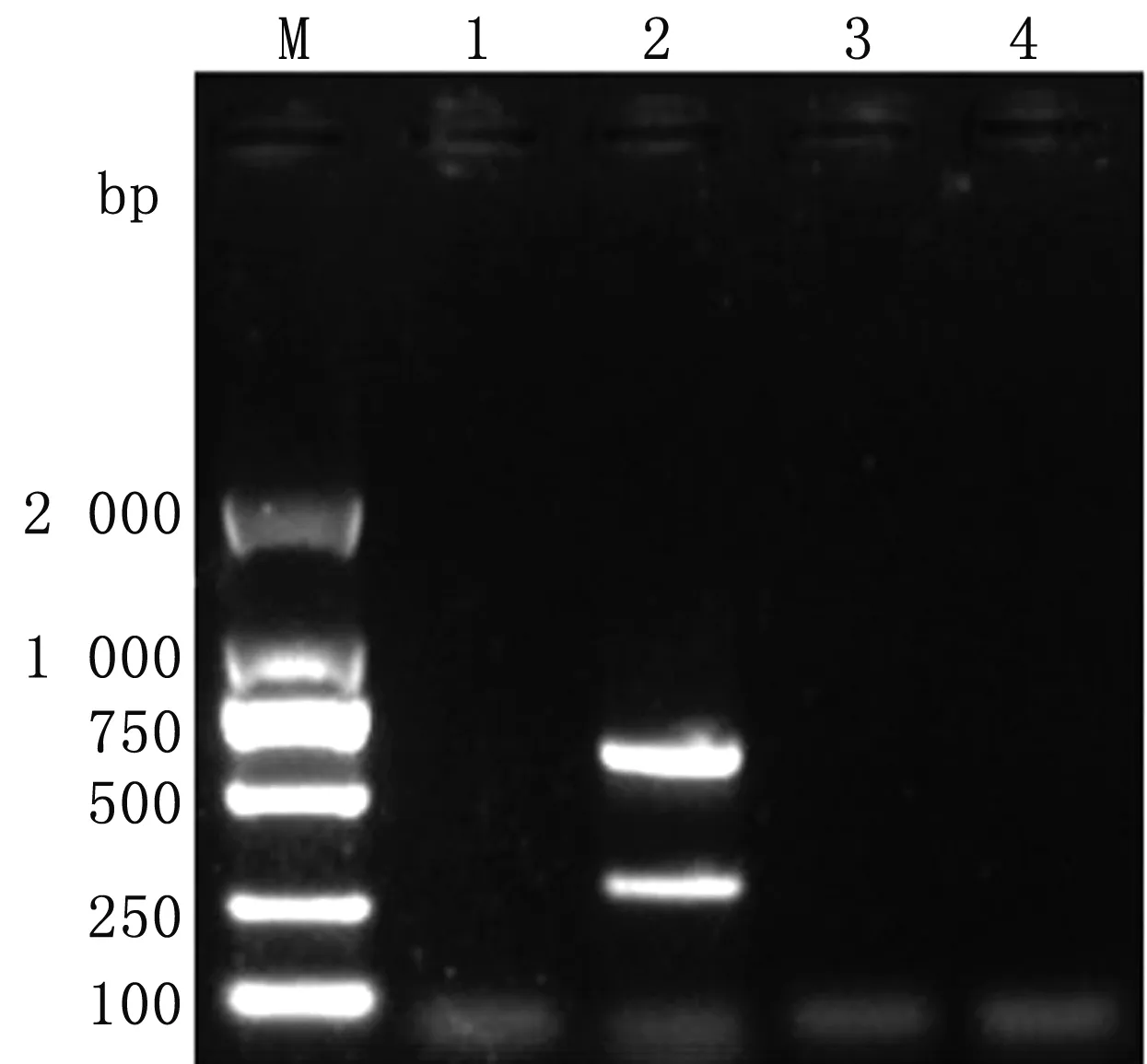
2.2 复合PCR的扩增及条件优化结果优化确定出的最终反应体系为10 μL,包括2×rTaq酶5 μL;引物P1、P2、P3、P4各为0.5 μL;模板0.5 μL;去离子水2.5 μL。最佳反应程序:95℃ 5 min; 95℃ 30 s,56℃ 30 s,72℃ 30 s ,共35个循环; 72℃ 10 min(图3,4)。以优化后的复合PCR的反应条件,将EV-E和EV-F的混合cDNA作为模板,进行PCR扩增,同时设阴性对照。扩增产物经琼脂糖凝胶电泳后,可见混合cDNA组同时扩增出2条带,其大小与单一cDNA组扩增条带相同(图5)。

M.DL2000 DNA Marker;1.阴性对照;2.5 μL;3.10 μL;4.15 μL;5.20 μL;6.25 μL;7.30 μL

M.DL2000 DNA Marker;1.阴性对照;2.51℃;3.52℃;4.53℃;5.54℃;6.55℃;7.56℃;8.57℃;9.58℃;10.59℃;11.60℃
2.3 复合PCR特异性结果应用复合PCR方法分别扩增EV-E和EV-F混合cDNA、牛细小病毒cDNA、牛病毒性腹泻病毒cDNA。除EV-E和EV-F混合cDNA组扩增出2条特异性条带,其余均未扩增出条带,表明复合PCR具有良好的特异性(图6)。
2.4 复合PCR的敏感性试验结果将紫外分光光度计测定的pMD18-EV-E和pMD18-EV-F质粒充分混匀后,确定出pMD18-EV-E和pMD18-EV-F的初始拷贝数约为 3.67×1010, 5.21×1010拷贝/μL。以10-1~10-10的梯度进行稀释,进行PCR扩增。建立的复合PCR方法检测EV-E和EV-F的最低检测滴度为 3.67×102,5.21×103拷贝/μL(图7)。
M.DL2000 DNA Marker;1.阴性对照;2.复合PCR扩增EV-E和EV-F混合cDNA产物;3.EV-E PCR产物;4.EV-F PCR产物
M.DL2000 DNA Marker;1.阴性对照;2.EV-E和EV-F混合cDNA扩增结果;3~4.复合PCR扩增牛细小病毒和牛病毒性腹泻病毒结果
2.5 复合PCR的重复性结果以复合PCR分别对3份样品进行3次重复性检测,结果EV-E和EV-F均为阳性,且阴性对照正常(图略),说明试验方法重复性良好。
2.6 复合PCR的初步应用结果用建立的复合PCR方法和ELISA方法对32份临床样品进行检测。所建立的复合PCR方法检测出的EV-E阳性数为9份(阳性率28.13%),EV-F阳性数为11份(阳性率34.38%),混合感染率为15.63%。与ELISA检测结果符合率为100.0%(图8,表2)。
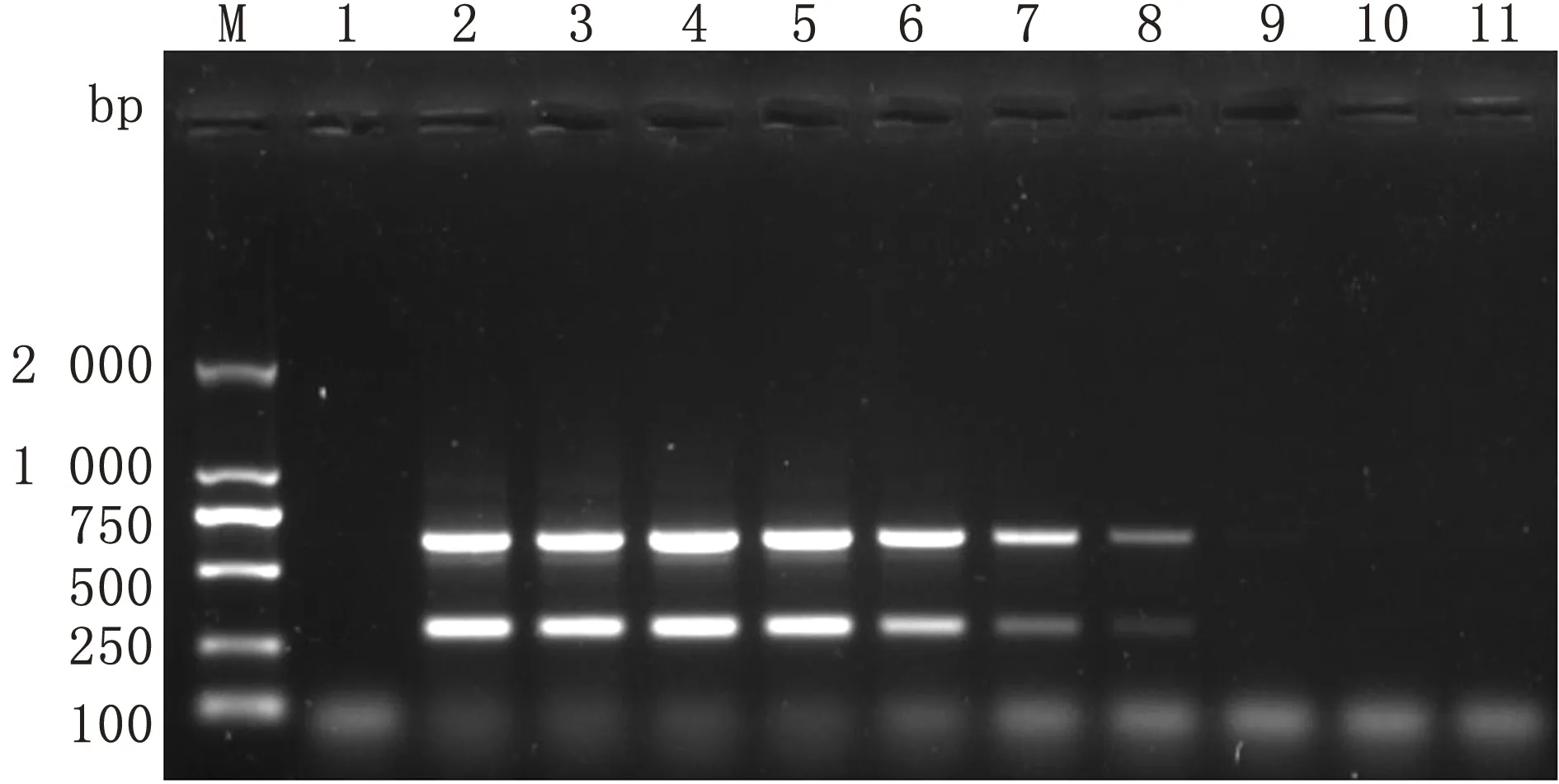
M.DL2000 DNA Marker;1.阴性对照;2~11.pMD18-EV-E和pMD18-EV-F混合质粒作10-1~10-10稀释后的复合PCR结果
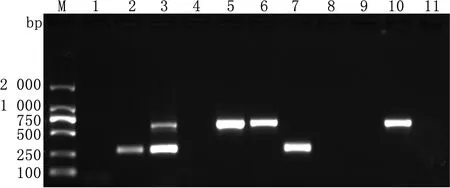
M.DL2000 DNA Marker;1.阴性对照;2~11.部分粪便样品的复合PCR结果
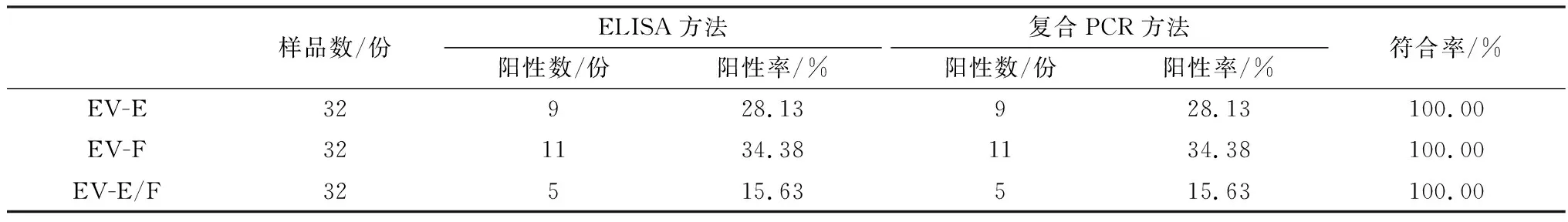
表2 RT-PCR和ELISA检测临床样品结果
3 讨论
BEV感染为国内新发的传染病,有关本病的研究近年来虽然取得了一些进展,但其诊断方法与流行病学研究仍然缺乏。目前,国内检测 BEV感染的方法主要有病毒分离、RT-PCR、实时荧光定量PCR、双抗体夹心ELISA等方法[16-18],这些方法虽然在确定国内牛群存在新发EV-E和EV-F感染方面发挥了重要作用,但由于它们只针对单一病毒血清型或基因型,因而在诊断 BEV感染中,难以揭示出牛群中的真实感染情况。本课题组前期对国内不同地区 BEV感染进行流行病学研究,发现国内许多地区的牛群同时存在EV-E和EV-F病毒混合感染的情况[13-15],导致 BEV感染的诊断与防控更加复杂。为了能够迅速同时确定出牛群中感染BEV的基因型或血清型,本研究基于对EV-E和EV-F的基因组的比对分析结果,分别设计了特异性扩增EV-E和EV-F的引物,并以此建立了可以依据扩增片段的大小进而鉴别EV-E和EV-F感染的复合PCR方法。特异性试验结果表明,建立的复合PCR仅能够检测出 BEV,具有较高的特异性;敏感性和重复性试验结果显示,该方法具有较高的敏感性和良好的重复性,且快速简便,可用于 BEV基因型/血清型的鉴别及诊断与流行病学调查研究。
本试验同时将2对引物的GC含量控制在50%~59%,以尽量降低GC含量差异对复合PCR的影响。在进行PCR反应体系及条件的优化中,发现应用25 μL体系进行复合PCR反应时,EV-E的扩增效率明显高于EV-F的扩增效率,导致EV-F检测结果呈现假阴性。而在10 μL反应体系下,两种引物扩增效率都比较高,从而使同时高效检测EV-E和EV-F成为可能。

