高糖环境对软骨细胞RANKL/OPG表达的影响
刘培珑,张言,梁景棋,刁佳宇,刘欢,梁晓军,张峰,赵宏谋*
(1.西安交通大学附属红会医院足踝外科,陕西 西安 710054;2,陕西省人民医院心血管内科二病区,陕西 西安 710068;3,西安交通大学公共卫生学院,陕西 西安 710048)
夏科氏骨关节病(charcot osteoarthropathy,CA)是一种周围神经病变引起的骨关节进行性、破坏性疾病,近年来随着全球范围内糖尿病患者的增加和病程延长,糖尿病已经成为了CA的主要病因[1]。CA的发病机制复杂,可能与多个因素有关,包括神经病变、代谢紊乱、使用激素造成的骨质疏松等,确切机制尚不清楚[2]。CA的早期研究主要集中在骨破坏方面,对于CA关节软骨破坏机制的研究则罕有报道。我们的前期研究发现,CA的透明软骨呈条索状排列,软骨细胞大量减少,同时破骨细胞聚集,软骨下骨增生且排列紊乱;且软骨细胞中核因子κB受体活化因子配体(receptor activator for nuclear factor-κ B ligand,RANKL)与骨保护素(osteoprotegerin,OPG)的表达与正常对照组存在显著差异[3]。但是这种差异是否与糖尿病患者体内高糖环境有关尚不清楚,国内外尚无关于糖浓度与软骨细胞RANKL/OPG表达情况的研究,因此本研究的目的是观察不同糖浓度对于正常软骨细胞RANKL及OPG表达的影响,以期为明确CA的发病机制及临床防治提供参考。
1 资料与方法
1.1 软骨组织来源 8例正常软骨,男性5例,女性3例;年龄29~55岁,平均年龄(41.3±12.6)岁。均来自于因车祸及严重外伤需要截肢的患者的胫距关节,术中确认关节软骨正常。本研究通过医院伦理委员会审批(批号:201910002),所有患者均为自愿捐赠,并签署知情同意书。
1.2 实验材料与试剂 细胞培养中所需的Dulbecco氏培养基(Dulbecoo's modified eagle medium,DMEM)/无糖培养基、DMEM/F12培养基、DMEM/高糖培养基、胎牛血清、青霉素和链霉素双抗溶液购自美国HyClone公司;胰蛋白酶、Ⅱ型胶原酶购自美国Sigma公司;RANKL抗体、OPG抗体及β-actin购自美国CST公司;葡萄糖测定试剂盒购自美国Sigma公司;CO2培养箱及酶标仪购自美国Thermo公司。
1.3 软骨细胞培养及实验分组 将软骨样本切成3~5 mm3的小块,置于含青霉素(100 U/L)和链霉素(100 mg/L)的磷酸盐缓冲液(phosphate buffer solution,PBS)中冲洗后,用1 mL 0.25%胰蛋白酶室温下消化15~20 min后,1 000 r/min离心5 min,吸除上清液后使用PBS洗涤3次。再加0.2% Ⅱ型胶原酶后置于37℃恒温摇床中消化8~10 h,后加入2 mL培养液终止消化。使用200目过滤网过滤软骨碎片,滤液1 000 r/min离心10 min,丢弃上清,使用PBS洗涤2次。使用DMEM/无糖培养基和DMEM/高糖培养基(33 mmol/L)按比例配制葡萄糖浓度为5 mmol/L(正常组)、10 mmol/L、15 mmol/L、20 mmol/L、25 mmol/L、33 mmol/L培养基,配制完成后取不同浓度的培养液加入葡萄糖浓度测定试剂盒,然后使用酶标仪测定340 nm吸光值以确定浓度符合实验要求。将软骨细胞分为6组,分别使用葡萄糖浓度为5 mmol/L、10 mmol/L、15 mmol/L、20 mmol/L、25 mmol/L、33 mmol/L含10%胎牛血清的DMEM培养基,置于37℃、5% CO2培养箱中进行培养,每3 d更换1次培养液,带原代细胞融合率达到85%~90%时进行传代,传代细胞用于后续实验。
1.4 Western blot检测RANKL/OPG蛋白表达 分别取6组软骨细胞,用各组含10%胎牛血清的DMEM培养基将细胞浓度调整为1×106/mL的细胞悬浮液,接种到6孔板中,每孔1 mL,每组设置3个复孔。在37℃、5% CO2培养箱中培养48 h后,每孔加入100 μL裂解液,放在冰上裂解30 min后,4℃ 1 000 r/min离心15 min;吸取蛋白上清液,用聚氰基丙烯酸正丁酯(butyleyanoacrylate,BCA)蛋白定量试剂盒检测提取蛋白的浓度。用超纯水将蛋白样品浓度稀释为3 μg/mL,按照4∶1比例与溴酚蓝上样缓冲液混合后煮沸5 min。在蛋白凝胶中每泳道加入蛋白样品20 μL,以电压120 V电泳,观察溴酚蓝进入分离胶底端时终止电泳。以90 V电压转膜90 min后,在室温下5%脱脂奶粉中封闭90 min。用PBS加Tween 20(PBS plus tween 20,PBST)洗涤3次,每次5 min。加入1∶1 000稀释的RANKL单克隆抗体、OPG单克隆抗体及β-actin单克隆抗体4℃孵育过夜。次日用PBST洗涤3次,每次5 min,再加入1∶2 000稀释的二抗(辣根过氧化物标记的IgG)在室温孵育2 h后,电化学发光(electro-chemi luminescence,ECL)法显影并于暗室内曝光。采用Image-Pro Plus图像分析软件分析各蛋白条带的灰度值,以β-actin作为内参,计算目的蛋白的相对表达量。实验重复3次。目的蛋白的相对表达量=目的蛋白灰度值/β-catin灰度值。
1.5 统计学方法 采用SPSS 18.0统计软件对数据进行分析,多组间计量资料的比较采用χ2检验,两组间的比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结 果
随着培养液糖浓度的增高,RANKL蛋白与OPG蛋白的表达量均呈逐渐减小趋势,RANKL蛋白表达量由2 613.8降低至975.6,OPG蛋白表达量由3 377.3降低至140.2(见表1,见图1~2),组间比较存在显著性差异(P<0.01);各高糖培养组与正常对照组相比,蛋白表达量均显著减小(P<0.01)。然而,随着培养液糖浓度的增高,OPG蛋白表达量的减小趋势更加显著,因此,RANKL/OPG相对表达量的比值则呈增加趋势。当培养液糖浓度>15 mmol/L时,RANKL/OPG的比值呈显著增加趋势,在20 mmol/L时比值达到最高点,之后随培养液糖浓度的增加则略有降低(见图3)。
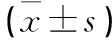
表1 不同糖浓度干预软骨细胞后RANKL及OPG表达量
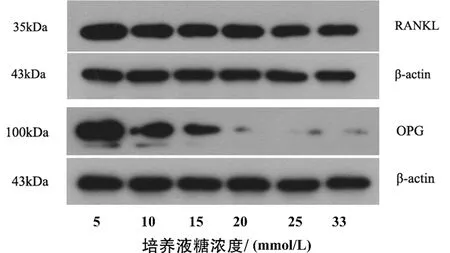
图1 不同糖浓度培养的软骨细胞RANKL与OPG蛋白表达的Western-Blot结果
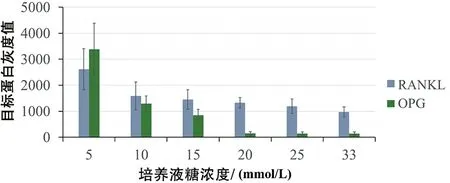
图2 不同糖浓度培养的软骨细胞RANKL与OPG蛋白表达灰度结果
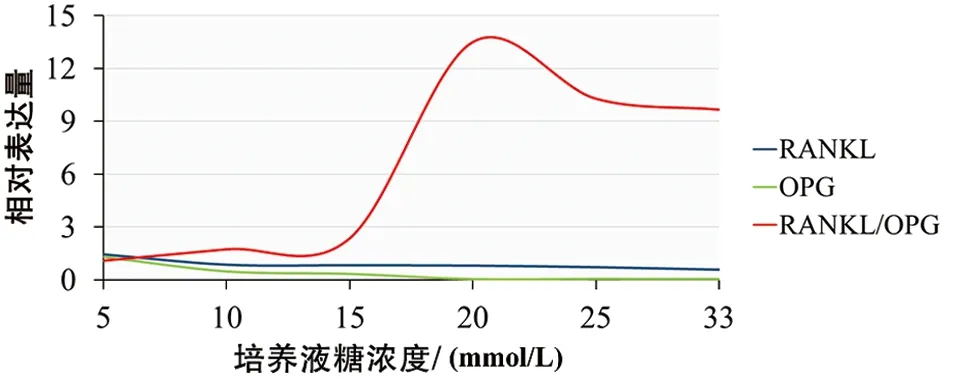
图3 不同糖浓度培养的软骨细胞RANKL/OPG相对表达量与比值趋势
3 讨 论
足踝部CA一旦出现,进展迅速,破坏严重,发病顺序常始于关节内部,导致关节软骨及周围稳定组织破坏,进而导致关节脱位与关节周围骨量丢失,治疗效果较差。骨性畸形导致相应皮肤压力增高并产生溃疡,增加了感染风险[4]。而CA的治疗仍局限于出现骨关节破坏后的外科治疗,对于现溃疡者截肢率和死亡率均非常高[5-6]。因此,揭示CA的发病机制,寻找有效且特异的防治措施,对于糖尿病患者早期预防CA的发生与发展有着非常重要的意义。
RANKL/OPG系统是在破骨细胞分化过程中的一个重要信号传导通路[7]。研究认为RANKL/OPG信号通路在CA的骨质破坏以及骨愈合延迟中发挥重要作用[8],而前期研究主要关注于RANKL/OPG在外周血的情况,以期寻找到特异性的血清标志物来对CA早期诊断。有研究指出糖尿病CA急性期与糖尿病患者和健康对照组相比,外周血单核细胞中RANKL的表达较低[9]。也有报道糖尿病CA患者外周血中RANKL基因表达与糖尿病患者和正常对照患者无差异[10]。这些结果提示糖尿病CA的发生可能与局部的病变有关。实际上,关节软骨细胞和关节滑膜细胞也可以合成和分泌RANKL和OPG[11-12]。RANKL/OPG信号通路也参与调控关节软骨细胞的去分化与凋亡[11]。我们的研究发现,DCA患者软骨细胞产生的RANKL显著高于正常对照组,OPG则显著低于正常对照组[3]。
关节的稳定与正常代谢依靠关节软骨的完整、软骨下骨的支撑和关节内环境的稳定。我们的前期研究发现,糖尿病CA患者中关节软骨与软骨下骨交接处出现大量的破骨细胞聚集,这可能与软骨细胞合成和分泌的RANKL/OPG比例失衡有关[3]。RANKL结合核因子κB受体活化因子(receptor activator for nuclear factor-κ B,RANK)后作用于前体破骨细胞,并诱导其向成熟破骨细胞分化,OPG与RANKL存在竞争关系,OPG可以通过与RANK的结合抑制RANKL与RANK的结合[13]。而且OPG还可以抑制破骨细胞自骨膜释放并削弱破骨细胞的黏附能力,从而抑制破骨细胞的分化、成熟及其生物作用的发挥,是调控破骨细胞功能活动的最后通路[11]。在骨代谢稳定的情况下,OPG与RANKL的分泌和表达保持着动态的平衡以维持成骨和破骨之间的平衡,如果该平衡被打破,RANKL/OPG比率失调,则会造成骨代谢失衡,引起骨质异常增生或者骨质流失。本研究发现随着培养液糖浓度的升高,软骨细胞RANKL和OPG的表达都呈下降趋势,但是OPG的表达下降更为显著,这便使得RANKL/OPG比率上调,导致破骨细胞被大量激活和聚集,打破软骨下骨原有的代谢平衡,导致软骨下骨过度溶解、吸收,进而导致对关节软骨的支撑作用减弱,引起关节软骨损伤与关节脱位。这与临床中观察到的糖尿病CA的病理特征是相符合的[14]。因此,长期的高糖环境可能是启动糖尿病CA的关键因素之一。
尽管葡萄糖在包括软骨细胞在内的所有细胞类型的能量代谢中起作用,但高浓度的葡萄糖对细胞代谢可能具有不利影响,因为过多的细胞内葡萄糖浓度会使糖酵解途径饱和,从而激活参与葡萄糖代谢的其他二级途径,如多元醇、己糖胺,蛋白激酶C或磷酸戊糖途径和产生晚期糖基化终产物,所有这些途径都会诱导氧化应激和炎性因子的产生[15]。Chen等[16]研究发现,高糖可诱导软骨细胞环氧合酶-2蛋白表达和前列腺素E2(prostaglandin E2,PGE2)、白细胞介素(interleukin,IL)-6、基质金属蛋白酶(matrix metalloproteinase,MMP)-13的产生。研究指出,糖尿病大鼠软骨细胞中MMP-8与MMP-9表达降低,Ⅱ型胶原α1和Ⅰ型胶原α1表达下降,而细胞凋亡相关蛋白表达增加[17]。Laiguillon等[18]的研究表明,在体外培养的软骨细胞中,高糖环境通过增加氧化应激和多元醇通路导致IL-1β诱导的炎症反应增加,进而促进软骨损伤。有学者认为可以通过控制血糖来预防糖尿病患者关节软骨的破坏和骨关节炎等疾病的进展[19]。我们的研究发现,从RANKL蛋白与OPG蛋白的相对表达量分析,两者均随着培养液糖浓度的增加而减小,但OPG的表达量减小则更加明显,当培养液糖浓度超过15 mmol/L时,RANKL/OPG的比率出现严重失衡,在20 mmol/L时达到峰值。因此,细胞外周环境中糖浓度超过15 mmol/L可能是诱发RANKL/OPG比率严重失调的临界值。
综上所述,随着细胞外糖浓度的增加,RANKL蛋白和OPG蛋白的表达均会下降,OPG的表达则下降更显著,因此,RANKL/OPG的比率则会升高。另外,在细胞外糖浓度超过15mmol/L时,RANKL/OPG的比率严重失衡,这种变化可能是造成糖尿病患者出现CA的重要因素。然而,细胞外糖浓度与RANKL/OPG表达的直接相关性以及其中的作用机制仍有待进一步研究证实。

