乌鸡肽对糖尿病小鼠糖化血清蛋白含量及免疫器官指数的影响
葛 莹,王欢欢,张 雷,李庆海,黄 沁,章学东
(杭州市农业科学研究院,浙江 杭州 310024)
糖尿病是因胰岛素分泌不足(1型糖尿病)或胰岛素抵抗(2型糖尿病)引起的一种复杂的慢性代谢性疾病[1,2]。据国际糖尿病联盟报告,2019年全球约有4.63亿人患糖尿病,预计到2035年达到5.92亿,已然成为威胁人类健康的一大疾病。常见的抗糖药物有胰岛素类、双胍类、α-葡萄糖苷酶抑制剂类等。其中,阿卡波糖属于α-葡萄糖苷酶抑制剂类降糖药且目前在临床上得到广泛应用[3-5]。但研究发现长期使用会发生不良反应或疗效不佳的情况[6]。许多专家认为除了运动和药物控制,饮食治疗是糖尿病治疗的基础措施[7]。因此,从食品中挖掘更安全、有效的抗糖功能成分具有重要的意义。
乌骨鸡是我国特有的药食两用鸡种,长期以来深受消费者喜爱。据《本草纲目》记载乌骨鸡能够治疗消渴症,即糖尿病[8]。同时,现代医学证实乌骨鸡体内富含多种功能活性成分,包括黑色素、氨基酸、脂肪酸和生物活性肽等。其中,乌骨鸡活性肽(以下简称乌鸡肽)是乌骨鸡肌肉蛋白水解得到的一些特定小分子量氨基酸片段,已被证实具有抗氧化、补气血、降血压、免疫调节等广泛的生理作用[9-11]。目前,乌鸡肽与糖尿病的关联研究较少。本课题组前期研究初步证实乌鸡肽能够改善链脲佐菌素(streptozotocin,STZ)诱导的糖尿病小鼠的体重、空腹血糖、血脂等水平。在此基础上,本试验分析乌鸡肽对糖尿病小鼠的糖化血清蛋白(glycosylated serum protein,GSP)含量及脾、胸腺指数的影响,以期进一步解析乌鸡肽的抗糖作用,为充分开发乌骨鸡功能成分提供理论依据。
1 材料与方法
1.1试验素材 雄性ICR小鼠(5周龄,清洁级)来自浙江省医科院实验动物中心,实验期间确保饲养环境安静清洁,室内温度(20±2)℃、湿度50%~60%、12 h明暗循环以及提供充足的饲料和饮水,造模前需适应性饲养1周。乌鸡肽由杭州市农业科学研究院提供,是由乌骨鸡蛋白经酶解分离制得的分子量小于5000 kDa的多肽。
1.2试剂及仪器 STZ(S0130,Sigma),阿卡波糖(德国拜耳医药保健有限公司),柠檬酸、柠檬酸三钠、氯化钠等分析纯(生工生物工程(上海)股份有限公司),GSP测试盒(南京建成生物工程);电子天平(梅特勒-托利多仪器(上海)有限公司);台式低温高速离心机(Eppendorf,德国);血糖仪和血糖试纸(Roche,美国);Infinite M200 Pro多功能酶标仪(Tecan,瑞士);超纯水机(Millipore,美国)。
1.3造模 将STZ溶于0.1 mol·L-1柠檬酸钠缓冲液以配制10 mg·mL-1注射液。ICR小鼠隔夜禁食后,按照120 mg·kg-1的STZ剂量进行腹腔注射来诱导糖尿病。注射1周后断尾采血,测得空腹血糖值≥11.1 mmol·L-1则为糖尿病小鼠。
1.4试验分组 将造模成功的小鼠随机分为3组,每组10只。分别每天灌喂400 mg·kg-1乌鸡肽(BP组)、30 mg·kg-1阿卡波糖(AC组)和生理盐水(PC组)。另随机选择10只健康小鼠作为正常对照组(NC)并灌喂生理盐水。
1.5试验方法 连续灌喂30 d后称重,然后采用脱颈法处死小鼠,眼眶静脉窦采血,4℃静置24 h,3000 r·min-1、15 min分离出血清,根据GSP测试盒说明书,利用酶标仪检测GSP含量,采集脾、胸腺组织,生理盐水冲洗后擦干、称重,最后计算脾、胸腺指数,公式如下:
脾指数(mg·g-1)=脾重量(mg)/体重(g)
胸腺指数(mg·g-1)=胸腺重量(mg)/体重(g)
1.6数据分析 采用平均值±标准差表示数值,使用SPSS 12.0软件进行统计分析,组间差异显著性采用Tukey检验,以P<0.05具有统计学意义。
2 结果与分析
2.1乌鸡肽对血清GSP含量的影响 GSP能有效地反映过去2~3周内平均血糖水平,不受临时血糖浓度波动干扰,是观察血糖控制情况的重要指标之一。由表1可知,相比于NC组,其余3组的GSP含量显著较高(P<0.05),即灌胃一段时间后的糖尿病小鼠仍持续高血糖。但相比于PC组,BP组和AC组的GSP含量显著较低(P<0.05)且这两组间无显著差异,说明灌喂乌鸡肽和阿卡波糖后的糖尿病小鼠血糖均显著下降,并且两者效果相似。总之,乌鸡肽和阿卡波糖能在一定程度上调节降低糖尿病小鼠血糖。
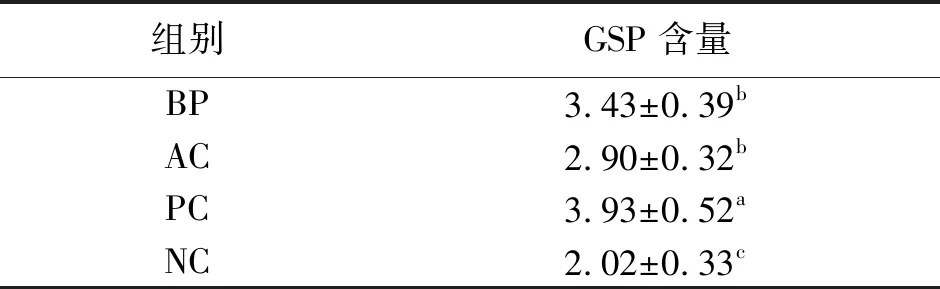
表1 乌鸡肽对糖尿病小鼠血清GSP含量的影响 单位:mmol·L-1
2.2乌鸡肽对免疫器官的影响 脾和胸腺是机体重要的免疫器官,并且脾指数和胸腺指数可作为评估免疫功能的基础指标。由图1可知,与NC组相比,BP组和AC组的脾指数无显著差异,而PC组显著较低(P<0.05);PC组的脾指数低于BP、AC组,且与后者具有显著差异(P<0.05)。胸腺指数由高到低为NC、BP、AC、PC组,但组间无显著差异。以上表明,灌喂乌鸡肽有利于提高糖尿病小鼠脾指数,具有一定的免疫调节作用。
3 讨论
目前,实验室常将STZ作为糖尿病模型诱导试剂。它是一种氨基葡萄糖-亚硝基脲化合物,进入体内被葡萄糖转运蛋白转运至胰腺组织,特异性破坏β细胞使胰岛素分泌下降,造成机体无法吸收葡萄糖、血糖升高[12]。研究者们通过一次腹腔注射大剂量STZ诱导1型糖尿病小鼠,具有高血糖和“三多一少”的症状[13,14]。同样,本试验经腹腔一次注射120 mg·kg-1剂量的STZ,1周后检测发现小鼠空腹血糖高于11.1 mmol·L-1,说明糖尿病小鼠构建成功。
GSP是由血液中的葡萄糖与白蛋白和其他蛋白分子N末端发生非酶促糖基化反应的产物,其中糖化白蛋白浓度约占90%[15]。它不受血液系统疾病的影响且半衰期较短(17~19天),从而反映测定前2~3周的短期血糖状态[16-17]。相比于空腹血糖测定的繁琐(需要禁食)和不稳定性,GSP能更快速、准确地反映血糖控制情况或者监测糖尿病治疗变化。Chen等[13]发现STZ型糖尿病小鼠GSP水平显著高于健康小鼠(P<0.05)。本试验也证实了健康小鼠GSP含量[(2.02±0.33)mmol·L-1)]显著低于阳性对照小鼠[(3.93±0.52)mmol·L-1](P<0.05)。灌喂乌鸡肽、阿卡波糖30 d后的小鼠组血糖均显著低于阳性对照组(P<0.05),说明乌鸡肽同阿卡波糖一样在一定程度上降低糖尿病小鼠血糖。但也观察到乌鸡肽、阿卡波糖组显著高于正常对照组(P<0.05),即血糖未恢复到健康小鼠水平,这可能与给药浓度及乌鸡肽关键功能肽段未完全分离提纯有关。
长期高血糖使机体对胰岛多种抗原成分失去耐受,主要组织相容性复合物Ⅱ类分子与其处理的β细胞抗原共同激活细胞毒性因子,产生氧化应激,从而导致免疫力下降引发严重的心血管、肝肾损伤等并发症[18]。脾和胸腺作为动物重要的免疫器官,其中脾脏是体内最大的免疫器官,具有T、B淋巴细胞以及巨噬细胞,胸腺能诱导T淋巴细胞分化、成熟,辅助T细胞产生抗体。当机体发生超敏反应,促进淋巴细胞增殖、免疫器官质量增加。因此,脾指数和胸腺指数是衡量免疫功能的重要指标[19,20]。黄桂红等[21]发现STZ诱导的糖尿病小鼠脾、胸腺指数显著低于健康小鼠(P<0.05)。本研究也发现阳性对照组小鼠的脾、胸腺指数低于其他组。已有研究表明乌鸡肽可以通过促进淋巴细胞增殖和巨噬细胞活力来增强免疫调节[22]。朱小语等[23]认为乌鸡肽可改善环磷酰胺致免疫低下小鼠的免疫功能。本试验也观察到灌胃乌鸡肽及阿卡波糖的糖尿病小鼠脾指数与健康小鼠无显著差异,说明它对糖尿病小鼠的免疫器官具有调节作用,从而减少并发症的产生。
总之,本研究证实了乌鸡肽对STZ诱导的糖尿病小鼠具有一定降低血糖、增强免疫功能的作用,后期课题组将进一步研究乌鸡肽降糖的关键功能肽段及其作用机制。
——乌鸡
——乌骨鸡

