慢性肾小球肾炎患者血浆suPAR、Cys-C 表达与肾功能及预后的相关性研究
吴克钗 薛玉蝶 吴小丽
慢性肾小球肾炎(CGN)是由各种病原微生物感染,可引起双侧肾小球弥漫性或局部性炎性改变的一种疾病[1]。CGN 具有发病隐匿,病程迁延,伴有不同程度的蛋白尿、血尿和进行性肾功能减退等特点,后期一般预后较差[2]。因此探究CGN 的发病因素及与肾功能的关系,对疾病预后有重要意义。可溶性尿激酶型纤溶酶原激活物受体(suPAR)可促进纤溶酶原激活、细胞黏附、趋化性和免疫细胞激活,已成为潜在的标志物[3-4]。胱抑素C(Cys-C)是大多数有核细胞分泌的内源性半胱氨酸蛋白酶抑制剂[5],具有预测急性肾损伤(AKI)的潜在价值[6]。本研究通过检测CGN患者血浆suPAR、Cys-C 表达水平,分析二者与肾功能指标及预后的相关性,以期为临床判断CGN 预后提供参考。
1 资料与方法
1.1 一般资料 选取2016 年11 月—2018 年12 月于温州医科大学附属苍南医院肾内科收治的CGN患者100 例作为研究组,另选取同期在本院进行体检的健康人90 名作为对照组。本研究获得医院伦理委员会批准后实施,批准编号:LS-2016-0121;所有研究对象及家属签署知情同意书。
1.2 纳入及排除标准 纳入标准:(1)所有患者均符合中华中医药学会肾病分会制定的《慢性肾小球肾炎的诊断、辨证分型及疗效评定(试行方案)》中对CGN 的诊断标准[7];(2)患者病历资料完整,有完整随访记录;(3)同意遵守医嘱。排除标准:(1)患有某些会损害肾脏的疾病(高血压、糖尿病等)、尿路结石、急慢性前列腺疾病;(2)严重肝肾功能不全或衰竭者;(3)合并自身免疫性疾病的患者。
1.3 主要试剂与仪器 尿素氮(BUN)、血清肌酐(SCr)、尿酸(UA)、二氧化碳结合力(CO2CP)酶联免疫吸附(ELISA)试剂盒(上海江莱生物科技有限公司,批号分别为JL19704、1530422946、1529949594、TC0277);血浆suPAR ELISA 试剂盒(青岛捷世康生物科技有限公司,批号SJH-012988);血浆Cys-C ELISA 试剂盒(上海雅吉生物科技有限公司,批号YS07378B);医用离心机(北京医疗器械有限公司,型号B600);血氧饱和仪(美国通用公司,型号6051-0000-159);全自动生化分析仪(美国Beckman Coulter 公司,型号AU5800)。
1.4 方 法
1.4.1 临床资料收集 收集受试者收缩压、舒张压、体质量指数(BMI)等一般资料。全自动生化分析仪检测受试者血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、BUN、SCr、UA、CO2CP 水平。
1.4.2 标本采集 所有患者均于入院后、体检者于体检当日分别抽取肘静脉血5mL,置于含枸橼酸钠抗凝剂的抽血管内上下颠倒混匀,均静置30min,室温条件下3000r/min,离心15min,吸取上清液分别装入EP 管中,置于-80℃冰箱中保存备用。
1.4.3 血浆suPAR、Cys-C 水平检测 从-80℃冰箱中取出冻存血浆样本,解冻,采用ELISA 法测定受试者血浆suPAR、Cys-C 水平,样品及标准品均设双孔检验,用酶标仪检测吸光度值,并绘制标准曲线,计算suPAR、Cys-C 的浓度,所有操作均严格按照试剂盒说明书进行。
1.4.4 随 访 对所有CGN 患者进行2 年随访,随访内容为患者的疾病进展情况,方式为电话或住院随访,每6 个月随访1 次,随访截止时间为2020 年12 月31 日。根据预后情况分为缓解组(89 例肾功能明显减退)和慢性肾功能衰竭组[8](11 例肾功能明显减退)。
1.4 统计学方法 应用SPSS 20.0 统计软件对数据进行分析,计量资料以均数±标准差()表示,两组间比较采用独立样本t 检验;计数资料用例表示,采用χ2检验。Pearson 法分析血浆suPAR、Cys-C 水平与肾功能指标的相关性;通过COX 比例风险模型分析影响CGN 患者预后的因素,P<0.05 认为差异有统计学意义。
2 结果
2.1 两组受试对象一般资料及临床病历资料比较两组间性别、年龄、收缩压、舒张压、BMI、TC、TG、LDL-C、HDL-C、CO2CP 差异无统计学意义(P>0.05)。与对照组比较,研究组BUN、SCr、UA 水平均升高(P<0.05)。见表1。
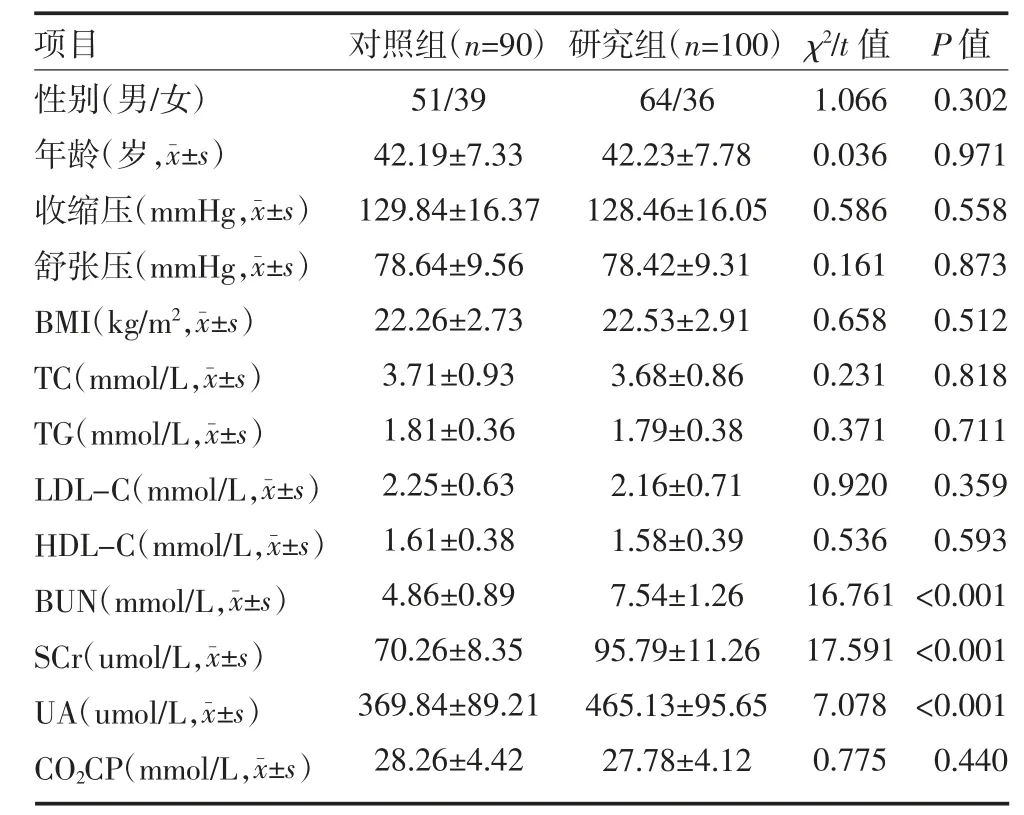
表1 两组受试对象一般资料及临床病历资料比较
2.2 两组受试对象血浆suPAR、Cys-C 水平比较与对照组比较,研究组血浆中suPAR、Cys-C 水平均升高(P<0.05)。见表2。
表2 两组受试对象血浆suPAR、Cys-C 水平比较()
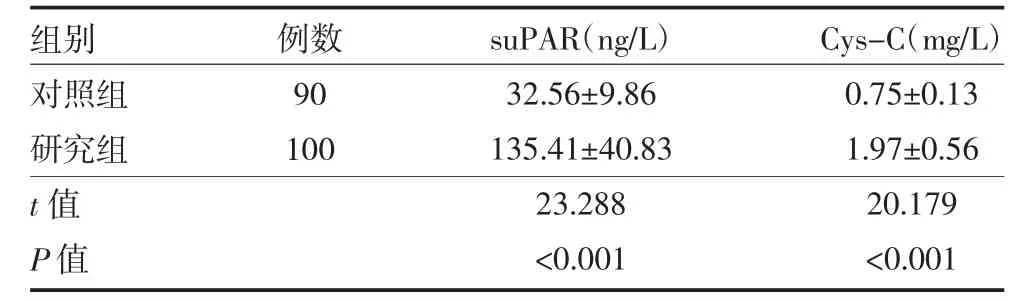
表2 两组受试对象血浆suPAR、Cys-C 水平比较()
注:对照组为健康人;观察组为CGN 患者;CGN 为慢性肾小球肾炎;suPAR 为可溶性尿激酶型纤溶酶原激活物受体;Cys-C 为胱抑素C
2.3 缓解组和慢性肾功能衰竭组患者血浆suPAR、Cys-C 水平比较 与缓解组比较,慢性肾功能衰竭组血浆suPAR、Cys-C 水平均升高(P<0.05)。见表3。
表3 缓解组和慢性肾功能衰竭组CGN 患者血浆suPAR、Cys-C 水平比较()
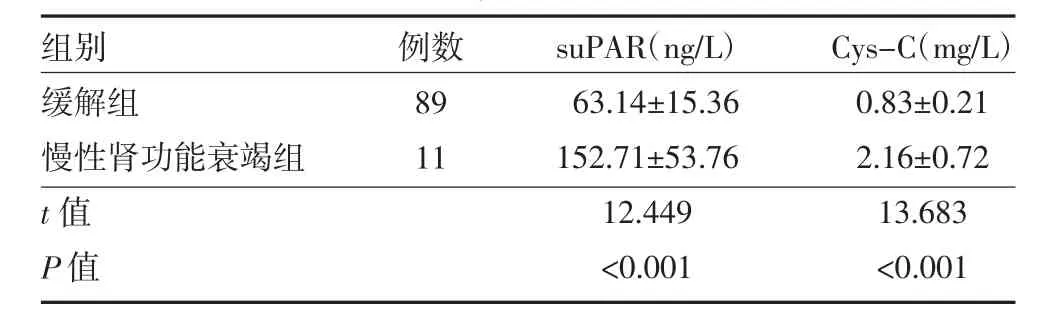
表3 缓解组和慢性肾功能衰竭组CGN 患者血浆suPAR、Cys-C 水平比较()
注:缓解组为病情缓解或无进展患者;慢性肾功能衰竭组为慢性肾功能衰竭患者;CGN 为慢性肾小球肾炎;suPAR 为可溶性尿激酶型纤溶酶原激活物受体;Cys-C 为胱抑素C
2.4 CGN 患者血浆suPAR、Cys-C 水平与肾功能指标的相关性分析 Pearson 法分析相关性显示,CGN患者血浆suPAR、Cys-C 水平与BUN、SCr、UA 均呈正相关(P<0.05)。见表4。
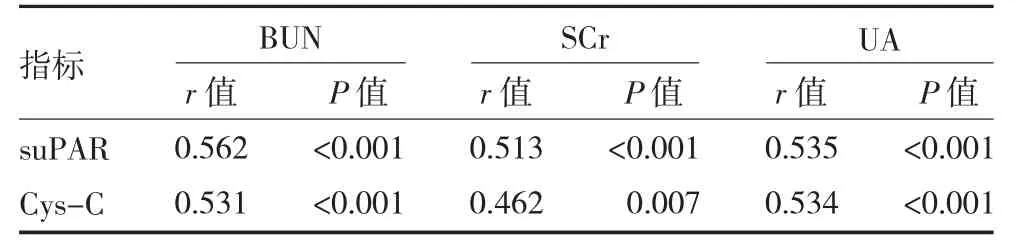
表4 CGN 患者血浆suPAR、Cys-C 水平与肾功能指标的相关性分析
2.5 影响CGN 患者预后的COX 危险因素分析 单因素COX 分析显示,BUN、SCr、UA、suPAR、Cys-C 均是影响CGN 患者不良预后的危险因素;多因素COX分析显示,suPAR、Cys-C 水平偏高均是CGN 患者不良预后的危险因素(HR=2.598、3.342,P<0.05)。见表5。
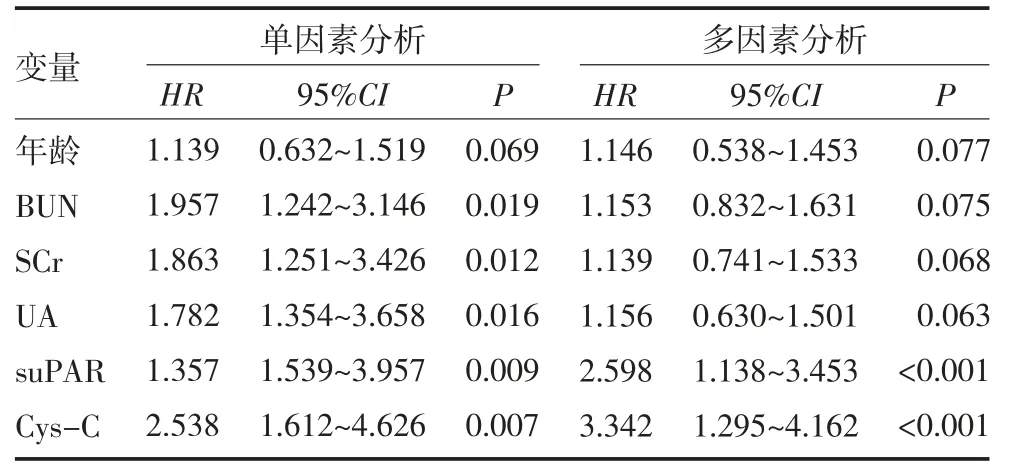
表5 影响CGN 患者预后的COX 危险因素分析
3 讨论
suPAR 是糖基磷脂酰肌醇锚定的三结构域膜蛋白的循环形式,由膜结合的尿激酶型纤溶酶原激活剂受体裂解产生,在内皮细胞、巨噬细胞、单核细胞、嗜中性粒细胞、淋巴细胞和成纤维细胞表达,存在于各种体液中,包括血液、尿液和脑脊髓液[9-10]。suPAR的浓度与免疫系统活性关系密切,当人体处于炎症或其他疾病状态时,免疫系统被激活并且suPAR 水平被感染和促炎性细胞因子上调,因此suPAR 水平可能指导炎症相关疾病的诊断和预后[11]。研究发现,监测suPAR 浓度可用于慢性肾脏病患者的早期诊断和预后,而高suPAR 浓度会增加死亡率、心血管事件和终末期肾脏疾病的风险[12]。
Cys-C 由所有核细胞稳定产生并分泌,其生成不受性别、食物中蛋白质摄入量、肌肉量等影响[13]。Cys-C 主要通过肾小球滤过从血流中去除,且几乎完全被远端肾小管重吸收而无肾小管分泌,与SCr不同,Cys-C 在评估慢性肾病肾功能损伤方面的特异性和准确度优于SCr[14]。本研究发现,观察组血浆suPAR、Cys-C 水平高于对照组;与缓解组相比,慢性肾功能衰竭组血浆suPAR、Cys-C 水平升高。提示suPAR、Cys-C 水平可能与CGN 及其预后情况有关。Pearson 法分析相关性显示,CGN 患者血浆suPAR、Cys-C 水平与BUN、SCr、UA 均呈正相关。提示二者与CGN 患者肾功能关系密切。研究显示,suPAR 水平的升高与慢性肾脏疾病的发生和肾小球滤过率的加速下降独立相关[15],而Cys-C 是肾小球滤过率的有效诊断标志物,因此联合suPAR、Cys-C 水平可能反映CGN 的相关进展。本研究COX 分析显示,su-PAR、Cys-C 水平偏高均是CGN 患者不良预后的危险因素。提示suPAR、Cys-C 可能参与CGN 患者疾病预后的进展,有一定预测作用,有助于临床判断CGN的预后情况。

