一种用于芽孢杆菌代谢物细胞毒性的快速检测方法
黄英, 彭晴, 王荃, 徐小轻, 张宇微, 马蓝, 石波, 乔宇*
(1.中国农业科学院饲料研究所,北京 100081;2.全国畜牧总站,北京 100125)
芽孢杆菌(Bacillus)属革兰氏阳性菌,可形成芽孢[1],能分泌多种酶类,如蛋白酶、纤维素酶、果胶酶;还能合成多种生物活性物质,如有机酸、维生素、氨基酸等[2]。益生芽孢杆菌能够提高营养物质的消化率,维持肠道菌群平衡,增强机体免疫力和抗病力,在功能食品、畜禽养殖、植物病害防治、工业酶制剂生产等方面取得了很好的应用效果[3]。
蜡样芽孢杆菌能产生溶血素、磷脂酶和其他肠毒素[4-5],引起人类和动物的中毒反应,主要表现为呕吐和腹泻。呕吐毒素(cereulide)[6]是由非核糖体肽合酶ces基因簇编码的热稳定性环状多肽。肠毒素主要包括溶血素Hbl、非溶血性肠毒素Nhe、肠毒素FM(entFM)、细胞毒素K(CytK)和肠毒素 T(BceT)[7]。Hbl由 L1、L2和 B 共 3 个亚基构成,分别由hblA、hblB和hblD基因编码[8]。当3个亚基都存在时毒性最强,对宿主产生溶血、细胞毒性和皮肤坏死毒性。Nhe由nheA、nheB和nheC 3个亚基构成[9],而entFM、CytK和BceT是单亚基蛋白[10]。近年来,具有益生功效的芽孢杆菌,如枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)、短小芽孢杆菌(Bacillus pumilus)等陆续被报道也能分泌与蜡样芽孢杆菌相同的毒素[5]。Parvathi等[11]从土壤中分离出一株短小芽孢杆菌,携带了与蜡样芽孢杆菌相同的呕吐毒素合成基因,且能够分泌呕吐毒素。Rowan等[12]用蜡样芽孢杆菌溶血素(Hbl的L2亚基)进行反向被动乳胶凝集试验,结果表明,凝结芽胞杆菌NB11和多粘芽孢杆菌NB6能分泌Hbl毒素。除此之外,一些枯草芽孢杆菌、地衣芽孢杆菌[13-16]和短小芽孢杆菌[13,17-20]还能产生多种类型的脂肽类毒素,如表面活性素(surfactin)、伊枯草菌素(iturin)和芬芥素(fengycin)等,部分脂肽类毒素具有溶血性和细胞毒性。
安全无毒是益生类芽孢杆菌必需具备的首要条件,在使用前必需对其毒性和安全性进行评价[13,21]。采用传统微生物培养和生化法测定毒素存在耗时长、灵敏度低等缺点[22];而利用PCR和全基因组测序分析检测毒素基因的方法缺乏必要的质量控制和结果验证,存在一定的局限性[22-23]。细胞毒性测定法通过体外检测毒素对相关哺乳动物生长代谢产生的影响,解决了上述方法的缺陷[22,24]。Beattie等[25]用体外培养的CHO细胞(中国仓鼠卵巢细胞),通过细胞染色和代谢活性的变化评价芽孢杆菌的细胞毒性,该方法耗时较长,需要24~72 h才能完成。Gray等[22]用Ped-2E9细胞(小鼠杂交瘤淋巴细胞)检测芽孢杆菌的细胞毒性,但Ped-2E9细胞只能检测出蜡样芽孢杆菌的细胞毒性,对枯草芽胞杆菌不敏感。Lee等[26]利用HEp-2细胞(人喉表皮样癌细胞)的空泡化测定蜡样芽孢杆菌的呕吐毒素。欧洲食品安全局(European Food Safety Authority,EFSA)的官方文件中使用非洲绿猴肾细胞(Vero细胞)评估饲用芽孢杆菌的产毒潜力[28]。研究报道,流式细胞仪法、同位素释放法、台盼蓝染色法[29]、MTT比色法[30]和CCK-8[31]法均能测定细胞毒性强弱。其中,MTT比色法和CCK-8法以其快速简单、不需要特殊检测仪器、无放射性同位素且适合大批量检测等特点被广泛应用。综上所述,在芽孢杆菌毒性检测中,不同株系的细胞和细胞活性测定方法在操作性、敏感性、适用性和准确性等方面存在差异,制约了细胞毒性检测方法的应用。因此,本研究拟通过筛选试验用细胞系,并进一步对细胞毒性的检测方法进行优化,建立一种简单、快速、可靠和广泛适用的芽孢杆菌细胞毒性检测方法,为芽孢杆菌的安全使用提供科学指导。
1 材料与方法
1.1 试验材料
芽孢杆菌:蜡样芽孢杆菌CICC 21261(标准毒株购自中国工业微生物菌种保藏中心)及81株芽孢杆菌(实验室分离保存),包括3株蜡样芽胞杆菌、44株枯草芽孢杆菌、15株解淀粉芽孢杆菌、9株地衣芽孢杆菌、6株贝莱斯芽孢杆菌、2株短小芽孢杆菌、1株人参芽孢杆菌、1株副芽孢杆菌。
细胞:非洲绿猴肾细胞(Vero细胞)购自武汉普诺赛生命科技有限公司,人喉表皮样癌细胞(HEp-2细胞)购自武汉普诺赛生命科技有限公司。
1.2 培养条件
芽胞杆菌:取甘油保存的芽孢杆菌于LB固体平板划线,37℃培养过夜后,挑取单菌落接种于LB液体培养基中,于37 ℃、180 r·min-1条件下培养16~18 h。将活化的菌液以体积比为2%的接种量转接于脑心浸出液培养基(BHI)中,32℃、180 r·min-1条件下培养 6~18 h[32]。
细胞:细胞接种于含DMEM完全培养基(含8%胎牛血清,1%双抗)的T-25瓶中,在37℃、5% CO2环境下培养,以胰酶消化传代。利用DMEM完全培养基调整细胞液密度为5×104~1×105个·mL−1[33]进行后续实验。
1.3 细胞毒性检测方法的建立
1.3.1 细胞活性检测方法的确定 ①MTT比色法。取Vero细胞液100µL接种于96孔板,于37℃、5% CO2下孵育24 h后更换为100µL DMEM完全培养基,同时实验组每孔加入50µL BHI培养基,对照组每孔加入50µL DMEM培养基(含1%双抗),以不接细胞的孔作为空白对照,每组做8个重复。于37℃、5% CO2下继续孵育2 h后,移去孔板中的液体,加入100µL质量浓度为1 mg·mL−1的MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,北京博奥拓达科技有限公司],37℃反应4 h后移去MTT溶液,每孔加入150µL的DMSO[34],充分振荡混匀后,在490 nm下测定光吸收值,并计算BHI培养基对细胞的抑制率[35]。
②CCK-8法。取Vero细胞液100µL接种于96孔板,于37℃、5% CO2下孵育24 h后更换100µL DMEM完全培养基,同时实验组每孔加入50µL BHI培养基,对照组每孔加入50µL DMEM培养基(含1%双抗),以不接细胞的孔作为空白对照,每组做8个重复。于37℃、5% CO2条件下继续孵育2 h后,移去孔板中的液体,加入100µL DMEM培养基以及10µL CCK溶液(Cell Counting Kit-8,biosharp,北京兰杰柯科技有限公司),37℃反应2 h,在450 nm下测定光吸收值,并计算芽孢杆菌培养基对细胞的抑制率。
1.3.2 细胞的选择 培养Vero细胞和HEp-2细胞,分别取细胞液100µL接种于96孔板,于37℃、5% CO2下孵育24 h后更换100µL DMEM完全培养基,同时实验组每孔加入50µL BHI培养基,对照组每孔加入50µL DMEM培养基(含1%双抗),以不接细胞的孔作为空白对照,每组做8个重复。37℃、5% CO2下继续孵育2 h后,采用MTT比色法测定BHI培养基对两种细胞的抑制率。
1.4 细胞毒性检测条件的优化
1.4.1 芽胞杆菌粗提物的制备 分别浓缩或稀释蜡样芽孢杆菌CICC 21261、蜡样芽孢杆菌1-20、解淀 粉 芽 孢 杆 菌 1-16 培 养 液 至 108CFU·mL−1,10 000 r·min−1离心10 min,上清液用0.22 µm的微孔滤膜过滤,制成芽孢杆菌粗提物,4℃保存不超过48 h。
1.4.2 反应体系的优化 将100µL Vero细胞液接入96孔板,于37℃、5% CO2下孵育24 h后更换100µL DMEM完全培养基,同时实验组分别加入粗提物25、50、75和100 µL,对照组加入与粗提物等量的BHI培养基,以不接细胞的孔作为空白对照,每组做8个重复,37℃、5% CO2下孵育2 h后,测定粗提物的细胞抑制率,比较不同体积的粗提物对细胞抑制率的影响。
1.4.3 反应时间的优化 将100µL Vero细胞液接入96孔板,于37℃、5% CO2下孵育24 h后更换100µL DMEM完全培养基,同时实验组加入粗提物50µL,对照组加入与粗提物等量的BHI培养基,以不接细胞的孔作为空白对照,各组于37℃、5% CO2下分别孵育1、2、4、6和24 h后,计算并比较不同孵育时间下的粗提物的细胞抑制率。
1.5 细胞抑制率的计算及结果判定
测定试验组光吸收值、对照组光吸收值和空白组光吸收值,按照下式计算细胞抑制率。

当芽孢杆菌的培养液对细胞抑制率<20%时,判定该菌株无细胞毒性;当芽孢杆菌的培养液对细胞抑制率≥20%时,判定该株芽孢杆菌具有细胞毒性[28,35]。
1.6 芽孢杆菌分离菌株毒性检测
利用建立的细胞毒性试验方法对实验室分离的81株芽孢杆菌进行细胞毒性检测。
1.7 芽胞杆菌分泌毒素的测定
1.7.1 毒素编码基因检测 提取芽孢杆菌基因组DNA,参考Özdemir等[36]的方法PCR扩增entFM、ces、cytk、hblA、hblC、hblD、nheA、nheB和nheC9种毒素编码基因,引物序列[36-39]详见表1。以1%的琼脂糖凝胶电泳检测PCR产物。
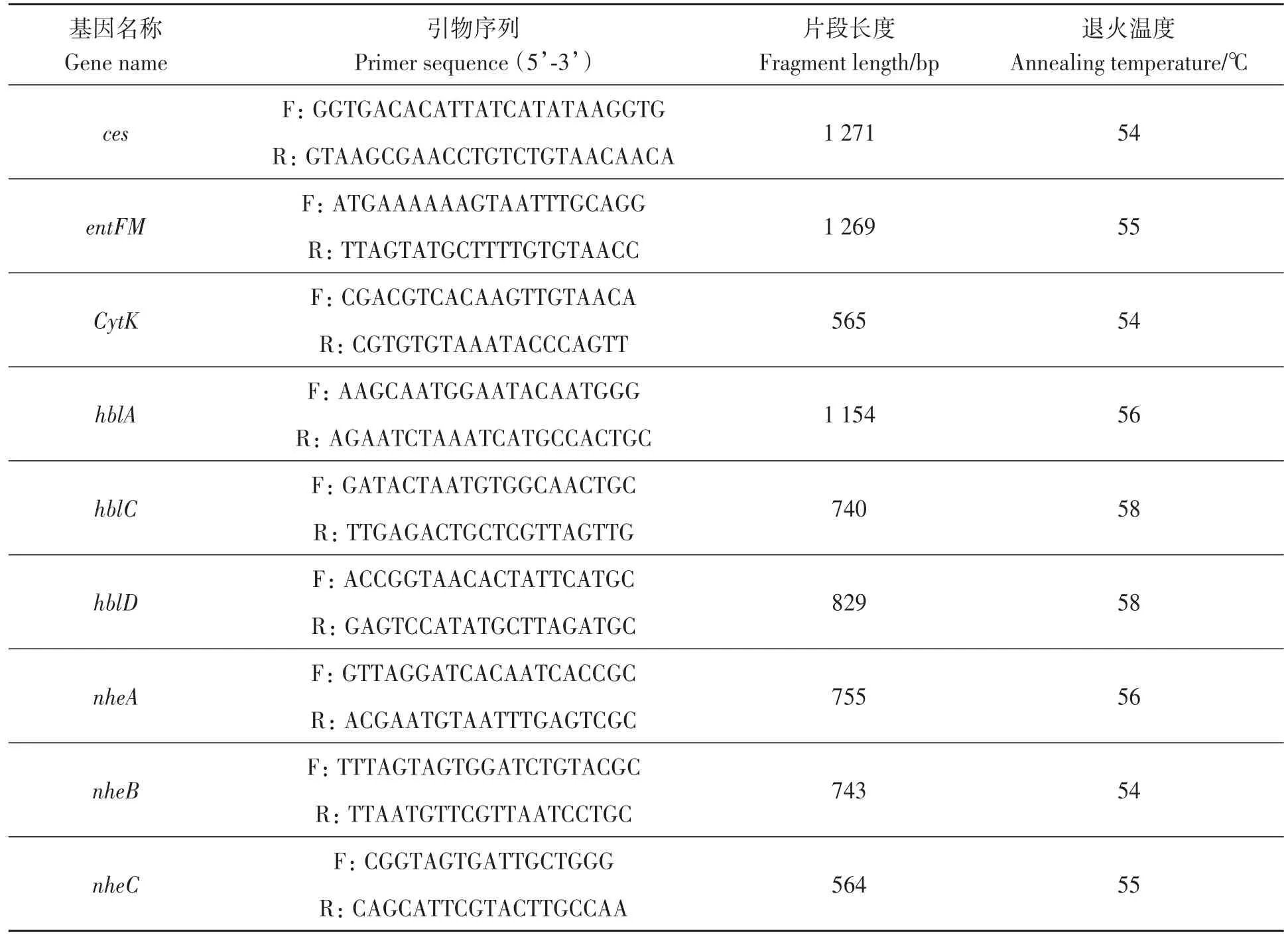
表1 毒素编码基因的PCR引物Table1 Primer of virulence genes for PCR
1.7.2 芽孢杆菌培养上清液的耐热性测试 芽胞杆菌产生的呕吐毒素和脂肽类毒素具有较高的热稳定性,而肠毒素Hbl、Nhe和Cytk等具有热不稳定性。为了分析芽胞杆菌分泌毒素的类型,芽孢杆菌培养物上清液在58℃下处理40 min[22]后,按建立的试验方法对其进行细胞毒性检测。
1.7.3 溶血性测定 挑取LB平板上活化的芽孢杆菌单菌落划线于含8%绵羊血(北京陆桥技术股份有限公司)的哥伦比亚血琼脂(北京索莱宝科技有限公司)平板上,于37℃培养14~18 h,观察菌落周围的形态,判断溶血性的类型,每株菌3个重复。若菌落周围形成了界限分明、完全透明的溶血环,具有溶血性,则溶血类型为β-溶血;若菌落周围的培养基没有变化,不具有溶血性,则为γ-溶血[40]。
1.7.4 肠毒素的特异性抗体检测 利用逆向被动乳胶凝集反应(CRET-RPLA,日本生研株式会社)检测芽孢杆菌肠毒素,操作步骤按照试剂盒说明书进行。
2 结果与分析
2.1 用于芽胞杆菌代谢物细胞毒性检测方法的建立
2.1.1 不同细胞活性检测方法对Vero细胞抑制率的影响 对比MTT比色法和CCK-8法测定BHI培养基对Vero细胞抑制率,结果(图1)表明,MTT比色法测定BHI培养基的细胞抑制率为2.46%,按照芽孢杆菌细胞毒性的判定标准,该BHI培养基的细胞抑制率较低,不具有细胞毒性;而使用CCK-8法测定Vero细胞抑制率时,当培养基与细胞反应2 h后,实验组的光吸收值高于对照组,细胞活性没有被抑制反而被促进,增长率达92%。根据CCK-8法的原理推断,可能BHI培养基中某些组分具有还原特性,使CCK-8法的显色反应被干扰,导致本底误差过大而使实验结果没有参考意义。因此,CCK-8法测定细胞活性不适用于本试验。MTT比色法培养基本底水平低,结果较稳定,适合本试验中细胞活性的测定。
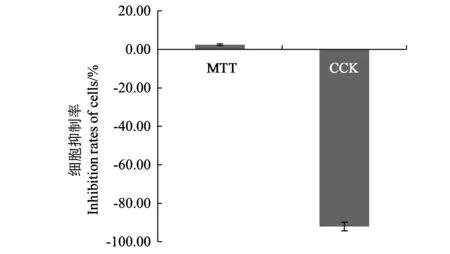
图1 BHI培养基的细胞抑制率Fig.1 Inhibition rates of Bacillus culture medium on Vero cells
2.1.2 BHI培养基对不同细胞活性的影响 Vero细胞和HEp-2细胞分别与BHI培养基反应后测定细胞抑制率,结果(图2)表明,当BHI培养基与Vero细胞反应2 h后,细胞抑制率为2.46%;而BHI培养基与HEp-2细胞反应2 h后,细胞抑制率为29.94%。与Vero细胞相比,本试验选用的BHI培养基对HEp-2细胞的抑制率达到20%以上,如此高的本底水平会影响芽孢杆菌培养物细胞毒性的判定,因此,选用Vero细胞作为试验细胞。
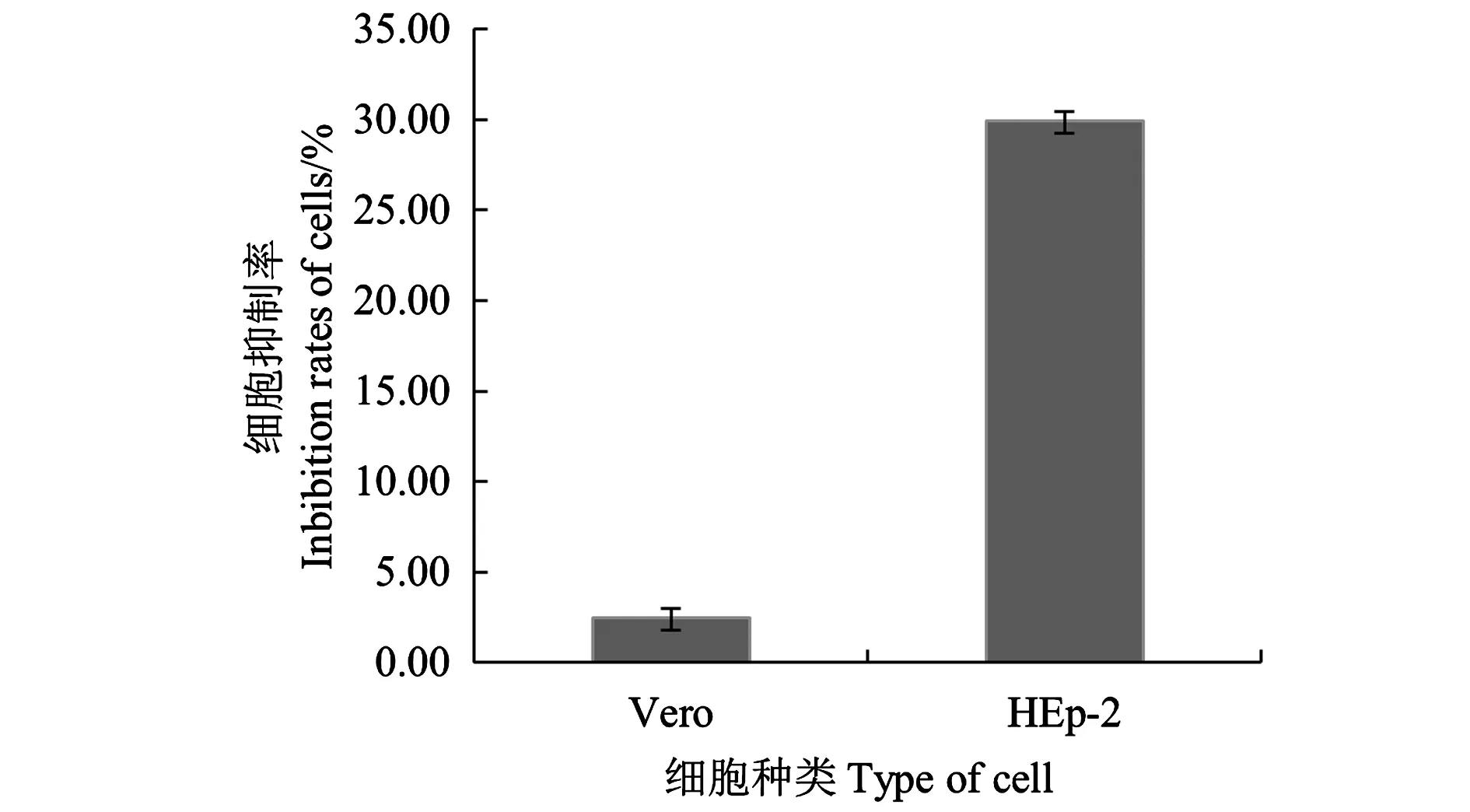
图2 BHI培养基对Vero细胞和HEp-2细胞的抑制率Fig.2 Inhibition rates of Bacillus culture medium on Vero cell and HEp-2 cell
2.2 用于芽胞杆菌代谢物细胞毒性检测条件的优化
2.2.1 不同反应体系对细胞抑制率的影响 不同体积粗提物对细胞抑制率的影响如表2所示,蜡样芽孢杆菌CICC 21261具有强毒性,在加入粗提物体积为50µL时,细胞抑制率最高;蜡样芽孢杆菌1-20和解淀粉芽孢杆菌1-16在加入粗提物体积为50µL时,细胞抑制率最高,分别为94.26%和52.64%。因此,将与细胞反应的芽孢杆菌粗提物体积确定为50µL。
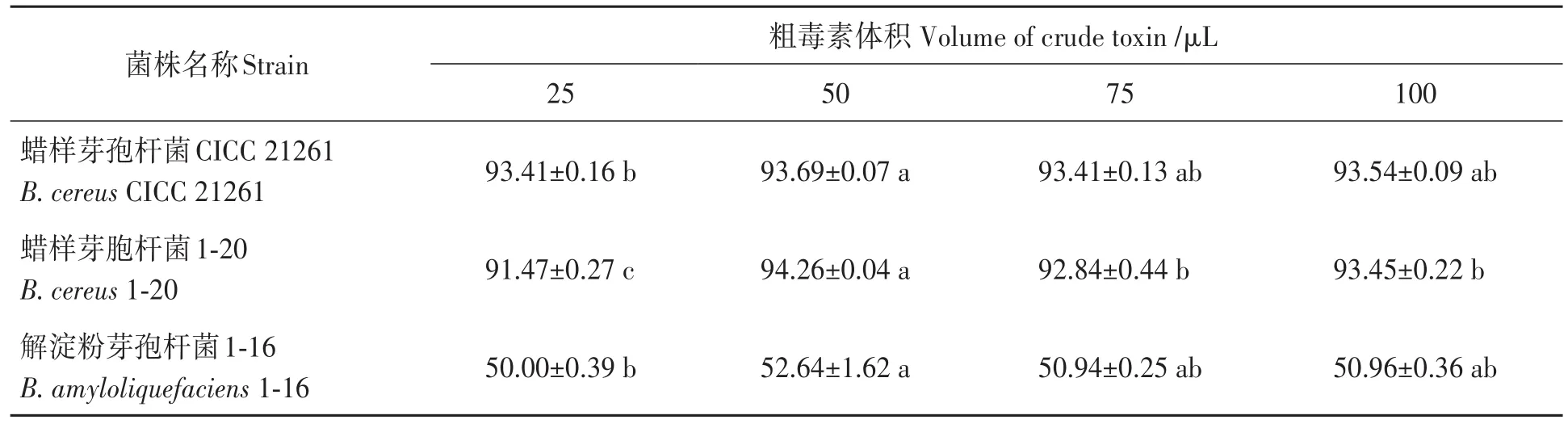
表2 不同粗提物体积的细胞抑制率Table 2 Inhibition rates of cells by different volumes of Bacillus crude extract (%)
2.2.2 不同反应时间对细胞抑制率的影响 芽孢杆菌粗提物和细胞反应不同时间对细胞抑制率的影响结果如图3所示,蜡样芽孢杆菌CICC 21261粗提物与细胞反应1 h,细胞抑制率达94.26%,细胞抑制率曲线到达平台期;蜡样芽孢杆菌1-20粗提物与细胞反应2 h,细胞抑制率达94.26%,细胞抑制率曲线到达平台期;解淀粉芽孢杆菌1-16的细胞抑制率虽然随粗提物和细胞反应时间的延长呈上升趋势,但反应1~4 h的细胞抑制率差异不显著。因此,综合3株菌的试验结果,将待测芽孢杆菌粗提物与Vero细胞反应时间确定为2 h。
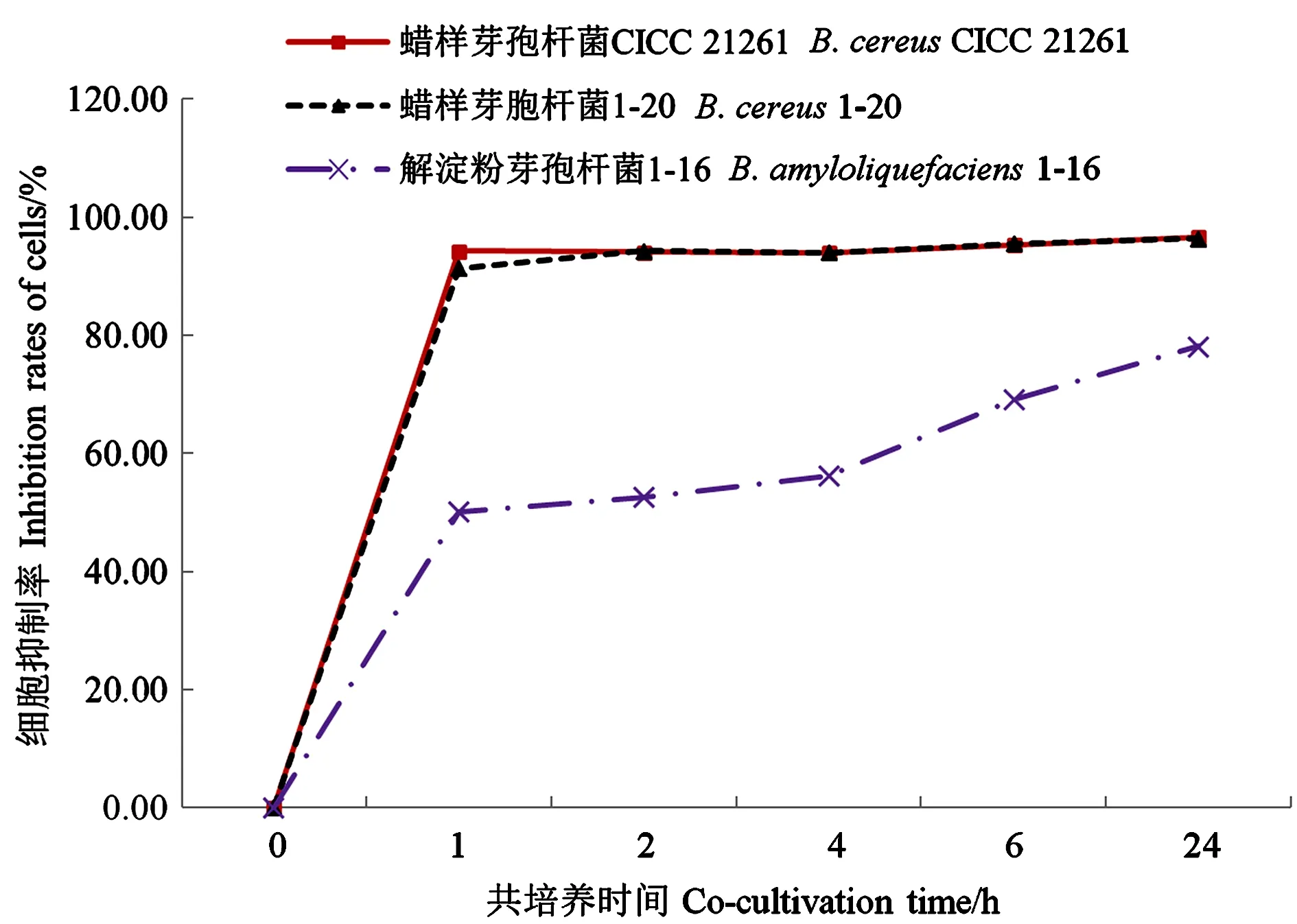
图3 不同反应时间下的细胞抑制率Fig.3 Inhibition rate of cells at different co-incubation times
2.3 不同来源的芽胞杆菌细胞毒性检测结果
应用建立的细胞毒性试验方法对81株芽孢杆菌的细胞毒性进行检测,结果(表3)表明,65株芽孢杆菌的Vero细胞抑制率小于20%,无细胞毒性作用,包括41株枯草芽孢杆菌、9株地衣芽孢杆菌、9株解淀粉芽孢杆菌、2株短小芽孢杆菌、1株人参芽孢杆菌、1株副芽孢杆菌和2株贝莱斯芽孢杆菌;16株芽孢杆菌的Vero细胞抑制率大于20%,显示出细胞毒性作用,包括3株蜡样芽孢杆菌、3株枯草芽孢杆菌、6株解淀粉芽孢杆菌和4株贝莱斯芽孢杆菌。

表3 芽孢杆菌细胞毒性检测及毒素分析Table 3 Cytotoxicity tests and toxin analysis of Bacillus
2.4 产毒芽胞杆菌的毒素分析
2.4.1 毒素编码基因检测结果 对16株具有细胞毒性的芽孢杆菌携带的毒素编码基因进行检测,结果(表3)表明,蜡样芽胞杆菌1-19携带entFM、hblA、hblC、hblD、nheA、nheB、nheC7个毒素编码基因;蜡样芽孢杆菌1-13携带entFM、Cytk、hblA、hblC、hblD、nheA、nheB、nheC8个毒素编码基因;蜡样芽胞杆菌1-20携带entFM、Cytk、hblA、hblC、hblD、nheB、nheC7个毒素编码基因;解淀粉芽孢杆菌3-29、3-33、1-18、2-15、1-16和枯草芽孢杆菌2-17、2-13、2-14及贝莱斯芽孢杆菌3-31仅携带hblD毒素编码基因;贝莱斯芽孢杆菌3-34、3-32、2-16及解淀粉芽孢杆菌1-17未检测到上述毒素编码基因。
2.4.2 芽孢杆菌分泌毒素的耐热性 对具有细胞毒性的16株芽孢杆菌培养物的上清液进行了加热失活处理,然后检测细胞毒性,结果(表3)表明,枯草芽孢杆菌2-14、解淀粉芽孢杆菌1-16和1-18及贝莱斯芽孢杆菌2-16粗提物经58℃处理40 min后,细胞毒性与未经热处理时的细胞毒性差异不显著;另12株菌(蜡样芽孢杆菌1-13、1-19、1-20,枯草芽孢杆菌2-13、2-17,解淀粉芽孢杆2-15、3-29、1-17、3-33,贝莱斯芽孢杆菌 3-31、3-32、3-34)培养物的上清液58℃处理40 min后,细胞毒性与未热处理菌株粗提物的细胞毒性差异显著,其中,3株蜡样芽孢杆菌粗提物经热处理后,细胞抑制率显著下降,推测这3株蜡样芽孢杆菌分泌的有毒代谢产物为不耐热的肠毒素;另9株芽胞杆菌粗提物经热处理后细胞毒性降幅较小,加热处理后细胞毒性为28.19%~57.23%。
2.4.3 溶血性结果 对16株具有细胞毒性的芽孢杆菌进行溶血性试验,结果(表3)表明,蜡样芽孢杆菌1-13、1-19和1-20的菌落周围形成了界限分明且完全透明的溶血环,具有溶血性,即溶血类型为β-溶血;其他13株芽孢杆菌菌落周围的培养基无变化,不具有溶血性,即溶血类型为γ-溶血。
2.4.4 肠毒素的特异性抗体检测结果 对16株具有细胞毒性的芽孢杆菌是否产生肠毒素进行检测,结果(表3)表明,蜡样芽孢杆菌1-13、1-19和1-20(菌体浓度为108CFU·mL-1)的检测结果呈阳性,肠毒素含量分别为16、128和 512 ng·mL-1;其余菌株检测结果均呈阴性。
3 讨论
利用细胞毒性试验评价细菌毒性是以生物学性状基本相同的细胞系(或株)为对象,避免了动物的使用及个体差异,且操作简单、检测灵敏度高,可在细胞存活的状态下观察细胞毒性物质,研究其对细胞结构和功能的影响,分析作用机理和量效关系[41-42]。目前,已经报道的可用作芽孢杆菌毒性评价的细胞有CHO细胞、Ped-2E9细胞和Vero细胞等,但是不同哺乳动物细胞对芽孢杆菌毒素的敏感性不同。作为受试细胞,CHO细胞不仅对产呕吐毒素和肠毒素的蜡样芽孢杆菌敏感,对枯草芽胞杆菌也同样敏感[21,25];Ped-2E9细胞对枯草芽胞杆菌的毒素不敏感[22];Vero细胞对多种病毒和毒素敏感[28,43]。本研究表明,蜡样芽孢杆菌、枯草芽胞杆菌、解淀粉芽孢杆菌属部分菌株对Vero细胞具有毒性,说明Vero细胞适宜作为受试细胞用于芽孢杆菌的毒性检测,并在此基础上建立了一种用于快速检测芽孢杆菌代谢物细胞毒性的方法。通过建立的细胞毒性试验方法对实验室分离的81株芽孢杆菌的代谢物细胞毒性进行测定,结果发现,16株芽孢杆菌对Vero细胞的抑制率大于20%,显示出细胞毒性作用[28,35];其中,3株蜡样芽孢杆菌的细胞抑制率达90%以上,其余13株枯草芽孢杆菌类菌株的细胞抑制率为33.29%~65.38%。
芽孢杆菌中是否存在毒素编码基因并表达产生相应的毒素是芽孢杆菌安全性评价的重要内容。Özdemir等[36]用PCR检测法对从土耳其市场上销售的鱼肉和牛肉中分离的52株芽孢杆菌进行检测,11株蜡样芽孢杆菌和1株枯草芽孢杆菌携带2个或3个毒素编码基因;12株芽孢杆菌携带hblC和hblD基因;8株携带hblA基因;7株携带nheABC基因;1株携带nheB和nheC基因。朱奎等[44]发现,从人、动物、植物和环境中益生菌产品中分离的43株蜡样芽胞杆菌和62株枯草芽胞杆菌中约32%(37/114)的分离株携带肠毒素(Nhe和Hbl)编码基因。虽然通过PCR检测法能够检测出芽孢杆菌携带的毒素编码基因,但基因表达受转录、翻译等多层次的调控,仅检出毒素基因并不能判定菌株是否具有毒性。因此,需结合常用的安全性检测方法(如芽孢杆菌毒素检测试剂盒和溶血性试验等)[21]确认菌株产生的毒素种类。
本研究对细胞毒性试验与PCR检测、溶血性试验以及抗体免疫反应试验的结果进行比较发现,3株蜡样芽孢杆菌携带了肠毒素entFM基因及Nhe、Hbl的所有编码基因,并检测出较高的肠毒素含量且具有溶血性;3种检测方法得出的试验结果与细胞毒性试验的灵敏度和准确性一致。对于13株具有细胞毒性的枯草芽孢杆菌类菌株,只有部分菌株检测出溶血性肠毒素Hbl的一个亚基,且试剂盒与溶血性试验结果均为阴性,因此,无法判定其安全性。但细胞毒性试验及热处理试验结果表明,13株枯草芽孢杆菌类菌株产生有毒代谢产物,且这些代谢产物可能具有较好的耐热性。研究表明,枯草芽孢杆菌类菌株可分泌热稳定性的脂肽类毒素[13],该类物质能作用于细菌细胞膜,破坏膜的稳定性并产生穿孔现象,同时也会对哺乳动物细胞产生毒性,导致细胞活性降低或死亡。因此,通过本研究建立的细胞毒性试验能更灵敏地反映枯草芽孢杆菌的毒性,而针对毒素编码基因的PCR法等更适用于蜡样芽胞杆菌。综上所述,与传统的毒素编码基因PCR法及抗体免疫反应等芽孢杆菌安全性评价方法相比,本研究建立的细胞毒性试验能更准确、更灵敏地体现芽孢杆菌的毒性,且周期短、操作简单、测样量大,可作为初步选育益生芽孢杆菌的安全评估方法。

