同时快速检测马铃薯X病毒、Y病毒和S病毒试纸条的研制
张微, 李志新, 赵雪, 张金鹏, 付春江, 刘卫平, 于倩倩
(黑龙江省农业科学院克山分院,黑龙江 齐齐哈尔 161600)
马铃薯X病毒(potato virus X,PVX)也叫马铃薯轻花叶病毒,马铃薯Y病毒(potato virus Y,PVY)也叫马铃薯重花叶病毒,马铃薯 S病毒(potato virus S,PVS)也叫做马铃薯潜隐病毒,3种病毒主要通过接触和蚜虫传播。3种病毒分布范围十分广泛,主要发生在马铃薯种植区,在田间3种病毒经常混合侵染,造成严重危害[1-3]。目前,马铃薯感染病毒后主要通过电子显微镜、DASELISA(enzyme-linked immunosorbent assay)和PCR(polymerase chain reaction)等方法[4-6]进行检测,但此类方法只能在实验室进行,在生产应用中具有很大局限性[7]。胶体金免疫层析技术(gold immune-chromatography assay,GICA)是将胶体金标记、免疫检测、层析分析、单(多)克隆抗体和新材料等结合在一起的技术,具有使用方便、反应快捷、特异性强、结果准确等特点[8],目前主要应用于医学检验、动植物疫病检疫防控和食品安全监督管理等方面[9-12]。在马铃薯病毒检测上,已研制出PVX、PVY和PVS单重胶体金检测试纸条[13-14]。而马铃薯被多种病毒同时侵染时一般使用PCR方法进行检测[15]。目前,关于多重病毒胶体金检测试纸条的研究尚未见报道。为此,本研究欲研制一种可同时快速定性检测PVX、PVY和PVS的多重胶体金试纸条,以期为马铃薯病毒病的检测提供一种快速方便的方法,为马铃薯病毒病的田间鉴定奠定基础。
1 材料与方法
1.1 试验材料
供试马铃薯品种为克新13号。PVX、PVY为本实验室从马铃薯上分离得到;PVS、马铃薯卷叶病毒(potato leaf roll virus,PLRV)、马铃薯M病毒(potato virus M,PVM)和马铃薯A病毒(potato virus A,PVA)为本实验室保存。将病毒分别摩擦接种繁殖于心叶烟(Nicotiana glutinosa)上。PVX、PVY和PVS抗体均购自美国Agdia公司;兔抗羊抗体购于北京百奥莱博科技有限公司;氯金酸购自天津市光复精细化工研究所;柠檬酸三钠、牛血清白蛋白购自哈尔滨欣科瑞有限公司;硝酸纤维素膜(nitrocellulose membrane,NC 膜)、玻璃纤维膜、样品垫、吸水纸、支持板、三维大平面点膜喷金仪、裁条机、微电脑自动斩切机均购自上海金标生物科技有限公司;DAS-ELISA检测试剂盒购买于美国Agida公司。其他试剂均为国产分析纯。
1.2 胶体金的制备、鉴定
采用氯金酸−柠檬酸三钠还原法制备胶体金,具体方法参见文献[14]。
1.3 免疫胶体金试纸条制备工艺优化
对于多种病毒同时检测试纸条制备技术,在金标抗体结合过程中,如将3种病毒抗体同时加入到胶体金溶液中,不同抗体之间会产生相互作用,且每种抗体与胶体金结合的条件存在差异,因此,需要对反应过程进行优化。本研究主要针对反应液pH、3种抗体的标记量、抗体加入先后顺序、封闭时间、离心时间、复溶液用量进行优化。
1.3.1 3种抗体与胶体金反应pH优化 取8支干净的1.5 mL离心管,分别加入1 mL胶体金,然后分别加入5µL 1 mg·mL-1PVX、PVY和PVS抗体,再加入0.2 mol·L-1碳酸钾(K2CO3)1、2、3、4、5、6、7和8µL调节pH,混匀后室温震荡反应30 min,观察不同pH反应颜色变化,确定K2CO3的最适加入量,每处理3次重复。
1.3.2 3种抗体使用量的优化 取8支干净的1.5 mL离心管,分别加入1 mL胶体金和1.3.1确定的适量 K2CO3(0.2 mol·L-1),再分别加入 1 mg·mL-1PVX、PVY和PVS抗体1、2、3、4、5、6、7和8 µL,调节抗体标记量,混匀后室温震荡反应30 min,观察不同抗体加入量时沉淀变化,确定免疫胶体金的最适抗体标记量,每处理3次重复。
1.3.3 抗体加入顺序优化 取6支干净的1.5 mL离心管,分别加入1 mL胶体金和适量K2CO3(0.2 mol·L-1),再分别按照 PVX-PVY-PVS、PVX-PVSPVY、PVY-PVX-PVS、PVY-PVS-PVX、PVS-PVXPVY和PVS-PVY-PVX顺序分别加入1 mg·mL-13种最适抗体加入量。混匀后室温震荡反应30 min,观察颜色变化。根据颜色变化确定3种抗体加入先后顺序,每个处理3次重复。
1.3.4 封闭时间与离心时间的优化 按照1.3.1~1.3.3筛选的最适条件进行标记的金标抗体中加入10%BSA,先设置封闭时间分别为20、25、30、35、40、45和50 min,离心30 min;再设置封闭30 min,离心时间分别为 20、25、30、35、40、45和 50 min。离心后,观察上清与沉淀量的关系,确定最佳封闭时间与离心时间,每处理3次重复。
1.3.5 复溶液使用量的优化 金标抗体按照最佳封闭时间与离心时间离心后,留沉淀弃上清,分别用80、90、100、110和120µL的复溶液对沉淀进行复溶。用喷金仪器设置合适的喷金量,喷在玻璃纤维纸上,制作金标垫,根据质控线的颜色确定复溶液的最佳用量,每处理3次重复。
1.4 检测线和质控线
将PVX、PVY和PVS抗体分别用超滤管(millipore,10 kD)浓缩至1.0 mg·mL-1,将NC膜固定贴合于支持板上,使用三维平面点膜喷金仪,将3种抗体划线于NC膜上,作为检测线(testline,T线),其中,T1线为PVX检测线;T2线为PVY检测线;T3线为PVS检测线。用0.02 mol·L-1磷酸缓冲液(phosphatic buffer solution,PBS,pH 7.4)将羊抗兔抗体稀释至1.0 mg·mL-1,划线于硝酸纤维素膜上,作为质控线(controlline,C线),37℃烘4 h。
1.5 试纸条的组装
将样品垫、金标垫和吸水纸组装到附有NC膜的支持板上,然后用切条机切割成3.5 mm宽度的试纸条。
1.6 试纸条的质量检测
1.6.1 特异性检测 利用PLRV、PVA、PVM、PVS、PVY、PVX以及PVX、PVY和PVS 3种病毒混合液对试纸条的特异性进行检测;将以上每种病毒的阳性材料用 2 mL的 PBS(0.02 mol·L-1)缓冲液混匀,制成样品检测液,将制备好的试纸条置于样品液中检测,重复检测3次。
1.6.2 灵敏度检测 取初始浓度为1 mg·mL-1的PVX、PVY和PVS阳性混合样品进行倍比稀释获得 1、2、10、20、102、2×102、103、2×103和104倍样品稀释液,用以检测试纸条的灵敏度。
1.6.3 准确性检测 取马铃薯待检样品54份,分别采用胶体金试纸条和DAS-ELISA进行检测,将检测结果进行对比分析。DAS-ELISA方法具体如下:①包被抗体,酶联板用1∶1 000稀释倍数的病毒特异性抗体(Ig G)包被,包被液由碳酸钠和碳酸氢钠组成,每个酶联板的小孔加入150µL的包被液,酶联板置于37℃温箱中温育3~4 h;②洗板,用洗瓶在每个孔中加满洗涤液,3 min后弃去洗涤液,重复洗涤8次;③加样,将待测样品称重编号后放入研钵,在研钵内加入样品提取缓冲液(0.2 g样品加入l mL缓冲液),取每个样品150µL上清液加入酶联板,同时设置阴性对照、阳性对照和空白对照,放入4℃冰箱内过夜;④加酶标,在洗涤后的酶联板中加入150µL酶标抗体,37℃温育3~4 h;⑤加底物液,在洗涤后的酶联板中加入100µL底物液,进行显色反应;⑥测OD值,将酶联板放入酶联免疫检测仪中测定OD值。
1.6.4 稳定性测试 将三重病毒检测试纸条置于铝箔袋中,加入干燥剂,每袋1条,一共180条,将其均分为3份。1份热合封口后保存于2~6℃低温环境中;1份热合封口后保存于室温;1份不封口保存于室温;分别对以上保存条件设置保存12个月,每个月检测试纸条有效性。
1.7 透射电镜观察胶体金形态
滴一滴胶体金溶液于铜网上,室温吸附15 min,然后用0.1%的PBS洗5次,吸去余液,再用磷钨酸负染5 min,干燥后置于透射电镜(HT7700,日本)下观察胶体金形态。
2 结果分析
2.1 胶体金颗粒
本试验使用的胶体金最大吸收值在520~530 nm处(图1),其颗粒形状为球型或椭球型,直径大小20~30 nm(图2)。
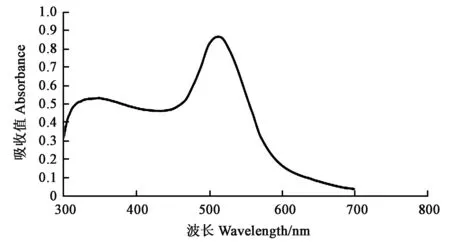
图1 胶体金吸收光谱Fig.1 Colloidal gold absorption spectrum

图2 透射电镜下胶体金颗粒形态Fig.2 Colloidal gold particle morphology under transmission electron microscope
2.2 胶体金试纸条制备条件的优化
在节约耗材的基础上,为达到理想的显色效果,经过试验,制备金标抗体的最佳反应条件为:加入0.2 mol·L-1K2CO33µL调节pH,金标抗体混合液颜色为红色;抗体加入量为4µL,此时仍没有沉淀;按照PVY、PVX和PVS的先后顺序加入效果最好,金标抗体混合液颜色为红色;最适封闭时间为30 min,离心时间40 min,金标抗体混合液颜色由红色转为酒红色,吸取上清时沉淀不易悬浮;最佳复溶液使用量为100µL,复溶沉淀喷金后,试纸条显色为酒红色,清晰可见(表1)。
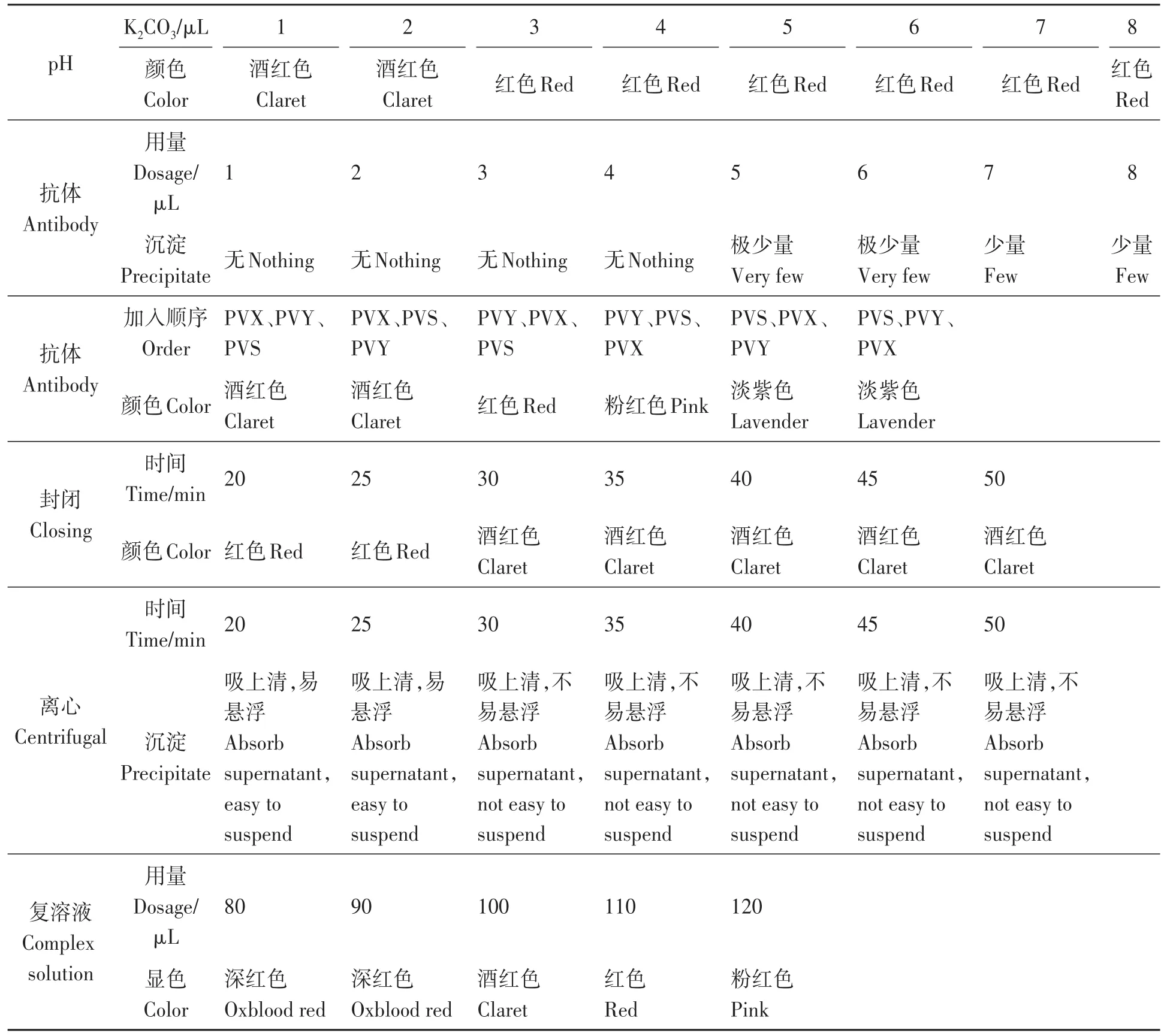
表1 免疫胶体金试纸条制备工艺优化Table 1 Optimization of preparation process of immune colloidal gold strip
2.3 试纸条的特异性
将试纸条分别插入PVS、PVY和PVX阳性样品中,相应病毒的检测线及质控线出现明显条带;3种病毒阳性样品混合后,将试纸条插入混样后,3条检测线和质控线均出现清晰条带;将试纸条分别插入PLRV、PVM、PVA的阳性样品中,仅质控线出现条带,表明三重病毒检测试纸条具有高度特异性。(图3)。

图3 试纸条对6种常见病毒的特异性检测Fig.3 Specific detection of 6 common viruses by strip
2.4 试纸条的灵敏度
分别将试纸条插入稀释 1、2、10、20、102、2×102、103、2×103、104倍的PVX、PVY和PVS 3种病毒阳性样品混合液中检测试纸条的灵敏度。结果发现,试纸条可检测稀释至104倍的PVX稀释液、2×103倍 PVY 稀释液和 103倍 PVS稀释液(图4)。

图4 试纸条的灵敏度检测Fig.4 Sensitivity detection of test strips
2.5 试纸条准确性
随机从马铃薯种薯生产田间采集叶片54份,经试纸条检测,结果含有PVX的样品为2份,含有PVY的样品为3份,含PVS的样品为7份,既含有PVY又含有PVS的样品为2份,同时含有3种病毒的样品为3份,37份为阴性,再用DAS-ELISA方法确认,两者结果一致(图5)。
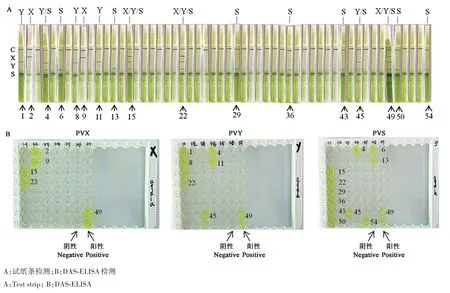
图5 54份田间采集马铃薯样品检测Fig.5 Detection of 54 potato samples collected from the field
2.6 试纸条的稳定性
图6表明,三重病毒检测试纸条在2~6℃环境中密封保存,有效期可达210 d;室温密封保存,有效期大于120 d;室温下敞开保存,有效期不足30 d。本试纸条适合在低温环境下密封保存,可维持较好的稳定性。

图6 试纸条稳定性测试Fig.6 Stability of test strip
3 讨论
PVX、PVY和PVS为侵染马铃薯最常见的3种病毒,其中,PVX和PVS单独侵染时危害较轻;PVY单独侵染时危害较重。如果不进行脱毒处理,病毒在马铃薯块茎中积累会导致种薯逐年退化,产量和品质受到严重影响。PVS是最难从马铃薯中脱除的病毒,且常与其他病毒复合侵染。2种以上不相关的病毒复合侵染同一寄主是病毒侵染过程中的常见现象。多种病毒复合侵染马铃薯危害会更加严重。研究表明,PVX与其他病毒复合侵染马铃薯造成的危害严重超过单一侵染的危害,对马铃薯产量和品质造成严重威胁[1,16],因此,开发对复合侵染病毒检测的方法具有重要意义。研究表明,通过电镜手段和PCR技术可以对PVX/PVY/PVS复合侵染进行检测[17-18],但只能在实验室开展。为了实现能够在田间对PVX/PVY/PVS复合侵染同时快速检测的目标,本研究通过优化制备条件,研制出了同时快速检测PVX/PVY/PVS的三重病毒检测试纸条。经过田间取样测试,三重病毒检测试纸条与DAS-ELISA检测结果完全一致。研究表明,单一检测PVX或PVY的试纸条在检测样品时反应时间约为10 min,试纸条的灵敏度分别为104倍(W/V)和103倍[13];单一检测PVS试纸条检测样品的反应时间约为2 min[14],灵敏度为104倍(W/V)[14]。一般情况下,多重病毒检测试纸条的灵敏度会低于单一病毒检测试纸条。本研究开发的三重病毒试纸条检测样品时间为5 min左右,反应快捷;且灵敏度与单一检测试纸条基本保持一致,说明本试纸条的制备技术较为先进。三重病毒检测试纸条在马铃薯田间使用时更为高效,1个试纸条可以同时实现检测3种病毒;在制备成本上较单一检测试纸条更节约耗材;且检测结果能够满足田间及口岸一线的检测要求,为马铃薯病毒病的检测提供了一种快速方便的方法。

