二氧化钛复合聚苯胺降解染料废水研究*
左志芳,夏文文,诸昌武,李宇冉,韩驭章,郭 婕
(1 扬州工业职业技术学院化学工程学院,江苏 扬州 225127;2 江苏省环境监测中心,江苏 南京 210036)
染料纺织业生产废水是典型工业废水之一,据统计工业废水中17%~25%的废水来自染料纺织业,此类废水中含有大量的含有π键的偶氮类染料。在一定条件下,这一类染料会分解成20多种致癌芳香胺。这一类废水若未经处理排放到受纳水体中,可能会严重影响接触者的健康。对于偶氮类染料废水的处理方法有很多,常见的有混凝、吸附、化学氧化、光降解、生物法等。传统的吸附、混凝存在着吸附剂再生以及混凝污泥的处理困难等问题,生物法则由于废水中染料分子对微生物会产生毒性,处理效果不佳,光催化降解是近年来备受关注的处理方法之一。TiO2作为一种常见的光催化降解材料,具有较好的催化效果,适用范围广,降解较为彻底,但在实际应用中存在着适用光吸收波长局限在紫外光波段,反应后易流失,在空气中易团聚等缺点[1-5]。范文玉,王红侠[2-7]等提出制备TiO2的复合光降解材料以提高可见光波段的降解效果并改善其团聚的情况。聚苯胺(PANI)作为近年来性能优质的导电高分子材料,拥有着特殊的电学和光学性质,因此备受人们的关注。聚苯胺对于可见光的利用率较高,能够与TiO2进行带隙耦合,提高TiO2的在自然光条件下的降解能力。
本文采用化学氧化法,以过硫酸铵为氧化剂,制备聚苯胺和TiO2复合光降解材料,考察该复合材料对染料模拟废水(以甲基橙为代表)的降解效果,取得较为理想的实验结果。
1 实 验
1.1 试 剂
苯胺,过硫酸铵,盐酸,甲基橙,乙醚,均购于国药集团化学试剂有限公司,以上药品均为化学纯;TiO2,德国德固赛P25;去离子水。
1.2 仪器设备
Tecnai 12透射电镜,荷兰Philips;GeminiSEM 300蔡司场发射扫描电镜系统,德国Carl Zeiss;紫外-可见-近红外吸收光谱仪Cary5000,美国Varian;UV1801紫外可见分光光度计,北京瑞丽分析仪器公司;圣科101系列数显鼓风干燥箱,上海圣科仪器设备有限公司;EMS-9B磁力加热搅拌器,天津欧诺仪器股份有限公司。
1.3 实验方法
1.3.1 不同配比复合材料的制备
定量称取TiO2,经超声分散在50 mL浓度为2 mol/L的盐酸中,充分分散后加入1 mL苯胺,并在0~5 ℃条件下搅拌混匀,称取2.4 g过硫酸铵,将其溶于25 mL的去离子水中,然后逐滴加到苯胺和TiO2的混合体系中,并在30 min内完成滴加。将系统保持在0~5 ℃条件下持续搅拌3 h。反应完成后进行抽滤,用乙醚洗涤滤饼数次,直至充分吸取滤饼中残留的未反应的苯胺和过硫酸铵,后用去离子水洗涤滤饼数次直至洗涤液未检出Cl-离子,将所得固体在60 ℃下干燥至恒重,以获得TiO2和聚苯胺复合材料,将其研磨以备后用。
1.3.2 聚苯胺/ TiO2复合材料对染料模拟废水降解研究
定量称取不同配比的催化材料,放入100 mL浓度30 mg/L的甲基橙溶液中,在黑暗中超声分散10 min,可见光条件下降解,每20 min取样测试,并在相同条件下以纯TiO2做降解对比实验。
2 结果与讨论
2.1 复合材料表征
2.1.1 复合材料扫描电镜和投射电镜表征
针对TiO2/ANI摩尔比为10:1的复合材料和聚苯胺进行扫描电镜和透射电镜表征。

图1 材料扫描电镜和透射电镜照片
电镜照片显示,球形TiO2颗粒沉积在聚苯胺表面上,分散较好,表明TiO2易于团聚的现象得到了较好地改善。同时发现纯苯胺经聚合后外观呈现纤维状,而与TiO2复合后材料的外观呈颗粒状,因为TiO2在苯胺的聚合反应中起凝聚核作用,聚合后的材料外观从纤维状变为颗粒状[8-10]。
2.1.2 复合材料红外光谱分析
红外谱图中509 cm-1处有明显的吸收峰,该峰是TiO2的特征吸收峰,预示着材料中TiO2的存在,而在1145 cm-1和1565 cm-1之间的多个吸收峰中 1145 cm-1处的吸收峰,这是聚苯胺结构中电子离域的表现,1245 cm-1和1301 cm-1两处吸收峰为C-N键在平面中弯曲振动的特征峰,预示着材料中存在 C-N结构,而1484 cm-1则是苯结构中C=C键伸缩振动的吸收峰,1565 cm-1是材料中C=N键伸缩振动吸收峰,预示着聚苯胺醌式结构的存在,且苯式-醌式结构共存,同时可以通过两峰的强弱判断聚苯胺的氧化程度,1565 cm-1处吸收峰强度越大,说明聚苯胺的氧化程度越高,3430 cm-1处较宽的吸收峰则是胺中N-H键伸缩振动的吸收峰,同时由于TiO2的O原子与聚苯胺中的H之间可形成氢键,氢键在该峰附近也产生吸收,使此处的峰宽变大。[2,5,10]

图2 材料红外光谱图
2.2 复合材料对甲基橙模拟废水降解研究
2.2.1 最佳配比实验
实验考察了TiO2和苯胺不同摩尔比的复合材料在自然光条件下对甲基橙的降解效果,并以纯TiO2作对比,得到实验结果如图3。

图3 不同配比下的光催化复合材料降解效果
图3数据显示,在可见光条件下,复合光催化材料对甲基橙的催化效果比纯TiO2在可见光下的催化降解效果理想,这是因为聚苯胺的禁带宽度较小,聚苯胺在可见光易于被激发产生光电子,该光电子可以跃迁到TiO2的导带,可与被吸附的O2反应生成O2-,同时聚苯胺由于电子跃迁形成的空穴也可与H2O生成OH-,并且TiO2的光生空穴也可以迁移至聚苯胺的π轨道,与OH-和H2O形成羟基自由基,通过这些自由基完成对甲基橙的攻击,破坏其结构使之最终得以降解[5-7,10]。反应机理如图4所示。实验中发现,聚苯胺的用量会影响光催化效果,聚苯胺量少则不易产生足够的光电子,催化效果不佳,但用量过多则会对TiO2产生裹覆,从而影响其对可见光的吸收,研究表明同等条件下,当TiO2/ANI摩尔比为10:1时,甲基橙降解效果最佳[10]。

图4 光降解机理图
2.2.2 pH影响实验
pH值的改变有时会引起物质结构的变化,以甲基橙为例,在中性或碱性溶液中,甲基橙表现为磺酸盐的形式,而在酸性溶液中,则转变为磺酸,磺酸基与分子内的碱性二甲氨基形成含有对醌式结构的内盐形式,这也是甲基橙在不同pH值下变色的原因;同时,pH值的变化会改变催化剂表面所带电荷的性质,进而影响催化剂在溶液中对带电物质的吸附性能。实验中考察了在催化剂投加量在0.5 g/L的条件下,pH=3,pH=5,pH=7,pH=9四个pH值条件下,经过2 h的反应TiO2/ANI摩尔比为10:1复合催化剂对甲基橙模拟废水的降解效果,实验结果见图5。

图5 pH值对降解效果的影响
实验结果显示,当pH=3的时,甲基橙的降解效果最显著,达到80.67%,且酸性条件和碱性条件降解效果均优于中性条件。这是由于酸性条件下,复合材料所生成的光生电子和空穴主要利用材料表面的氧生成羟基自由基,而在碱性条件下羟基作为光生空穴的俘获剂而生成羟基自由基,故在酸性条件和碱性条件下都有利于甲基橙被光催化复合材料生成的羟基自由基所氧化降解。有研究者[11]通过研究发现聚苯胺的等电点约为8.49,而TiO2的等电点约为6.5,可以考虑复合材料的等电点约在7.7,酸性条件可以使催化剂表面带正电,甲基橙中的磺酸基更容易被吸附于催化剂表面而被降解。
同时,由于甲基橙在中性或碱性溶液中呈偶氮式的磺酸盐形式,而在酸性溶液中转变为磺酸,与分子内的碱性二甲氨基成内盐形式,呈醌式结构,有研究表明,甲基橙的醌式结构比偶氮式结构更易于发生脱碳降解[12-13],故酸性条件甲基橙的降解速度高。
2.2.3 投加量影响实验
实验研究了pH=3时,TiO2/ANI摩尔比为10:1的复合催化剂在不同投加量条件下2h的降解效果,实验结果见图6。
图6实验结果表明,该催化剂0.5 g/L的投加量,经过2 h甲基橙模拟废水的降解率为80.67%,继续增加催化剂的投加量至1 g/L时,发现降解率提高不大,进一步加大投加量,降解效率反而出现下降,主要是由于在一定范围内随着催化剂投加量的增加,催化活性中心点增加,降解效果提高显著,但进一步增加催化材料用量,则会影响光在溶液中的传播,部分催化剂表面活性点不能有效利用光进行催化降解,催化效果下降[12-13]。根据实验确定最佳投加量0.5 g/L。

图6 投加量对降解效果的影响
2.3 甲基橙降解性能及动力学研究
实验考察了复合材料在最佳降解条件下降解甲基橙的紫外可见波段内降解效果变化,随着时间推移,甲基橙的特征峰逐渐减弱,说明甲基橙被有效降解。

图7 复合材料降解甲基橙紫外-可见吸收光谱
同时考察了复合材料对甲基橙模拟废水降解的动力学参数,将降解浓度变化数据按ln(C0/C)对时间(t)进行数据拟合,同时以纯TiO2作对比,得到拟合结果见图8和表1。
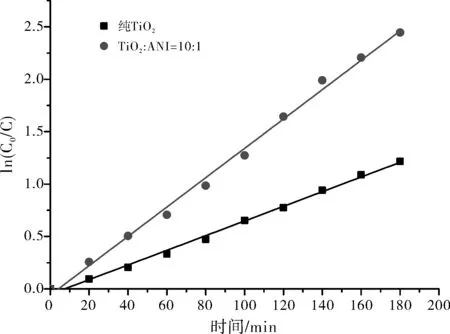
图8 光催化复合材料在最优条件下的降解动力学影响

表1 甲基橙降解动力学参数
由图8和表1的结果可见,在相同实验条件下,纯TiO2和与聚苯胺复合改性后的催化材料对甲基橙模拟废水的降解均符合准一级降解动力学规律,同时通过反应速率常数和半衰期数值可以看出,经聚苯胺修饰后的TiO2对甲基橙模拟废水的降解效果优于纯TiO2,可见通过与聚苯胺的复合,提高了TiO2在自然光条件下对甲基橙模拟废水的降解效果[10]。
3 结 论
采用化学氧化法在液相中制备了聚苯胺/ TiO2光降解复合材料。通过研究发现,当TiO2/ANI的摩尔比为10:1时,甲基橙模拟废水的浓度为30 mg/L时的降解效果最好。电镜和红外表征发现TiO2和聚苯胺有效地复合。自然光降解实验结果表明经聚苯胺改性后的TiO2光生电子与空穴的复合的几率降低,使得 TiO2在自然光条件下对甲基橙也具备了较好地降解效果。实验同时研究了该复合催化材料在降解甲基橙过程中最佳pH条件和最佳投加量,实验数据表明当废水pH=3,催化剂用量为0.5g/L时,2h对甲基橙模拟废水的降解率可达80.67%,同时发现酸性条件有利于甲基橙在液相中以醌式结构出现,并被吸附和降解;催化剂的用量在一定范围内有利于提高降解效果,但用量过多则影响光在溶液中的穿透,对降解产生不利影响[10]。

