胰炎消方治疗重症急性胰腺炎疗效及对炎症因子、肝脏功能和肠黏膜屏障功能的影响
张 琦 佟明铭 陶 红 田朝霞
(河北省秦皇岛中医医院,河北 秦皇岛 066000)
急性胰腺炎(AP)是由于胰腺内胰酶激活所致的胰腺急性炎症性疾病,其主要病理特征为胰腺腺泡细胞破坏、组织出血、水肿和坏死[1-2]。本病是临床常见的消化系统急症,起病急,病情进展快,常常累及全身器官和系统而发展为重症急性胰腺炎(SAP)[3-4]。目前,国内治疗SAP以保守治疗为主的多学科综合救治,包括胃肠减压、液体复苏、抗生素的应用、营养支持等[5],但仍有部分患者效果不理想。近年来,中医药在SAP的治疗中逐渐得到重视,中医辨证论治在提高疗效、改善患者预后方面发挥了重要作用[6]。中医理论认为SAP主要病机为湿热内蕴、瘀热互结,与肝胆、脾胃密切相关,治以清腑泻热解毒、活血化瘀为主[7-8]。本研究根据SAP的中医病机特点,应用胰炎消方治疗AP获得满意的临床疗效,并与常规西医治疗做对照。现报告如下。
1 资料与方法
1.1 病例选择 西医诊断参照《中国急性胰腺炎诊治指南》[9]SAP西医诊断标准;中医诊断标准参照《急性胰腺炎中西医结合诊疗共识意见》[10]中瘀热互结的中医辨证标准。纳入标准:年龄18~65岁;接受非手术治疗;自愿参加本研究,并签署协议书。排除标准:合并消化道瘘、胰瘘等并发症需手术治疗者;重型爆发型AP者;有慢性胰腺炎病史者;心肝肾严重功能不全者;血液病、恶性肿瘤、自身免疫系统疾病、精神疾病者;妊娠或哺乳期女性;对本研究所应用药物过敏者。
1.2 临床资料 选择本院2018年4月至2021年4月收治的SAP患者90例,按照随机数字表法分为治疗组与对照组各45例。治疗组男性26例,女性19例;年龄23~64岁,平均(38.42±8.53)岁;发病时间2~38 h,平均(6.88±1.92)h;体质量指数 22.51~27.84 kg/m2,平均(24.72±2.05)kg/m2。男性23例,女性22例;年龄22~64岁,平均(39.08±8.77)岁;发病时间 3~42 h,平均(7.09±1.86)h;体质量指数 22.45~27.89 kg/m2,平均(24.79±2.11)kg/m2。两组临床资料差异无统计学意义(P>0.05)。
1.3 治疗方法 对照组进行西医常规治疗,包括禁食水、持续胃肠减压、静脉补液、维持水电解质酸碱平衡、营养支持、改善微循环等,并给予制酸剂、胰酶分泌抑制剂、抗生素等药物。治疗组在上述治疗基础上给予中药胰炎消方口服或胃管注入,组方:金钱草45 g,蒲公英、黄芪、半边莲、鸡矢藤各30 g,丹参、赤芍、柴胡、枳实、大黄、延胡索各15 g,黄芩、栀子、桃仁、厚朴、芒硝、木香各10 g。上述药物由本院制剂室代煎,每剂煎取300 mL,分3次口服或胃管注入,疗程为7 d。
1.4 观察指标 1)中医证候评分:治疗前后对患者进行中医证候评分,将发热、腹痛、腹胀、恶心呕吐、大便秘结分为无、轻度、中度、重度4个级别,分别计0、2、4、6分,各项积分之和为该患者的中医证候评分。2)血尿淀粉酶及肝功能相关指标:于治疗前及治疗结束后第2日抽取两组清晨空腹静脉血,并留取中段晨尿,应用德国产迈瑞BS-280型全自动生化分析仪测定血淀粉酶、尿淀粉酶、谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBiL)含量。3)炎症因子和肠黏膜屏障功能指标:治疗前后抽取两组清晨空腹静脉血,以3 000 r/min转速离心10 min,静置后收集血清置于-80℃冰箱内待测,应用酶联免疫法测定白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、核因子-κB p65(NF-κB p65)、D-乳酸、二胺氧化酶(DAO)含量。
1.5 统计学处理 应用SPSS23.0统计软件。计量资料以()表示,组间、组内比较应用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前后中医证候评分比较 见表1。治疗前两组SAP患者主要中医证候发热、腹痛、腹胀、恶心呕吐、大便秘结评分差异均无统计学意义(P>0.05),治疗后两组上述各项评分均降低(P<0.01),两组比较,治疗组降低情况更为显著(P<0.01)。
表1 两组治疗前后中医证候评分比较(分,±s)
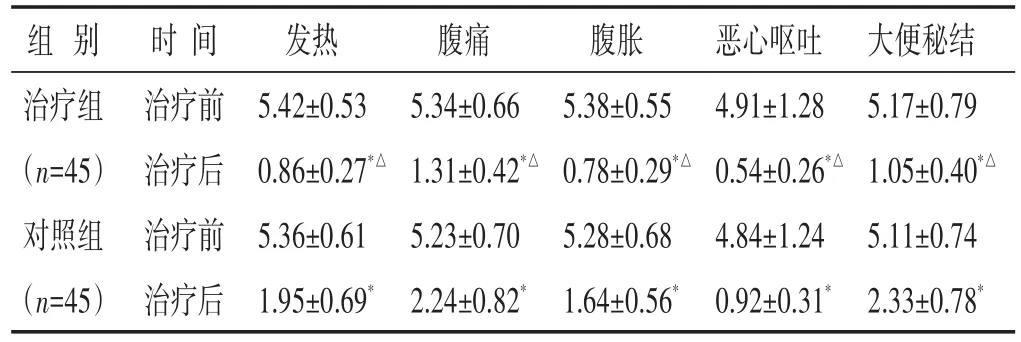
表1 两组治疗前后中医证候评分比较(分,±s)
注:与本组治疗前比较,*P<0.01;与对照组治疗后比较,△P<0.01。下同。
组别治疗组(n=45)对照组(n=45)时间治疗前治疗后治疗前治疗后发热5.42±0.53 0.86±0.27*△5.36±0.61 1.95±0.69*腹痛5.34±0.66 1.31±0.42*△5.23±0.70 2.24±0.82*腹胀5.38±0.55 0.78±0.29*△5.28±0.68 1.64±0.56*恶心呕吐4.91±1.28 0.54±0.26*△4.84±1.24 0.92±0.31*大便秘结5.17±0.79 1.05±0.40*△5.11±0.74 2.33±0.78*
2.2 两组治疗前后血、尿淀粉酶比较 见表2。治疗前两组血淀粉酶、尿淀粉酶含量差异无统计学意义(P>0.05),治疗后两组血淀粉酶、尿淀粉酶含量均显著降低(P<0.01);两组比较,治疗组改善更加显著(P<0.01)。
表2 两组治疗前后血尿淀粉酶比较(U/L,±s)
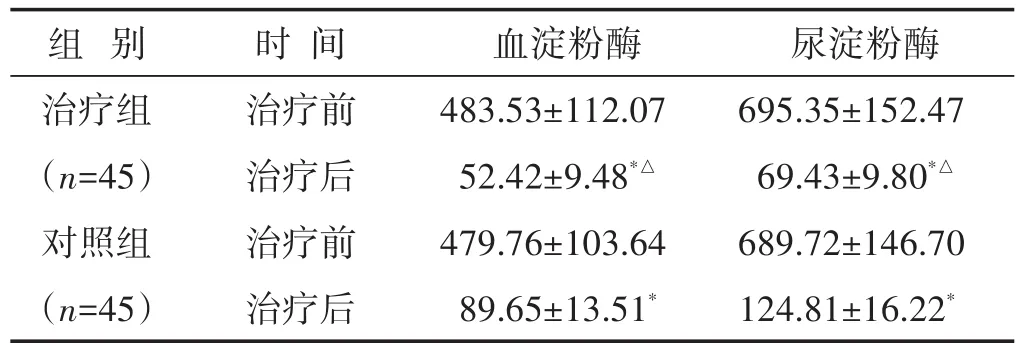
表2 两组治疗前后血尿淀粉酶比较(U/L,±s)
组 别 时 间 血淀粉酶 尿淀粉酶治疗前治疗后治疗前治疗后治疗组(n=45)对照组(n=45)483.53±112.07 52.42±9.48*△479.76±103.64 89.65±13.51*695.35±152.47 69.43±9.80*△689.72±146.70 124.81±16.22*
2.3 两组治疗前后肝功能指标比较 见表3。治疗前两组ALT、AST、TBiL差异无统计学意义(P>0.05),治疗后两组ALT、AST、TBiL均降低(P<0.01),治疗组均低于对照组(P<0.01)。
表3 两组治疗前后ALT、AST、TBiL比较(±s)
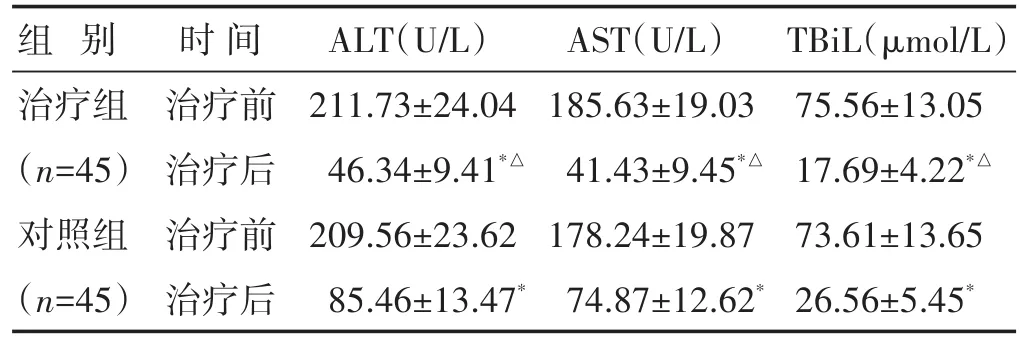
表3 两组治疗前后ALT、AST、TBiL比较(±s)
组别治疗组(n=45)对照组(n=45)时间治疗前治疗后治疗前治疗后ALT(U/L)211.73±24.04 46.34±9.41*△209.56±23.62 85.46±13.47*AST(U/L)185.63±19.03 41.43±9.45*△178.24±19.87 74.87±12.62*TBiL(μmol/L)75.56±13.05 17.69±4.22*△73.61±13.65 26.56±5.45*
2.4 两组治疗前后炎症因子比较 见表4。治疗前两组血清IL-6、TNF-α、NF-κB p65差异无统计学意义(P>0.05),与治疗前比较,治疗后两组血清IL-6、TNF-α、NF-κB p65水平均降低(P<0.01),治疗组显著低于对照组(P<0.01)。
表4 两组治疗前后血清IL-6、TNF-α、NF-κB p65比较(±s)
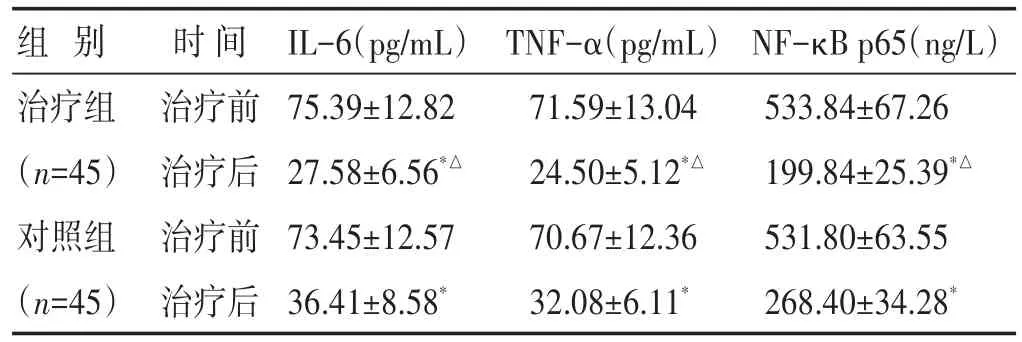
表4 两组治疗前后血清IL-6、TNF-α、NF-κB p65比较(±s)
组别治疗组(n=45)对照组(n=45)时间治疗前治疗后治疗前治疗后IL-6(pg/mL)75.39±12.82 27.58±6.56*△73.45±12.57 36.41±8.58*TNF-α(pg/mL)71.59±13.04 24.50±5.12*△70.67±12.36 32.08±6.11*NF-κB p65(ng/L)533.84±67.26 199.84±25.39*△531.80±63.55 268.40±34.28*
2.5 两组治疗前后肠黏膜屏障功能指标比较 见表5。结果为治疗前两组血清D-乳酸、DAO含量差异无统计学意义(P>0.05),治疗后两组血清D-乳酸、DAO含量均低于治疗前(P<0.01),治疗组降低更明显(P<0.01)。
表5 两组治疗前后血清D-乳酸、DAO含量比较(±s)
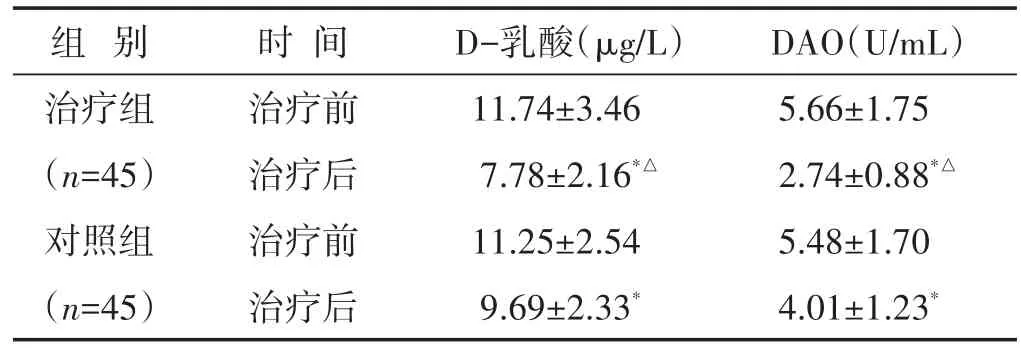
表5 两组治疗前后血清D-乳酸、DAO含量比较(±s)
组别治疗组(n=45)对照组(n=45)时间治疗前治疗后治疗前治疗后D-乳酸(μg/L)11.74±3.46 7.78±2.16*△11.25±2.54 9.69±2.33*DAO(U/mL)5.66±1.75 2.74±0.88*△5.48±1.70 4.01±1.23*
3 讨 论
SAP是临床常见的急腹症,胰酶异常激活导致胰腺组织弥漫性出血、坏死是本病的主要机制,胰腺组织内发病同时可释放大量炎症因子,产生肠源性内毒素,并可诱发其他器官功能衰竭。SAP往往病情凶险,及时有效治疗对于改善预后具有重要意义[11]。中医学根据SAP的临床表现将其纳入“脾热病”“胰瘅”“脾瘅”“脾心痛”等范畴[12],患者素体肥胖,嗜食肥甘厚味,易化生湿热之邪,致湿邪困脾,进而脾胃不和,肝胆不利。脾脏升降失司,致湿热蕴结中焦,久而生瘀,同时肝失疏泄,致气机瘀滞,脏腑功能紊乱而发本病。治以清热利湿解毒,活血化瘀为主。胰炎消方是本院在胰腺炎长期治疗中总结的经验方,由金钱草、蒲公英、黄芪、半边莲等17味中药组成,其中金钱草可清热利湿,蒲公英、半边莲、黄芩、栀子可清热解毒,丹参、桃仁、赤芍可清热凉血,活血化瘀,鸡矢藤散瘀解毒,延胡索活血行气止痛,柴胡疏肝理气,枳实、厚朴、木香、芒硝可泻下热结、荡涤肠腑,大黄可清湿热,攻积滞,凉血祛瘀解毒;黄芪可健脾益气,托毒排脓。全方配伍清热利湿解毒、活血化瘀、通腑泻下兼顾,对SAP标本兼治。本研究发现治疗后治疗组发热、腹痛、腹胀等中医证候评分改善情况优于对照组,血尿淀粉酶均低于对照组,表明胰炎消方应用于SAP的治疗有利于改善患者中医证候,降低血尿淀粉酶含量,提高治疗效果。
研究表明,SAP在发病过程中由于多种炎症因子大量释放并相互作用,往往会诱发肝、肾、肠道等胰外器官的损伤,其中肝脏损伤率可高达88.9%[13]。肝脏是机体代谢的重要器官,多种炎症因子和细胞因子灭活均有肝脏的参与,因此肝脏也是多种炎症因子和细胞因子作用的靶器官,是SAP发病后早期损伤的胰外器官[14]。SAP发病会产生多种炎症介质,这些炎症介质进入肝组织后,激活肝巨噬细胞,产生IL-6、TNF-α、NF-κB p65等大量炎症因子产生和释放,进一步加重机体的炎症反应[15]。SAP发生后胰腺组织NF-κB表达于3 h左右达到高峰,刺激胰腺组织产生大量炎症因子,并通过门静脉系统进入肝脏,激活肝组织NF-κB的表达,NF-κB通过炎症介质加重肝组织微循环障碍,诱导肝细胞凋亡,导致肝功能损伤[16]。NF-κB p65是NF-κB的核心蛋白,而IL-6、TNF-α是人体内经典的炎症因子,也是NF-κB调控的主要的下游分子。本研究发现治疗后治疗组血清IL-6、TNF-α、NF-κB p65水平显著低于对照组,肝功能指标ALT、AST、TBiL也显著低于对照组,提示胰炎消方可能通过调节NF-κB的表达和炎症因子的释放,抑制机体的炎症反应,保护肝脏功能。
近年来的研究表面肠黏膜屏障功能障碍及由此导致的肠功能衰竭、细菌移位是急性胰腺炎发病的重要机制[17],DAO是分布于小肠绒毛上皮高活性酶类,在肠黏膜屏障功能受损时分泌量增加,其血液含量可反应肠黏膜完整性和受损程度[18]。D-乳酸为肠道细菌发酵产生的代谢产物,在肠道黏膜功能损伤、通透性增加时,肠道细菌产生的D-乳酸会进入血液循环,使D-乳酸的血清含量升高[19]。本研究发现治疗后治疗组血清DAO、D-乳酸水平均低于对照组,提示中药胰炎消方应用于SAP的治疗可改善肠道黏膜的屏障功能,这也可能是胰炎消方抑制胰腺炎症反应的机制之一。
综上所述,胰炎消方可有效降低中医证候评分,降低血尿淀粉酶含量,保护肝脏功能,治疗SAP效果显著,其机制可能与调节调节NF-κB的表达和炎症因子的释放,保护肠道黏膜屏障功能有关。但具体机制尚需开展基础研究进一步验证。

