异鼠李素通过抑制泡沫细胞形成增加动脉粥样硬化斑块稳定性的机制研究
王婷婷,李妍,张明明,蒋国健,郭文怡,张东伟
冠状动脉粥样硬化斑块的形成被认为是导致急性心血管事件的重要原因[1]。巨噬细胞脂质代谢异常进而演变成泡沫细胞并在内皮下不断聚集是动脉粥样硬化斑块起始和发展的关键。研究表明,泡沫细胞是巨噬细胞中脂质代谢失调形成的,当巨噬细胞中积累大量的脂质时会导致脂滴的形成,而脂滴作为一种特殊的细胞器,将导致巨噬细胞呈泡沫状[2]。大量泡沫细胞的不断聚集将导致斑块中新生血管形成、大量脂质池和坏死核心的形成,最终导致斑块不稳定。因此,探讨动脉粥样硬化斑块形成过程中泡沫细胞形成的机制,并制定通过减少泡沫细胞形成、减小斑块中脂质核心面积来增加动脉粥样硬化斑块稳定性的治疗策略,对减少急性心血管事件的发生具有重要意义。
异鼠李素是一种可从银杏、沙棘及大量花、果实和叶中提取的黄酮类化合物,已有研究发现其具有抗血小板聚集、扩张冠状动脉、降血脂的药理作用[3],其作用机制可能是由于异鼠李素能够抑制促炎因子的释放,从而抑制动脉粥样硬化病程进展[4]。但异鼠李素是否可通过减少巨噬细胞中脂滴数目、抑制泡沫细胞形成、减少泡沫细胞的浸润、减小动脉粥样硬化斑块中的脂质核心面积,最终增加动脉粥样硬化斑块稳定性,目前尚不得知。本研究在前期研究[1-4]基础上,通过高脂饮食和氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)干预分别构建动脉粥样硬化动物模型和细胞模型,探索异鼠李素是否可以通过改善巨噬细胞脂质代谢、抑制泡沫细胞形成,进而增加动脉粥样硬化斑块稳定性,并进一步探寻其具体分子机制。
1 材料与方法
1.1 实验时间 本实验时间为2020年8月至2021年10月。
1.2 实验材料
1.2.1 实验动物 体质量为25~30 g的6~8周雄性C57BL小鼠10只,购自空军军医大学动物中心;体质量为25~30 g的6~8周雄性ApoE-/-小鼠20只,购自北京维通利华实验动物技术有限公司。所有小鼠饲养于空军军医大学动物中心,SPF级环境,饲养环境温度控制在18~29 ℃,相对湿度控制在40%~70%。构建动脉粥样硬化模型所需要的高脂饲料成分包括15%脂肪、1.25%胆固醇、0.2%胆酸盐。
1.2.2 实验细胞 RAW 264.7巨噬细胞,购自美国ATCC公司。
1.2.3 主要实验试剂与仪器 异鼠李素(批号:MED80003,纯度≥98%)购自湖南康都制药有限公司,ox-LDL购自广州益源生物科技有限公司,SIRT6抗体(货号:#8864S)、GAPDH抗体(货号:#8864S)购自美国CST公司,CD68(1∶100;型号Ab955;Abcam公司),荧光二抗(兔抗鼠,1∶100稀释;Abcam公司),二抗(山羊抗兔)购自西安壮志生物科技有限公司,BODIPY 493/503染料(批号:GC42959,纯度≥98%)购自美国GlpBio公司,小鼠麻醉用异氟烷购自河北一品制药股份有限公司,Bio-Rad凝胶成像系统购自美国伯乐公司,Ad-sh-SIRT6腺病毒购自上海汉恒生物科技有限公司。
1.3 实验方法
1.3.1 动物实验
1.3.1.1 实验动物分组及干预方法 将10只雄性C57BL小鼠作为空白对照组;将20只ApoE-/-小鼠随机分为动脉粥样硬化组和动脉粥样硬化+异鼠李素组,每组10只。参考文献[5],采用高脂饲料喂养动脉粥样硬化组和动脉粥样硬化+异鼠李素组小鼠16周以构建动脉粥样硬化小鼠模型。其中动脉粥样硬化+异鼠李素组小鼠于高脂饲料喂养第9周开始给予异鼠李素,腹腔注射,20 mg•kg-1•d-1,连续给药8周[6]。持续监测各组小鼠血脂指标,16周后用异氟烷麻醉并处死各组小鼠,分离小鼠主动脉,通过油红O染色发现小鼠动脉管腔内形成了动脉粥样硬化斑块,视为造模成功。
1.3.1.2 油红O染色检测小鼠动脉粥样硬化斑块中脂质核心面积百分比 干预16周后,采用异氟烷麻醉并处死各组小鼠,分离小鼠主动脉,取出动脉粥样硬化斑块组织,送病理科进行包埋后制作冰冻切片,取出冰冻切片,置于常温磷酸盐缓冲液(phosphate buffered saline,PBS)中进行复温,干燥10 min后置于新鲜油红O染色液中孵育10~15 min;在75%乙醇溶液中分化2~3 s,清水中洗1 min。将切片放置在Harris苏木素中复染1~2 min,流水下冲洗,使用1%盐酸酒精分化数秒,流水下冲洗,使用氨水返蓝,流水下冲洗;用盖玻片封固后利用显微镜通过Image J软件分析小鼠动脉粥样硬化斑块中脂质核心面积与管腔总横截面积,计算小鼠动脉粥样硬化斑块中脂质核心面积百分比[5]。
1.3.1.3 免疫荧光染色检测小鼠动脉粥样硬化斑块中泡沫细胞所占比例 取动脉粥样硬化斑块组织,置于多聚甲醛中固定,采用石蜡包埋并切片(3~5 mm),抗原修复,山羊血清封闭60 min。加一抗CD68,在4 ℃冰箱中孵育过夜,然后加Flour-Cy3标记的荧光二抗均匀覆盖组织,避光,在湿盒中孵育60 min。PBS轻柔洗涤后用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole dihydrochloride,DAPI)复染细胞核,甘油封固后在激光共聚焦显微镜下观察动脉粥样硬化斑块中CD68(泡沫细胞标志物)阳性细胞所占比例,即泡沫细胞所占比例。
1.3.2 细胞实验
1.3.2.1 细胞培养 将RAW 264.7巨噬细胞置于含15%胎牛血清的细胞培养基,培养环境为消毒灭菌细胞孵箱(37 ℃,含5% CO2,湿度95%),24 h后观察贴壁细胞情况,培养基浑浊后及时更换新鲜培养基。
1.3.2.2 Western blotting法检测巨噬细胞中SIRT6表达水平 取对数生长期的巨噬细胞,将其分为空白对照组(不进行干预)、ox-LDL干预组(采用50 g/ml的ox-LDL干预24 h以体外诱导泡沫细胞形成)、ox-LDL+异鼠李素干预组(采用20 μmol/L的异鼠李素孵育8 h[6],之后采用50 g/ml的ox-LDL干预24 h以体外诱导泡沫细胞形成)。用PBS洗涤各组巨噬细胞并充分消化,提取蛋白后按照操作流程进行聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE),并转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。提前按1∶100配好SIRT6、GAPDH抗体;脱脂奶粉封闭后于4 ℃冰箱中过夜进行一抗孵育,滴加山羊抗兔IgG抗体孵育1 h,采用化学发光法利用Bio-Rad凝胶成像系统检测各组巨噬细胞中SIRT6表达水平。实验独立重复3次。
1.3.2.3 BODIPY 493/503染色检测巨噬细胞中脂滴数目取对数生长期的巨噬细胞,将其分为空白对照组(不进行干预)、ox-LDL组(采用50 g/ml的ox-LDL干预24 h以体外诱导泡沫细胞形成)、ox-LDL+异鼠李素组(采用20 μmol/L 异鼠李素孵育8 h[6],之后采用50 g/ml的ox-LDL干预24 h以体外诱导泡沫细胞形成)、ox-LDL+异鼠李素+Ad-sh-SIRT6组〔采用20 μmol/L异鼠李素孵育8 h[6],转染Ad-sh-SIRT6腺病毒以干扰SIRT6的表达,病毒感染复数(multiplicity of infection,MOI)值是100∶1,12 h后用50 g/ml的ox-LDL干预24 h以体外模拟动脉粥样硬化状态〕。室温下用提前配置好的10 μg/ml BODIPY 493/503染料对各组巨噬细胞进行染色,1 h后在激光共聚焦显微镜下观察巨噬细胞中脂滴数目。实验独立重复3次。
1.4 统计学方法 采用Graphpad Prism 5.01进行统计分析。计量资料以(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 空白对照组、动脉粥样硬化组、动脉粥样硬化+异鼠李素组小鼠动脉粥样硬化斑块中脂质核心面积百分比比较 空白对照组小鼠动脉粥样硬化斑块中脂质核心面积百分比为0。动脉粥样硬化+异鼠李素组小鼠动脉粥样硬化斑块中脂质核心面积百分比为(20.3±1.8)%,低于动脉粥样硬化组的(40.1±2.7)%,差异有统计学意义(t=19.30,P<0.001),见图1。
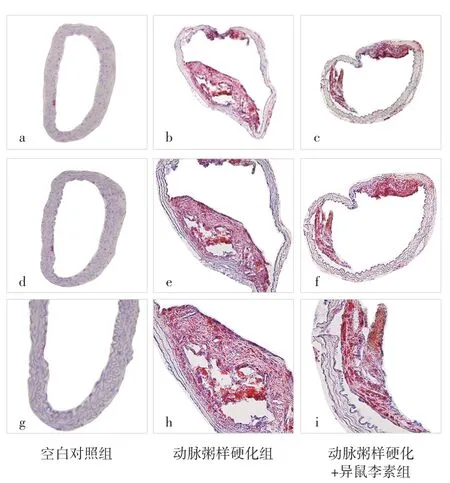
图1 油红O染色检测空白对照组、动脉粥样硬化组、动脉粥样硬化+异鼠李素组小鼠动脉粥样硬化斑块中脂质核心面积百分比Figure 1 Percentage of lipid core area detected by oil red O staining in atherosclerotic plaque of blank control group,atherosclerosis group and atherosclerosis+isorhamnetin group
2.2 空白对照组、动脉粥样硬化组、动脉粥样硬化+异鼠李素组小鼠动脉粥样硬化斑块中泡沫细胞所占比例比较 空白对照组、动脉粥样硬化组、动脉粥样硬化+异鼠李素组小鼠动脉粥样硬化斑块中泡沫细胞所占比例分别为0、(9.31±0.08)%、(4.04±0.38)%。动脉粥样硬化组小鼠动脉粥样硬化斑块中泡沫细胞所占比例高于动脉粥样硬化+异鼠李素组,差异有统计学意义(t=42.92,P<0.001),见图2。

图2 免疫荧光染色检测空白对照组、动脉粥样硬化组、动脉粥样硬化+异鼠李素组小鼠动脉粥样硬化斑块中泡沫细胞所占比例Figure 2 Proportion of foam cells in atherosclerotic plaques of mice detected by immunofluorescence staining in blank control group,atherosclerosis group and atherosclerosis+isorhamnetin group
2.3 空白对照组、ox-LDL干预组、ox-LDL+异鼠李素干预组巨噬细胞中SIRT6表达水平比较 空白对照组、ox-LDL干预组、ox-LDL+异鼠李素干预组巨噬细胞中SIRT6表达水平分别为(1.00±0)、(0.31±0.07)、(0.61±0.06)。空白对照组、ox-LDL干预组、ox-LDL+异鼠李素干预组巨噬细胞中SIRT6表达水平比较,差异有统计学意义(F=326.50,P<0.001);ox-LDL干预组、ox-LDL+异鼠李素干预组巨噬细胞中SIRT6表达水平低于空白对照组,差异有统计学意义(t值分别为25.36、15.79,P值均<0.001);ox-LDL+异鼠李素干预组巨噬细胞中SIRT6表达水平高于ox-LDL干预组,差异有统计学意义(t=10.29,P<0.001),见图3。
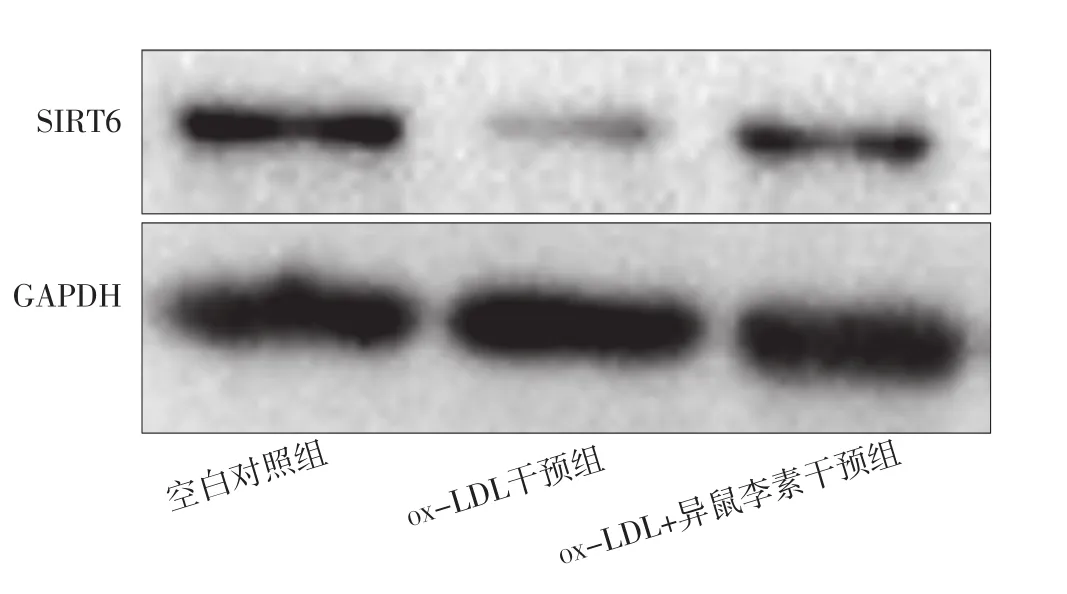
图3 Western blotting法检测空白对照组、ox-LDL干预组、ox-LDL+异鼠李素干预组巨噬细胞中SIRT6表达水平的SDS-PAGE图Figure 3 SDS-PAGE graph of SIRT6 expression level in macrophages detected by Western blotting method in blank control group,ox-LDL intervention group and ox-LDL+isorhamnetin intervention group
2.4 空白对照组、ox-LDL组、ox-LDL+异鼠李素组、ox-LDL+异鼠李素+Ad-sh-SIRT6组巨噬细胞中脂滴数目比较 空白对照组、ox-LDL组、ox-LDL+异鼠李素组、ox-LDL+异鼠李素+Ad-sh-SIRT6组巨噬细胞中脂滴数目分别为(3.00±0.27)、(18.00±1.61)、(9.00±0.80)、(35.00±3.13)。四组巨噬细胞中脂滴数目比较,差异有统计学意义(F=593.00,P<0.001);ox-LDL组、ox-LDL+异鼠李素组、ox-LDL+异鼠李素+Ad-sh-SIRT6组巨噬细胞中脂滴数目多于空白对照组,差异有统计学意义(t值分别为29.06、22.47、32.21,P值均<0.001);ox-LDL+异鼠李素组巨噬细胞中脂滴数目少于ox-LDL组,差异有统计学意义(t=15.83,P<0.001);ox-LDL+异鼠李素+Ad-sh-SIRT6组巨噬细胞中脂滴数目多于ox-LDL组、ox-LDL+异鼠李素组,差异有统计学意义(t值分别为15.27、25.45,P值均<0.001),见图4。
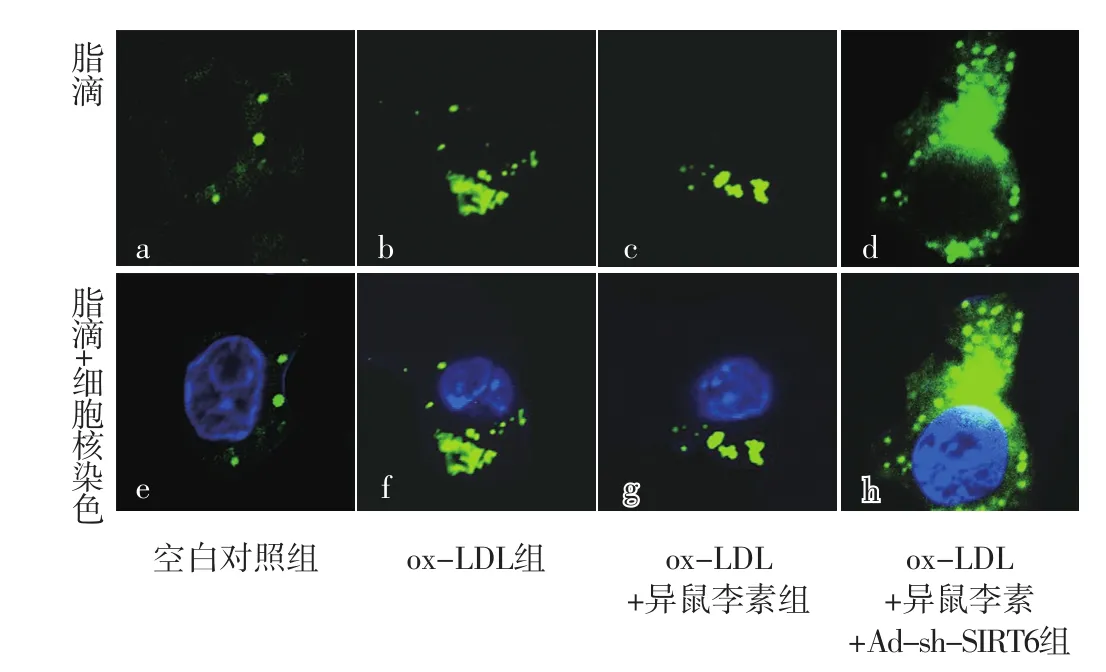
图4 BODIPY 493/503染色检测空白对照组、ox-LDL组、ox-LDL+异鼠李素组、ox-LDL+异鼠李素+Ad-sh-SIRT6组巨噬细胞中脂滴数目(×60)Figure 4 The number of lipid droplets in macrophages detected by BODIPY 493/503 staining in blank control group,ox-LDL group,ox-LDL+isorhamnetin group,ox-LDL+isorhamnetin+Ad-sh-SIRT6 group
3 讨论
研究发现,急性和持续性心肌缺血导致的突然血流中断会导致急性心肌梗死和恶性心律失常的发生[1]。尸检数据表明,心源性猝死的大多数罪犯血管在造影检查中均发现有40%~69%的管腔狭窄[7]。几十年来,学者普遍认为,易损斑块是导致急性冠脉综合征的罪魁祸首[8],其中纤维帽变薄在易损斑块的形成中扮演了重要角色。斑块中浸润的巨噬细胞能够分泌蛋白水解酶,进而降解富含胶原的纤维帽基质,最后导致纤维帽变薄。尸检结果发现,破裂的纤维帽通常被巨噬细胞衍生的泡沫细胞所浸润[9-10]。而泡沫细胞的形成会促进炎症反应,导致斑块中坏死核心的形成,最终导致斑块不稳定[11]。泡沫细胞是通过哺乳动物巨噬细胞中脂质代谢失调形成的:当脂质积累超过巨噬细胞的平衡能力时会触发脂滴的形成,从而导致这些巨噬细胞呈泡沫状[2]。脂滴是所有细胞中三酰甘油和胆固醇酯被单层膜包裹从而储存脂质的细胞器,几乎存在于每种细胞类型中,如肝细胞、神经元、胶质细胞、巨噬细胞、树突状细胞和淋巴母细胞[12-13]。近年研究表明,脂滴作为一种特殊的细胞器,促进了泡沫细胞的形成,并且在动脉粥样硬化病程进展中发挥重要作用。因此,减少巨噬细胞中脂滴形成,抑制泡沫细胞浸润,对增加动脉粥样硬化斑块稳定性至关重要。为此,本研究在前期研究[1-4]基础上,通过高脂饮食和ox-LDL干预分别构建动脉粥样硬化动物模型和细胞模型,探索异鼠李素是否可以通过改善巨噬细胞脂质代谢、抑制泡沫细胞形成,进而增加动脉粥样硬化斑块稳定性,并进一步探寻其具体分子机制。
异鼠李素作为沙棘属植物沙棘果实的主要提取物,富含多种活性物质,如黄酮类、维生素类、类胡萝卜素等[14]。研究表明,异鼠李素可减弱ox-LDL对内皮细胞的损伤、抑制脂质堆积、抑制血管平滑肌细胞增殖与迁移,从而延缓或抑制动脉粥样硬化病情进展[15]。上述研究表明异鼠李素参与了动脉粥样硬化斑块的病程进展,但其能否调控巨噬细胞中的脂质代谢,抑制脂滴在巨噬细胞中的聚集及其具体的分子机制,目前研究甚少。本研究结果显示,动脉粥样硬化+异鼠李素组小鼠动脉粥样硬化斑块中脂质核心面积百分比、泡沫细胞所占比例低于动脉粥样硬化组,提示异鼠李素能够明显缩小和减少ApoE-/-小鼠动脉粥样硬化斑块中的脂质核心面积和泡沫细胞。SIRT6作为哺乳动物Sirtuin家族的重要成员之一,主要定位在细胞质中,具有烟酰胺腺嘌呤二核苷酸依赖的去乙酰化酶活性,通过在组蛋白H3上第9位赖氨酸和第56位赖氨酸脱乙酰基发挥作用,通过调控脂质代谢参与心血管疾病的病情进展[16]。研究发现,SIRT6能调控三酰甘油的合成和脂质代谢,在小鼠肝细胞中敲除SIRT6可以增加三酰甘油的合成,导致三酰甘油在肝细胞中过度积累,最终导致脂肪肝或肝脂肪变性[17]。既往研究表明,糖尿病患者颈动脉粥样硬化斑块形成与SIRT6表达水平下降密切相关,其机制可能是由于SIRT6的表达降低导致斑块中炎症反应增强、胶原含量降低,斑块的易损性增加[18]。本研究结果显示,ox-LDL干预组、ox-LDL+异鼠李素干预组巨噬细胞中SIRT6表达水平低于空白对照组,ox-LDL+异鼠李素干预组巨噬细胞中SIRT6表达水平高于ox-LDL干预组,表明异鼠李素能够提升ox-LDL干预的巨噬细胞中SIRT6表达水平。ox-LDL组、ox-LDL+异鼠李素组、ox-LDL+异鼠李素+Ad-sh-SIRT6组巨噬细胞中脂滴数目多于空白对照组,ox-LDL+异鼠李素组巨噬细胞中脂滴数目少于ox-LDL组,ox-LDL+异鼠李素+Ad-sh-SIRT6组巨噬细胞中脂滴数目多于ox-LDL组、ox-LDL+异鼠李素组,提示下调SIRT6表达水平后异鼠李素抑制巨噬细胞中脂滴聚集的作用被减弱。由此本研究组认为,异鼠李素在动脉粥样硬化斑块的病程进展中发挥的保护作用主要体现在:缩小ApoE-/-小鼠动脉粥样硬化斑块中的脂质核心面积,减少巨噬细胞演变的泡沫细胞在动脉粥样硬化斑块中的聚集,从而增加动脉粥样硬化斑块稳定性,而这些作用的发挥是依靠上调SIRT6表达水平来实现的,而下调SIRT6表达水平后巨噬细胞中聚集了大量脂滴,在一定程度上加剧了巨噬细胞中的脂质代谢紊乱,促进了泡沫细胞的形成。
本研究尚存在一定局限性:首先,影响动脉粥样硬化斑块形成及其稳定性的因素是多方面的,异鼠李素是否通过影响内皮细胞来源的外泌体,即通过旁分泌途径减少单核细胞在内皮细胞表面的黏附而减少泡沫细胞形成;此外,异鼠李素是否可通过促进线粒体融合而促进脂滴的代谢,从而改善巨噬细胞中的脂质代谢紊乱,减少泡沫细胞形成,这些具体分子调控机制尚不明确,还需要后期进一步验证。
综上所述,异鼠李素通过上调SIRT6表达水平,减少巨噬细胞中脂滴数目,抑制动脉粥样硬化斑块中泡沫细胞形成,缩小动脉粥样硬化斑块中脂质核心面积,进而增加动脉粥样硬化斑块稳定性。本研究为异鼠李素在冠心病患者中的应用提供了实验依据,为减少急性心肌梗死的发生提供了新的中医药治疗方案。
作者贡献:王婷婷、张东伟进行研究的构思与设计、可行性分析及文章的撰写,负责文章的质量控制及审校,对文章整体负责、监督管理;王婷婷、李妍负责文章修订;张明明负责结果分析;蒋国健负责文献资料收集;郭文怡负责图片整理。
本文无利益冲突。

