纳美芬联合功能性电刺激治疗急性缺血性脑卒中的临床疗效及安全性研究
马勋,雍志军
急性缺血性脑卒中是脑部血管狭窄堵塞造成急性血液循环障碍,患者多伴有认知功能、神经功能及肢体运动功能障碍。研究数据表明,急性缺血性脑卒中每年造成100多万人死亡[1]。该病患者预后较差,多数会出现偏瘫、失语及认知障碍等后遗症,严重影响其生活质量。纳美芬是一种新型阿片类受体拮抗剂,能竞争性阻断内源性阿片肽与受体结合,避免继发性脑损伤[2]。已有多个研究证实,纳美芬易透过血-脑脊液屏障,进而与中枢神经的阿片受体结合,可有效阻断内源性阿片肽(脑啡肽、强啡肽、内啡肽等)对中枢神经的抑制作用,最终起到抑制脑水肿的作用[3]。功能性电刺激属于低频电刺激,利用电刺激作用于支配肌肉的神经,诱发肌肉收缩,从而诱发或模拟肌肉的自主运动,是针对脑卒中后肢体运动障碍患者的常见治疗方案[4]。目前尚未见关于纳美芬联合功能性电刺激治疗急性缺血性脑卒中有效性及安全性的研究。本研究旨在分析纳美芬联合功能性电刺激治疗急性缺血性脑卒中的临床疗效及安全性,以期为急性缺血性脑卒中患者的临床治疗提供理论基础。
1 对象与方法
1.1 研究对象 选取2018年6月至2020年6月陕西省人民医院收治的急性缺血性脑卒中患者102例为研究对象。纳入标准:(1)在发病6 h内入院治疗;(2)符合《中国急性缺血性脑卒中诊治指南2014》[5]中急性缺血性脑卒中的诊断标准,并经CT或MRI检查确诊;(3)初次发生脑卒中;(4)年龄40~70岁。排除标准:(1)合并严重心肝肾、感染性或免疫系统疾病者;(2)患有颅脑创伤或肿瘤者;(3)有严重认知障碍者;(4)患有严重精神疾病,不配合治疗者。采用Mininize分层随机软件将患者分为联合治疗组(n=51)和对照组(n=51)。联合治疗组中男27例,女24例;年龄40~70岁,平均(60.3±10.4)岁;病程(4.0±1.2)h。对照组中男26例,女25例;年龄42~70岁,平均(60.9±9.9)岁;病程(4.0±1.3)h。两组患者性别(χ2=0.039,P=0.843)、年龄(t=0.685,P=0.521)、病程(t=0.931,P=0.443)比较,差异无统计学意义。本研究经陕西省人民医院伦理委员会批准,且患者或家属均签署了知情同意书。
1.2 治疗方法 所有患者入院后按照《中国急性缺血性脑卒中诊治指南2014》[5]要求给予抗血小板聚集、抗凝、降血压等常规治疗,并给予相应的营养支持。联合治疗组患者在常规治疗的基础上采用盐酸纳美芬(成都天台山制药有限公司生产,批准文号:国药准字H20080645)治疗,起始剂量为0.5 mg/70 kg,后改为0.2 mg混合0.9%氯化钠注射液100 ml进行静脉滴注;同时采用功能性电刺激(采用日本KR7型双通道FES治疗仪)治疗,在患者腓总神经出口放置阴极,并在胫前肌肌腹放置阳极,根据患者最大耐受程度调整刺激强度,30 min/次,1次/d。对照组患者在常规治疗的基础上采用与纳美芬剂量相同的0.9%氯化钠注射液及功能性电刺激治疗,治疗方法同联合治疗组。此外,两组患者同时进行运动疗法,包括侧翻身练习,腕关节及踝关节背伸牵张锻炼,坐站、步行、平衡锻炼,30 min/d。两组患者均治疗2周。
1.3 观察指标 (1)美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分、格拉斯哥昏迷量表(Glasgow Coma Scale,GCS)评分。分别于治疗前及治疗后采用NIHSS和GCS评估患者神经功能缺损程度,其中NIHSS总分42分,得分越高表示神经功能缺损越严重;GCS总分15分,得分越低表示神经功能缺损越严重[6]。(2)Barthel指数、Fugl-Meyer运动功能评定量表评分。分别于治疗前及治疗后采用Barthel指数、Fugl-Meyer运动功能评定量表评估患者日常生活活动能力和肢体运动功能,其中Barthel指数总分100分,Fugl-Meyer运动功能评定量表总分100分,得分越高表示患者日常生活活动能力和肢体运动功能越好[7]。(3)大脑中动脉(middle cerebral artery,MCA)血流动力学指标。分别于治疗前及治疗后采用颅脑超声(德国西门子,X300 Premium型)检测两组患者MCA的血流动力学指标,包括平均血流速度、搏动指数(pulsatility index,PI)、阻力指数(resistance index,RI)。(4)血清强啡肽A(1-13)、β-内啡肽(β-endorphins,β-EP)、D-二聚体。分别于治疗前及治疗后抽取患者清晨空腹静脉血5 ml,3 000 r/min离心10 min(离心半径10 cm),提取血清,采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测强啡肽A(1-13)、β-EP、D-二聚体;ELISA试剂盒购自泉州市九邦生物科技有限公司,严格按照试剂盒说明书进行操作。(5)不良反应发生率。比较两组患者治疗期间不良反应发生情况,包括呼吸异常、心律失常、肝功能异常、胃肠道反应等。
1.4 统计学方法 采用Microsoft Office Excel 2016软件进行数据整理,并采用SPSS 23.0软件进行数据分析。符合正态分布的计量资料以(±s)表示,组间比较采用两独立样本t检验,组内比较采用配对t检验;计数资料以相对数表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后NIHSS评分、GCS评分比较 两组患者治疗前NIHSS评分、GCS评分比较,差异无统计学意义(P>0.05);联合治疗组患者治疗后NIHSS评分低于对照组,GCS评分高于对照组,差异有统计学意义(P<0.05)。对照组、联合治疗组患者治疗后NIHSS评分分别低于本组治疗前,GCS评分分别高于本组治疗前,差异有统计学意义(P<0.05),见表1。
表1 对照组与联合治疗组患者治疗前后NIHSS评分、GCS评分比较(±s,分)Table 1 Comparison of NIHSS score and GCS score between the control group and the combined treatment group before and after treatment
注:NIHSS=美国国立卫生研究院卒中量表,GCS=格拉斯哥昏迷量表;a表示与本组治疗前比较,P<0.05
组别 例数 N I H S S评分 G C S评分治疗前 治疗后 治疗前 治疗后对照组 5 1 2 0.2±4.6 1 4.8±3.3 a 7.6±1.4 9.5±2.6 a联合治疗组 5 1 1 9.9±3.9 1 0.6±2.5 a 8.0±2.0 1 3.3±2.6 a t值 1.8 8 6 9.5 8 1 -0.7 5 9 -8.5 9 4 P值 0.0 8 1 <0.0 0 1 0.5 0 6 <0.0 0 1
2.2 两组患者治疗前后Barthel指数、Fugl-Meyer运动功能评定量表评分比较 两组患者治疗前Barthel指数、Fugl-Meyer运动功能评定量表评分比较,差异无统计学意义(P>0.05);联合治疗组患者治疗后Barthel指数、Fugl-Meyer运动功能评定量表评分高于对照组,差异有统计学意义(P<0.05)。对照组、联合治疗组患者治疗后Barthel指数、Fugl-Meyer运动功能评定量表评分分别高于本组治疗前,差异有统计学意义(P<0.05),见表2。
表2 对照组与联合治疗组患者治疗前后Barthel指数、Fugl-Meyer运动功能评定量表评分比较(±s,分)Table 2 Comparison of Barthel index and Fugl-Meyer Motor Assessment Scale scores between the control group and the combined treatment group before and after treatment
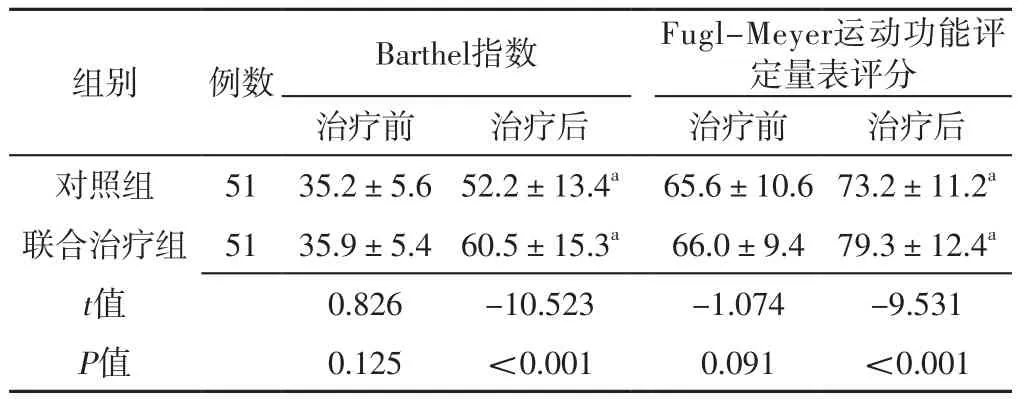
表2 对照组与联合治疗组患者治疗前后Barthel指数、Fugl-Meyer运动功能评定量表评分比较(±s,分)Table 2 Comparison of Barthel index and Fugl-Meyer Motor Assessment Scale scores between the control group and the combined treatment group before and after treatment
注:a表示与本组治疗前比较,P<0.05
组别 例数 Barthel指数 Fugl-Meyer运动功能评定量表评分治疗前 治疗后 治疗前 治疗后对照组 51 35.2±5.6 52.2±13.4a 65.6±10.6 73.2±11.2a联合治疗组 51 35.9±5.4 60.5±15.3a 66.0±9.4 79.3±12.4a t值 0.826 -10.523 -1.074 -9.531 P值 0.125 <0.001 0.091 <0.001
2.3 两组患者治疗前后MCA血流动力学指标比较 两组患者治疗前MCA平均血流速度、PI、RI比较,差异无统计学意义(P>0.05);联合治疗组患者治疗后MCA平均血流速度快于对照组,MCA PI、RI低于对照组,差异有统计学意义(P<0.05)。对照组、联合治疗组患者治疗后MCA平均血流速度分别快于本组治疗前,MCA PI、RI分别低于本组治疗前,差异有统计学意义(P<0.05),见表3。
表3 对照组与联合治疗组患者治疗前后MCA血流动力学指标比较(±s)Table 3 Comparison of hemodynamic indexes of middle cerebral artery between the control group and the combined treatment group before and after treatment
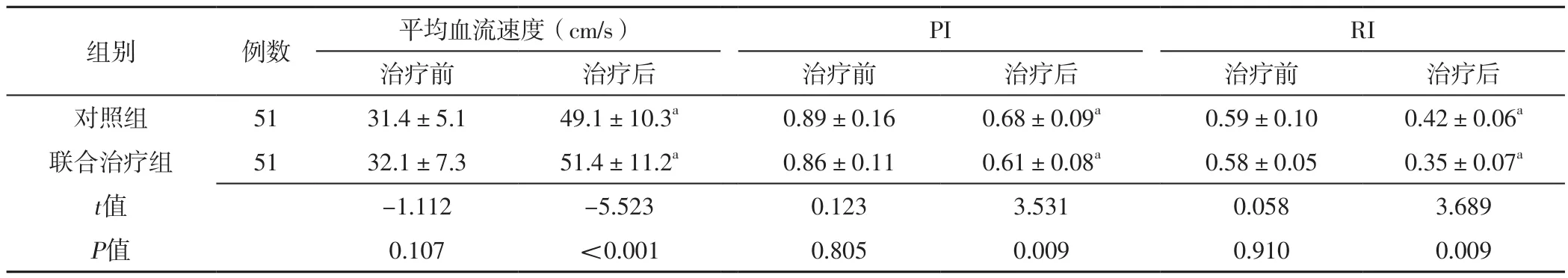
表3 对照组与联合治疗组患者治疗前后MCA血流动力学指标比较(±s)Table 3 Comparison of hemodynamic indexes of middle cerebral artery between the control group and the combined treatment group before and after treatment
注:PI=搏动指数,RI=阻力指数;a表示与本组治疗前比较,P<0.05
组别 例数 平均血流速度(cm/s) PI RI治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 51 31.4±5.1 49.1±10.3a 0.89±0.16 0.68±0.09a 0.59±0.10 0.42±0.06a联合治疗组 51 32.1±7.3 51.4±11.2a 0.86±0.11 0.61±0.08a 0.58±0.05 0.35±0.07a t值 -1.112 -5.523 0.123 3.531 0.058 3.689 P值 0.107 <0.001 0.805 0.009 0.910 0.009
2.4 两组患者治疗前后血清强啡肽A(1-13)、β-EP、D-二聚体比较 两组患者治疗前血清强啡肽A(1-13)、β-EP、D-二聚体比较,差异无统计学意义(P>0.05);联合治疗组患者治疗后血清强啡肽A(1-13)、β-EP、D-二聚体低于对照组,差异有统计学意义(P<0.05)。对照组、联合治疗组患者治疗后血清强啡肽A(1-13)、β-EP、D-二聚体分别低于本组治疗前,差异有统计学意义(P<0.05),见表4。
表4 对照组与联合治疗组患者治疗前后血清强啡肽A(1-13)、β-EP、D-二聚体比较(±s)Table 4 Comparison of serum enkephalin A(1-13),β-EP and D-dimer between the control group and the combined treatment group before and after treatment

表4 对照组与联合治疗组患者治疗前后血清强啡肽A(1-13)、β-EP、D-二聚体比较(±s)Table 4 Comparison of serum enkephalin A(1-13),β-EP and D-dimer between the control group and the combined treatment group before and after treatment
注:β-EP=β-内啡肽;a表示与本组治疗前比较,P<0.05
组别 例数 强啡肽A(1-13)(ng/L) β-EP(ng/L) D-二聚体(mg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 51 189.8±28.7 141.6±11.5a 221.9±31.4 164.8±29.6a 3.78±0.65 1.01±0.32a联合治疗组 51 187.4±27.4 127.1±13.2a 219.6±29.8 148.6±25.1a 3.52±0.53 0.67±0.21a t值 1.854 6.587 0.123 10.274 0.135 4.689 P值 0.058 <0.001 0.805 <0.001 0.610 0.003
2.5 两组患者不良反应发生率比较 对照组患者中,发生呼吸异常2例、心律失常2例,不良反应发生率为7.8%(4/51);联合治疗组患者中,发生呼吸异常3例、胃肠道反应2例、肝功能异常1例、心律失常1例,不良反应发生率为13.7%(7/51)。两组患者不良反应发生率比较,差异无统计学意义(χ2=1.511,P=0.219)。
3 讨论
急性脑卒中是急性发病并迅速出现脑功能缺失征象的脑血管事件,是中老年常见的神经系统疾病,可对脑组织及功能产生较大损伤,患者发病后多伴有神经系统损伤、认知障碍及肢体偏瘫等严重后遗症[8]。80%的脑卒中患者为缺血性脑卒中,目前临床上的治疗方案主要有溶栓治疗、使用神经保护剂或采用阿司匹林改善预后等[9]。纳美芬是缺血性脑卒中的新型治疗药物,是高选择性的阿片类受体拮抗剂,其能顺利透过血-脑脊液屏障,与中枢神经系统的阿片受体结合,竞争性阻断内源性阿片肽与受体结合,减少细胞炎性因子的释放,抑制炎性反应。功能性电刺激是缺血性脑卒中后肢体运动功能障碍的常见治疗方案,其是利用低频脉冲电流,设定程序后作用于特定肌肉,以补偿丧失的肢体运动功能[10]。另外,功能性电刺激传入神经最终可投射到大脑皮质高级中枢,能够促进大脑皮质功能重组[11]。本研究旨在分析纳美芬联合功能性电刺激治疗急性缺血性脑卒中的临床疗效及安全性。
研究表明,功能性电刺激能够改善脑卒中患者肢体运动功能[12]。KOTTINK等[13]研究发现,采用功能性电刺激腓骨可以明显改善伴有足下垂的脑卒中患者的步行速度。同时,纳美芬能提高细胞线粒体功能,改善神经元能量代谢。另外,纳美芬能抑制脑啡肽的合成和释放,抑制血管收缩,改善微循环[14]。孙嫄等[15]研究发现,纳美芬能明显改善急性脑卒中伴意识障碍患者的血流动力学,并降低强啡肽表达,可以作为急性脑卒中患者的临床治疗药物。本研究分别采用功能性电刺激及纳美芬联合功能性电刺激治疗急性缺血性脑卒中患者,结果显示,联合治疗组患者治疗后NIHSS评分及MCA PI、RI低于对照组,GCS评分、Barthel指数、Fugl-Meyer运动功能评定量表评分高于对照组,MCA平均血流速度快于对照组;对照组、联合治疗组患者治疗后NIHSS评分及MCA PI、RI分别低于本组治疗前,GCS评分、Barthel指数、Fugl-Meyer运动功能评定量表评分分别高于本组治疗前,MCA平均血流速度分别快于本组治疗前;表明与单纯功能性电刺激相比,纳美芬联合功能性电刺激可以更有效地减轻急性缺血性脑卒中患者的神经功能缺损程度,改善患者日常生活活动能力、肢体运动功能、血流动力学指标。
β-EP和强啡肽A(1-13)是内源性阿片肽,可参与中枢神经系统的继发性损伤,其血清水平也与脑卒中病情有明显相关性[16]。D-二聚体是交联纤维的一种特异性降解产物,在急性缺血性脑卒中的发生发展中起重要作用,急性缺血性脑卒中患者体内纤溶和凝血功能失调,形成血栓,导致D-二聚体水平明显升高[17]。查海锋等[18]采用盐酸纳美芬联合电针刺激治疗急性脑损伤患者,结果显示,联合治疗能明显提升急性脑损伤患者的临床疗效,降低强啡肽、β-EP水平,改善血清炎性因子水平,有利于患者的恢复。本研究结果与之类似,联合治疗组患者治疗后血清强啡肽A(1-13)、β-EP、D-二聚体低于对照组,提示联合治疗组患者内源性阿片肽降低更明显,也侧面反映出纳美芬联合功能性电刺激更能缓解急性缺血性脑卒中患者的中枢神经系统损伤。
此外,本研究结果显示,两组患者不良反应发生率比较,差异无统计学意义,说明纳美芬联合功能性电刺激安全性良好,可用于急性缺血性脑卒中患者的临床治疗。但本研究样本量较小,且为单中心研究,后期需进一步扩大样本量,并进行长期随访,以探讨纳美芬联合功能性电刺激对急性缺血性脑卒中患者预后的影响。
综上所述,纳美芬联合功能性电刺激能有效改善急性缺血性脑卒中患者的神经功能、日常生活活动能力、肢体运动功能、血流动力学指标,降低血清强啡肽A(1-13)、β-EP、D-二聚体,且安全性良好,可用于急性缺血性脑卒中患者的临床治疗。
作者贡献:马勋进行文章的构思与设计,文章的可行性分析,文献收集、整理,文章的撰写以及统计学分析;雍志军进行论文的修订,文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。

