急性脑梗死患者血清小凹蛋白-1水平的变化及意义
李才明 陈礼锟 孔令恩 张停亭 庄顺芝 邱志维 黄爱郑
(1.惠州市第一人民医院神经内科,广东 惠州 516003;2.东莞东华医院神经内科,广东 东莞 52300)
Caveolae是1953年由美国生物学家在电子显微镜观内皮细胞下被发现的一种小窝结构,主要由脂类和蛋白质组成,其胞质面由一层膜外衣覆盖[1]。小凹蛋白(Cav)主要成分有三种,分别为Cav-1,Cav-2和Cav-3。目前认为,Cav-1主要发挥着生物学作用。Cav-1是胞膜上的一种整合膜蛋白,在保持Caveolae的完整性、胆固醇转运、小胞的运输、信号的传导中起一定的作用[2]。Cav-1的生物学作用多样,在细胞外基质、血管内皮细胞、神经元、神经胶质细胞、血管平滑肌等方面都有其相关作用机制,通过cAMP-PKA、TrkB、PKC等多条途径,调控基质金属蛋白(MMPs)、紧密连接蛋白等物质的表达,在维持血脑屏障完整性、侧枝形成、调控动脉粥样硬化、神经修复等方面发挥作用[3]。本研究观察了脑梗死患者急性期Cav-1水平变化及与脑梗死相关因子的关系,探索其临床意义,为脑梗死的预防和治疗提供理论依据。
1 资料与方法
1.1 一般资料 选取2017年1月至9月本院神经内科收治的急性脑梗死病人39例(脑梗死组)和39例同期健康体检者(对照组),脑梗死组男19例,女20例,平均年龄(66.89±11.38)岁。对照组男20例,女19例,平均年龄(64.87±8.82)岁。两组年龄、性别相比差异均无统计学意义(P>0.05)。所有急性脑梗死患者均在发病7d内入院,均未进行阿替普酶或尿激酶溶栓治疗,也无出血转化。39例脑梗死患者中,根据NIHSS评分,轻型35例,中型3例,重型1例,NIHSS评分中位数为3分。入选标准:(1)按照《中国急性缺血性脑卒中诊治指南2018》中脑梗死的诊断标准,均经头颅CT和(或)MRI扫描证实;(2)发病时间≤7d;(3)首次发病;(4)年龄18~80岁。排除标准:既往有肿瘤、脑梗死、心肌梗死、头颅外伤、严重肝肾疾病史或其他严重的急慢性疾病者。所有入选患者均对本研究知情同意,医院伦理委员会讨论通过,符合伦理原则。
1.2 方法 两组患者均在入院后第1d清晨空腹抽取静脉血清标本。所有标本使用肝素钠抗凝,在室温下3000 r/min离心10min后分离血清,血清转移至EP管,置于低温冰箱-40℃储存。血清Cav-1检测试剂盒为Human Caveolin-1 ELISA kit(英国abbexa公司,型号abx571954),使用美国宝特ELX-800生产的酶标仪参照Human Caveolin-1 ELISA试剂盒说明书进行检测。同型半胱氨酸(Hcy)、总 胆 固 醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、载脂蛋白A1(APOA1)和载脂蛋白B(APOB)、空腹血糖(FBS)、尿素氮(BUN)、肌酐(Cr)、尿酸(UA)和前白蛋白(PA)的水平由我院检验科生化中心使用德国罗氏Cobas全自动生化仪检测。糖化血红蛋白(HbA1C)由我院检验科生化中心使用深圳普门H9全自动糖化血红蛋白测试仪检测。
所有入选急性脑梗死患者入院后第1d采用NIHSS评分评估患者神经功能缺损程度,该量表包括视野、凝视、意识水平、运动、感觉、共济失调、面瘫、构音障碍、语言及忽视症等11项条目,分值0~45分,得分越高表示神经功能缺损越严重。轻型:NIHSS评分4~7分;中型:NIHSS评分8~15分;重型:NIHSS评分>15分。在评估NIHSS评分时,需经两名专业的神经内科医师完成,保证测评结果的准确性。
1.3 统计学方法 采用SPSS 26.0软件分析,结果用(x±s)表示,不同发病日的组间Cav-1差异比较采用配对t检验,组间多重两两对比采用LSD法,采用Logistic线性回归模型分析Cav-1与NIHSS评分、生化指标的关系,取(P<0.05)为差异有统计学意义。
2 结果
2.1 脑梗死组与对照组血清Cav-1水平、生化指标比较 与对照组相比,脑梗死组Cav-1水平明显降低,差异有显著统计学意义(P<0.01);脑梗死组和对照组的Hcy、FBS、HbA1C、TC、TG、LDL、HDL、apoA、apoB、BUN、Cr、UA、PA水平无显著性差异(P>0.05)。见表1
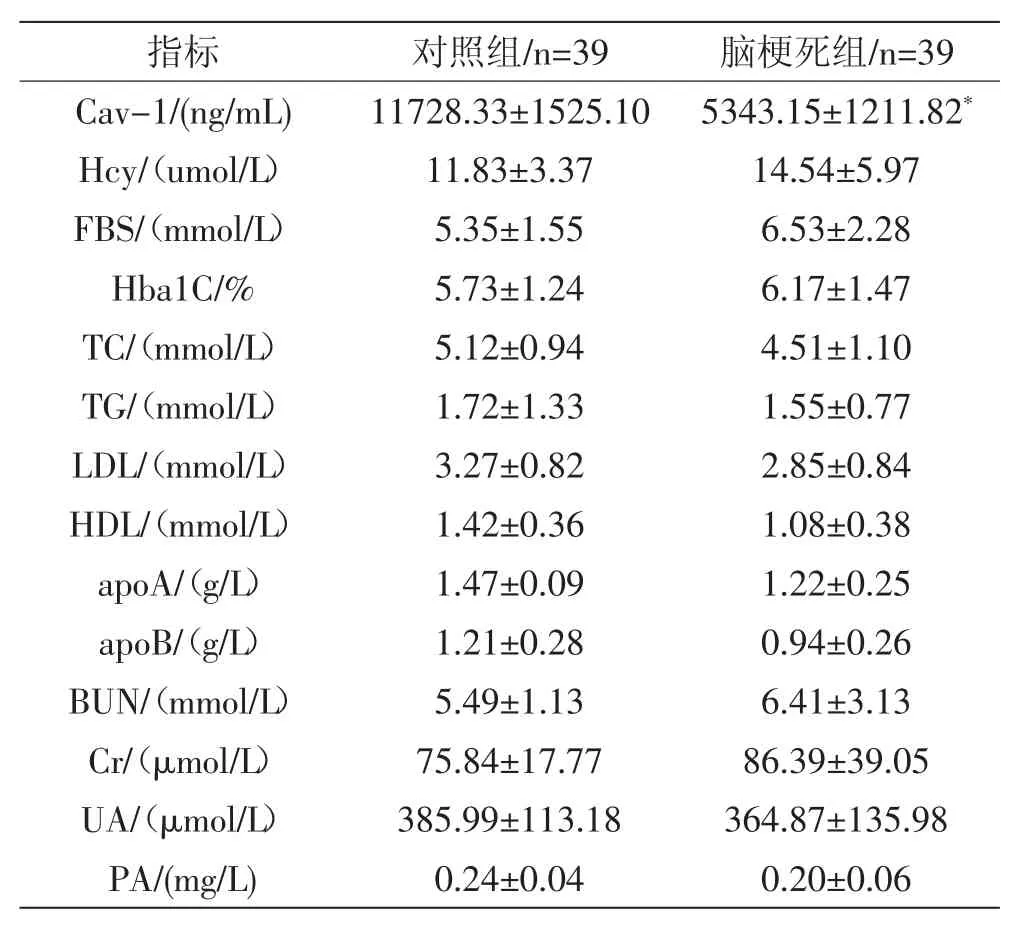
注:*P<0.01
2.2 血清Cav-1水平与NIHSS评分、生化指标的关系 将脑梗死组血清Cav-1水平与NIHSS评分、Hcy、FBS、HbA1C、TC、TG、LDL、HDL、apoA、apoB、BUN、Cr、UA水平进行Logistic回归分析。结果提示,脑梗死组血清Cav-1水平与NIHSS评分、Hcy、FBS、HbA1C、TC、TG、LDL、HDL、apoA、apoB、BUN、Cr、UA、PA均 无 明显相关(P>0.05)。
3 讨论
Cav-1目前在脑血管病中的作用机制尚不十分明确。研究表明,Cav-1在血脑屏障、神经炎性反应、动脉粥样硬化等方面发挥生物学作用[4]。近年的临床及动物研究表明,Cav-1可能是脑血管病的一种保护性因素[5]。本研究发现脑梗死组的血清Cav-1水平显著低于对照组,推测血清低水平Cav-1可能是脑梗死发病的一个危险因素;但不排除患者发生脑梗死后,体内Cav-1的水平下降导致的差异,其因果关系需进一步研究明确。
Castellanos等[6]对133名行溶栓治疗的脑梗死患者的研究表明,Cav-1水平在出血转化组及1型脑血肿转化组均与非出血组无显著性差异,且三组患者Cav-1水平均高于非卒中组;而2型血肿转化组及症状性出血组(sIHT)则显著低于非出血组。表明血清低Cav-1水平可能与阿替普酶溶栓后的严重出血转化及神经功能恶化相关。有研究发现,脑梗死后发生血清中低Cav-1水平患者,其脑微出血的风险是高Cav-1水平者的3倍,血清低Cav-1水平可能与脑梗死早期神经功能恶化相关[7]。在动物实验方面,通过基因敲除、病毒转染等方式,使Cav-1基因沉默或过度表达,随后构建大脑中动脉栓塞模型(MCAO)。结果表明,Cav-1敲除的小鼠神经功能恶化、脑梗死面积等方面显著比对照组小鼠严重,而Cav-1过量表达的小鼠则神经损伤的程度较对照组小鼠减轻[8]。本研究表明,脑梗死患者Cav-1水平低于对照组,但其变化与NIHSS评分无明显相关性,提示Cav-1水平与病情严重程度可能无关。
既往研究发现,血清前白蛋白水平升高可能是青年型脑梗死发病的一种保护因素。但本研究表明,脑梗死患者血清Cav-1水平与Hcy水平、血糖(FBS、HbA1C)、血脂(TC、TG、LDL、HDL、apoA、apoB)和肾功能(BUN、Cr)、UA和PA水平无明显的相关性,提示血清Cav-1水平变化可能与Hcy、血糖、血脂、PA代谢无关,不受肾功能和UA的影响,可能是急性脑梗死的新指标[9]。但Hcy、血糖、血脂、PA代谢和肾功能、UA等受饮食、运动、药物、吸烟、酗酒等因素影响大。本研究有其局限性:纳入的病例大部分为轻型病例(35/39,NIHSS评分<7分),未进行病因分型,均因为超过时间窗未进行溶栓治疗,无出血转化,且样本量不大,须进一步研究以明确Cav-1在脑梗死的发生和发展中的作用。
综上,血清Cav-1水平在脑梗死发病后存在一定的变化规律,但与Hcy、血糖、血脂、PA代谢无关,不受肾功能和UA的影响,提示Cav-1对脑梗死的发生、发展有一定的预测价值,与常规风险因素联合检测或许能及早发现急性脑梗死的患者,为脑梗死的预防、治疗和预后评估等方面提供一定的理论基础,可能是急性脑梗死的新指标。

