橙皮素通过Wnt/β-catenin信号通路调控肝癌细胞增殖、凋亡、侵袭和迁移的机制研究
李晓媛 郭昊翊 郭敏娟 耿楠 黄真珍
(郑州大学药学院,郑州 450000)
肝癌是一种始于肝脏的恶性肿瘤,可分为原发性和继发性两种类型,其中原发性肝癌是全球第六大最常见的癌症类型[1]。原发性肝癌易发生侵袭和转移,恶性程度高,患者预后差、易复发、病死率较高。肝癌占癌症总数的5.7%,目前仅中国肝癌发病人数就占全世界肝癌患者的55%[2]。尽管在肝癌的治疗方面取得了巨大进展,包括手术、栓塞、化学疗法和靶向治疗,但患者的五年生存率仍然很低[3]。因此,有必要寻找低毒、高效的抗肝癌药物以阻碍肝癌的进展。橙皮素(hesperetin)一种来源于芸香科柑橘属的类黄酮物质,具有抗氧化、抗炎等多种生物学功能[4]。以往研究显示,橙皮素具有降血脂、保护心血管、降压等作用,最近研究发现,其在抗肿瘤方面发挥至关重要的作用[5-6]。研究表明,橙皮素能够显著抑制乳腺癌细胞增殖并诱导细胞凋亡[7]。COUTINHO等[8]研究显示,橙皮素可诱导骨肉瘤细胞停滞于G2期,抑制细胞生长。但是,目前尚不完全了解橙皮素对肝癌细胞生物学行为的影响及作用机制。因此,本研究旨在探究橙皮素对肝癌细胞增殖、凋亡、侵袭和迁移的影响及其可能的作用机制,以期为临床上开发高效、低毒的抗肝癌候选药物提供实验依据。
1 材料与方法
1.1 材料人肝癌细胞MHCC97H购自美国ATCC细胞库;橙皮素(质量分数99%)购自上海源叶生物有限公司;DMEM培养基、青霉素-链霉素双抗购自美国Gibco公司;胎牛血清、胰蛋白酶购自美国HyClone公司;CCK-8细胞活性检测试剂购自日本同仁化学研究所;AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒、Transwell小室和Matrigel基质胶购自美国BD公司;Wnt/β-catenin信号通路激活剂LiCl购自美国Sigma公 司;Cleaved Caspase-3(1∶800稀 释)和Cleaved Caspase-9(1∶800稀释)抗体购自美国SAB公司;MMP-2(1∶500稀释)、MMP-9(1∶500稀释)、β-catenin(1∶500稀释)、c-myc(1∶500稀释)和Cyclin D1(1∶500稀释)抗体购自美国Santa Cruz公司;HRP标记的IgG二抗购自美国CST公司;DMSO购自上海索莱宝生物科技有限公司;SDS-PAGE凝胶试剂盒、BCA蛋白浓度检测试剂盒购自上海碧云天生物技术研究所;ECL化学发光试剂购自赛默飞世尔科技有限公司。
1.2 方法
1.2.1 细胞培养肝癌MHCC97H细胞用含10%胎牛血清和1%青霉素-链霉素双抗的DMEM培养基培养,放置在37℃、含5%CO2、饱和湿度的培养箱中进行孵育,每隔1 d更换1次新的培养液,待细胞贴壁汇合至90%左右时,用胰蛋白酶消化细胞,以1∶3或1∶4的 比 例 进 行传 代,取 对 数 生 长 期 的MHCC97H细胞用于后续实验研究。
1.2.2 CCK-8检测对数期的MHCC97H细胞以2×104个/孔接种到96孔板中,放置在37℃培养箱过夜培养,待细胞生长到50%融合时,用不同浓度的橙皮素(0、0.1、0.5、1、5、10 μmol/L)干预MHCC97H细胞24 h,同时设置空白调零孔,干预结束后弃去原培养液,向每孔细胞中加入含10 μl CCK-8试剂不含血清的DMEM培养液,于37℃培养箱继续孵育2 h,使用酶标仪测定每孔细胞的光密度值(OD值),设置波长为450 nm,计算不同浓度的橙皮素对细胞存活率的影响,细胞存活率(%)=(实验组OD值-空白调零孔OD值)/(对照组OD值-空白调零孔OD值)×100%。并使用GraphPad Prism软件算出橙皮素处理MHCC97H细胞24 h的半数抑制浓度(IC50)。
1.2.3 实验分组和处理对数期的MHCC97H细胞接种到6孔板中,实验分为Con组、HPT组和HPT+LiCl组。Con组的MHCC97H细 胞 未 行处 理,HPT组 的MHCC97H细 胞 以2.5 μmol/L HPT干 预24 h,HPT+LiCl组的MHCC97H细胞以2.5 μmol/L HPT和10 mmol/L Wnt/β-catenin信号通路 激 活 剂LiCl干预24 h。
1.2.4 集落形成实验MHCC97H细胞分组和处理后以5×102个/孔接种到6孔板中,每隔2 d更换1次培养液,培养14 d后,肉眼观察到集落时终止培养,以4%多聚甲醛固定30 min,以1%结晶紫染色15 min,用蒸馏水洗去染液,晾干后统计每孔集落形成数,分别计算各组细胞集落形成率,集落形成率(%)=集落形成数/接种细胞数×100%。
1.2.5 流式细胞术检测对数期的MHCC97H细胞以2×105个/孔种植到96孔板中,按1.2.3分组处理24 h后,离心收集各组MHCC97H细胞,PBS洗涤细胞2次,加入500 μl Binding buffer重悬细胞制成单细胞悬液,随后加入AnnexinⅤ-FITC和PI各5 μl,避光染色15 min,随即通过流式细胞仪测定并分析细胞凋亡率。
1.2.6 Transwell实验对数期的MHCC97H细胞以1.2.3分组处理24 h后,收集细胞,用不含血清的培养液悬浮细胞制成细胞悬液,分别取200 μl细胞悬液添加到Transwell小室的上室(侵袭实验中Tran⁃swell小室的上室覆盖有Matrigel基质胶,迁移实验中Transwell小室的上室无Matrigel基质胶覆盖),在下室添加500 μl含胎牛血清的培养液,将小室放置在常规培养箱孵育24 h,除去小室内的培养液,以PBS洗涤细胞,再以4%多聚甲醛固定细胞20 min,PBS洗涤后以结晶紫染色30 min,PBS洗涤后晾干,使用倒置显微镜观察穿膜细胞数,随机选取5个视野计侵袭或迁移细胞数。
1.2.7 Western blot实验MHCC97H细胞按照上述1.2.3方法分组处理24 h后,收集各组细胞,加入含蛋白酶抑制剂的细胞裂解液,放置在冰上30 min,离心收集上清液即蛋白样品,采用BCA法测定蛋白浓度,制备10%的SDS-PAGE凝胶,取等量蛋白样品上样,行凝胶电泳分离蛋白质,然后电转至硝酸纤维素膜上,将膜置于含5%脱脂奶粉的封闭液中孵育2 h,洗膜后加入相应稀释的一抗,4℃过夜孵育,洗膜后加入HRP标记的IgG二抗,室温孵育2 h,洗膜后以ECL化学发光试剂进行显色,以GAPDH进行标定,采用Image J软件分析各组细胞中目的蛋白相对表达情况。
1.3 统计学分析以上实验均重复3次,取均值,实验数据均以±s表示,采用SPSS21.0统计学软件处理数据,多组间差异比较采用单因素方差分析,组间两两差异比较采用SNK-q检验分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 橙皮素干预MHCC97H细胞作用浓度筛选
CCK-8检测结果显示(图1),在一定浓度范围内橙皮素能够抑制MHCC97H细胞存活率并呈浓度依赖性,随着橙皮素浓度的增加,MHCC97H细胞存活率随之降低,橙皮素干预MHCC97H细胞24 h的半数抑制浓度(IC50)为4.77 μmol/L。根据CCK-8检测结果,将接近1/2 IC50浓度为2.50 μmol/L作为后续实验剂量。
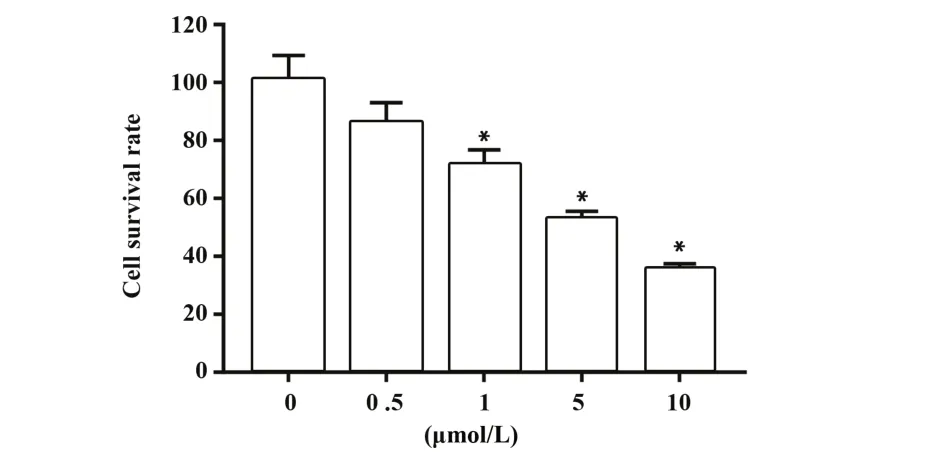
图1 不同浓度的橙皮素对MHCC97H细胞存活率的影响Fig.1 Effect of hesperidin with different concentrations on survival rate of MHCC97H cells
2.2 各组MHCC97H细胞增殖能力比较CCK-8和集落形成实验结果显示(图2),与Con组相比,HPT组MHCC97H细胞OD值和集落形成率均明显降低(P<0.05)。与HPT组相比,HPT+LiCl组细胞OD值和集落形成率均明显升高(P<0.05)。
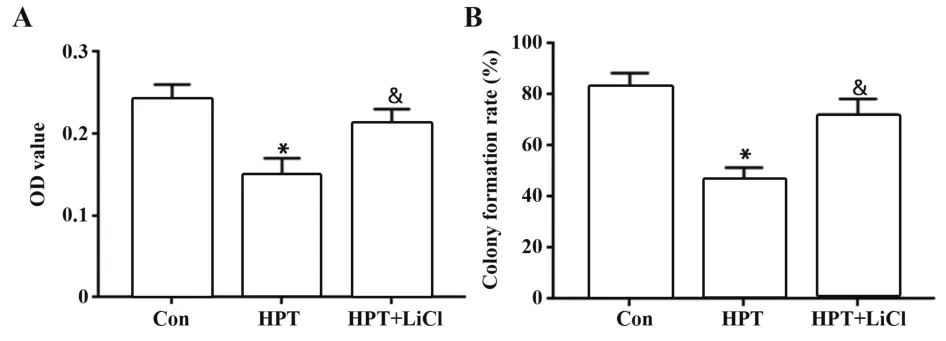
图2 各组MHCC97H细胞OD值和集落形成率比较Fig.2 Comparison of OD value and colony forming rate of MHCC97H cells in each group
2.3 各组MHCC97H细胞凋亡情况比较流式细胞术检测结果显示(图3),与Con组相比,HPT组MHCC97H细胞凋亡率明显升高(P<0.05),与HPT组相比,HPT+LiCl组细胞凋亡率明显降低(P<0.05)。
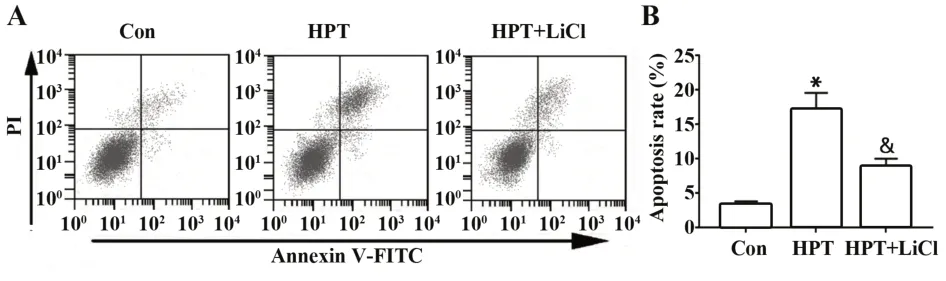
图3 橙皮素对肝癌MHCC97H细胞凋亡率的影响Fig.3 Effect of hesperidin on apoptosis rate of MHCC97H cells in hepatoma
2.4 各组MHCC97H细胞侵袭和迁移能力比较Transwell实验检测结果显示(图4),与Con组相比,HPT组MHCC97H细胞侵袭和迁移数均明显减少(P<0.05),与HPT组相比,HPT+LiCl组侵袭和迁移细胞数均明显增多(P<0.05)。
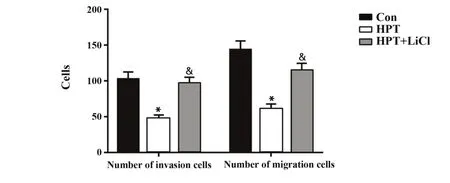
图4 各组MHCC97H细胞侵袭和迁移细胞数比较Fig.4 Comparison of invasion and migration of MHCC97H cells in each group
2.5 各组MHCC97H细胞中蛋白表达水平比较Western blot检测结果显示(图5),与Con组相比,HPT组MHCC97H细 胞 中Cleaved Caspase-3和Cleaved Caspase-9的表达明显上调(P<0.05),MMP-2和MMP-9的表达明显下调(P<0.05),与HPT组相比,HPT+LiCl组细胞中Cleaved Caspase-3和Cleaved Caspase-9的表达明显下调(P<0.05),MMP-2和MMP-9的表达明显上调(P<0.05)。
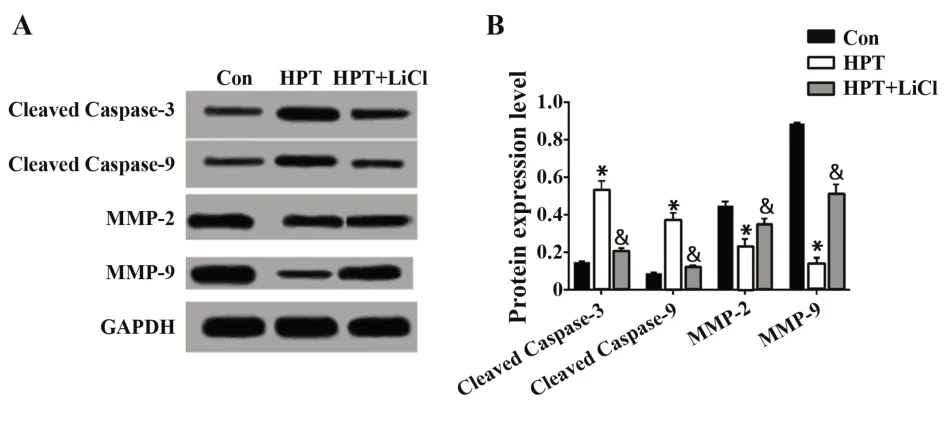
图5 橙 皮 素 对Cleaved Caspase-3、Cleaved Caspase-9、MMP-2和MMP-9表达的影响Fig.5 Effect of hesperidin on expressions of Cleaved Caspase-3,Cleaved Caspase-9,MMP-2 and MMP-9
2.6 各组MHCC97H细胞中Wnt/β-catenin信号通路激活水平比较Western blot检测结果显示(图6),与Con组相比,HPT组MHCC97H细胞中β-catenin、c-myc和Cyclin D1表达水平均明显降低(P<0.05),与HPT组相比,HPT+LiCl组细胞中β-catenin、c-myc和Cyclin D1表达水平均明显升高(P<0.05)。
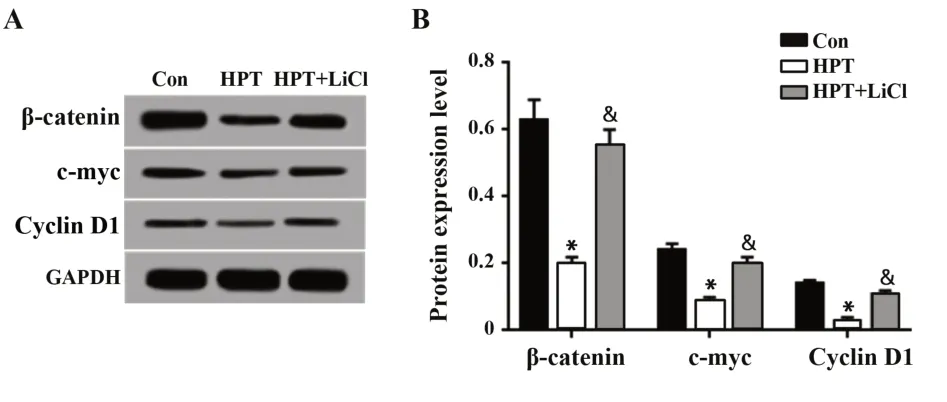
图6 橙皮素对Wnt/β-catenin信号通路激活的影响Fig.6 Effect of hesperidin on Wnt/β-catenin signaling pathway activation
3 讨论
橙皮素是一种黄酮类化合物,普遍存在于芸香科柑橘属的幼果中。在临床中,橙皮素长期以来一直用于治疗心血管疾病、炎症以及抢救休克[9]。橙皮素能够影响包括细胞氧化应激、自噬、线粒体损伤、钙平衡和内质网应激等生物学过程[10]。最近,苦参碱的抗肿瘤特性引起了广大学者的关注。有研究显示橙皮素以Caspase-3依赖的方式促进人肺癌H522细胞的凋亡[11]。此外橙皮素可以通过线粒体介导的内源性途径通过ROS的积累来诱导食管癌细胞的细胞凋亡[12]。在前列腺癌中,橙皮素处理可导致细胞增殖受到抑制,并诱导细胞周期停滞在G1期[13]。LEE等[14]研究发现,橙皮素和柚皮素可通过下调FAK和p38信号通路抑制人胰腺癌细胞的生长和迁移。这些证据表明橙皮素对不同类型癌症的发展和进程产生影响。赵雨欣等[15]研究发现,橙皮素衍生物对肝癌细胞具有促凋亡作用。但是,尚不完全了解橙皮素调节肝癌细胞生物学行为的影响和分子机制。本实验首先采用不同浓度的橙皮素干预肝癌MHCC97H细胞,结果发现,在一定浓度范围内橙皮素能够抑制MHCC97H细胞的存活率。后续实验结果显示,橙皮素不仅可诱导MHCC97H细胞凋亡,对细胞侵袭和迁移能力均有抑制作用。Caspase-3和Caspase-9均为Caspase家族成员,与真核细胞凋亡密切相关。Caspase-9是细胞凋亡的启动者,受信号刺激引起Caspase级联反应,启动死亡信号的转导,Caspase-3是细胞凋亡的执行者,可直接降解细胞内功能蛋白引发凋亡[16]。MMP-2和MMP-9属于基质金属蛋白酶家族成员,在肿瘤细胞侵袭转移中发挥重要作用[17]。本实验Western blot检测结果发现,橙皮素干预的MHCC97H细胞中Cleaved Caspase-3、Cleaved Caspase-9的表达明显上调,MMP-2和MMP-9的表达明显下调。提示橙皮素可能通过Caspase-3方式诱导MHCC97H细胞凋亡,通过调节MMP-2和MMP-9的表达阻碍细胞侵袭和迁移。这些实验结果提示橙皮素对肝癌的发展和进程具有一定的抑制作用。
Wnt/β-catenin信号通路参与胚胎发育和致癌过程中的生理病理过程。目前已经在不同类型的肿瘤中发现了Wnt/β-catenin信号传导途径的异常激活[18-20]。在10%~50%的肝癌肿瘤中观察到β-catenin异常表达,并且β-catenin的高表达与肿瘤的进展和不良的预后相关[21]。因此可通过阻断Wnt/β-catenin信号转导途径以达到治疗肝癌的目的。为探究橙皮素对肝癌细胞生物学行为影响的机制,本实验检测了Wnt/β-catenin信号通路相关蛋白的表达情况,结果发现橙皮素干预的MHCC97H细胞中β-catenin、c-myc和Cyclin D1的表达均明显下调,提示橙皮素可能通过抑制Wnt/β-catenin信号通路的激活抑制MHCC97H细胞增殖、侵袭和迁移,并促进细胞凋亡。为验证该推测,本实验在橙皮素干预的MHCC97H细胞中添加Wnt/β-catenin信号通路激活剂LiCl,结果显示LiCl能够部分逆转橙皮素对MHCC97H细胞增殖、侵袭和迁移能力的抑制作用,阻碍橙皮素诱导的MHCC97H细胞凋亡。这些实验结果证实了橙皮素对肝癌MHCC97H细胞增殖、凋亡、侵袭和迁移的调节作用是通过阻断Wnt/β-catenin信号通路来实现的。
综上所述,橙皮素可有效抑制人肝癌细胞的增殖、侵袭和迁移,并诱导细胞发生凋亡,下调Cleaved Caspase-3/9的表达,上调MMP-2/9的表达。此外,橙皮素能够抑制Wnt/β-catenin信号通路有关蛋白β-catenin、c-myc和Cyclin D1的表达。因此,橙皮素可能通过调控Wnt/β-catenin信号通路抑制肝癌的进程。本实验为解析橙皮素的药理机制提供一些理论依据,为橙皮素用于肝癌的临床治疗提供一定的实验依据。