苦参碱通过MAPK/mTOR信号通路诱导IMCD3细胞自噬及机制研究①
马广强 牛玲 宋莹莹 万红娇 靳亮
闫成花(江西中医药大学,南昌 330004)
常染色体显性多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)是一种常见的单基因遗传性肾病,主要由多囊肾病基因1(Pkd1)和多囊肾病基因2(Pkd2)基因突变所致。发病率为1/1 000~1/400,多见于成人,主要表现为肾小管上皮细胞囊肿,肾实质逐渐纤维化,肾功能进行性减退,最终导致肾功能衰竭以及终末期肾病(end-stage renal disease,ESRD)[1]。据流行病学统计,中国约有150万患者,多囊肾(polycystic kidney disease,PKD)是引起我国终末期肾病的四大病因之一[2]。ADPKD发病率高,预后差,受到社会的普遍关注和医学界的高度重视。患者在临床中常伴有疼痛、血尿以及囊内感染等并发症,患者一生中可能经历数次囊内感染,目前,西医临床对于PKD的治疗无特异性药物,主要通过药物抑制囊肿增大及囊液分泌,以缓解临床症状,延缓肾衰竭,若病情发展至终末期肾病,则以透析治疗或换肾为主,近一半的ADPKD患者最终需要肾脏替代治疗[3]。开发缓解或治疗PKD的有效药物是医学界的一大难题,因此,研究PKD的发病机制,对探寻有效的治疗方案具有重要作用。
中药是我国乃至全球的宝贵财富,诸多中药或者其提取物在各种疾病的治疗上显示了显著的优势。苦参(sophora flavescens ait)为豆科槐属植物,是一种传统中药材,在我国已经有两千多年的使用历史,主要具有清热、利尿、杀虫、祛湿等功效,同时还具有抗炎、抗病毒、抗肿瘤等功能[4]。苦参的生物活性成分主要包括生物碱类和黄酮类成分,其中苦参碱在生物碱中含量相对较大,是最主要的活性物质[5-7]。苦参碱具有抗病毒,抗肿瘤、抗菌以及抗炎等多方面作用[8]。但苦参碱对PKD疾病以及功能机制的研究尚无报道。本研究旨在探究苦参碱对肾上皮细胞自噬的影响及其调节机制,从而为临床治疗PKD患者提供新的治疗思路。
1 材料与方法
1.1 材料高糖培养基(索莱宝,12100);DMSO(索莱宝,D8371);优质胎牛血清(GEMINI,900-108);胰酶(索莱宝,T1350);IMCD3细胞(上海舜冉生物公司);无菌PBS(索莱宝,P1020);显微镜盖玻片(江苏世泰实验器材有限公司);苦参碱(湖南凯拉瑞生物科技有限公司,519-02-8);0.22 μm无菌过滤器(硕华,621110);BAF(Sigma,B1793);细胞培养皿(硕华,230101);细胞培养板(硕华,220100);Annexin V-FITC细胞凋亡检测试剂盒(碧云天,C1062M-1);CCK-8试剂盒(Bioss,BA00280);TriQuick Reagent总RNA提取试剂(索莱宝,R1100);2.5%戊二醛固定液(森倍伽生物科技,BL-G014);4%多聚甲醛固定液(索莱宝,P1110);LC3(Proteintech,14600-1-AP);SDS-PAGE凝胶制备试剂盒(索莱宝,P1200);5×蛋白上样缓冲液(索莱宝,P1040)。
1.2 方法
1.2.1 细胞培养IMCD3接种于含10%胎牛血清和1%青链霉素的高糖培养基,于37℃、5%CO2的培养箱中培养。
1.2.2 CCK-8法检测细胞活性实验将胰酶消化后的IMCD3细胞制成细胞悬液,接种于96孔板中,每孔细胞铺板量为3×104个,置于37℃、CO2培养箱中孵育24 h。分别用0.2、0.4、0.8、1.6 mg/ml的苦参碱处理,每个浓度2个复孔,并设置不加苦参碱的空白对照组,培养24 h后,每孔加入CCK-8溶液20 μl以及180 μl细胞培养液,置于培养箱内孵育40 min。采用酶标仪测定450 nm处的吸光度。
1.2.3 细胞凋亡实验将实验分为:空白对照组;苦参碱处理组(0.2、0.4、0.8、1.6 mg/ml),每样2个复孔。将贴壁细胞IMCD3以1.25×105个/孔,铺板于12孔板中,培养24 h后给药。将对照组和药物处理组的IMCD3细胞使用Annexin V-FITC细胞凋亡检测试剂盒染色;将消化后的细胞悬液每样取1×105个细胞,1 500 r/min离心5 min,弃上清,加入195 μl Annexin V-FITC结合液轻轻重悬细胞。加入5 μl Annexin V-FITC,轻轻混匀后加入1 μl碘化丙啶染色液,室温(20~25℃)避光孵育10~20 min,随后置于冰浴中,流式细胞仪检测细胞凋亡并计算细胞凋亡率。
1.2.4 免疫荧光实验将实验分组为:空白对照组;苦参碱处理组(0.8 mg/ml),每样2个复孔。将贴壁细胞IMCD3以2.5×105个/孔铺板于6孔板中,孔内预先放置无菌细胞爬片,加入细胞培养基培养24 h后去掉原培养基,用PBS清洗2遍,按预先实验设计给药培养24 h。在达到上述培养条件后,弃去细胞培养基及苦参碱药液,加入4%多聚甲醛固定液,固定20 min后去掉固定液。0.5% Triton X-100(PBS配制)室温通透20 min,PBS浸洗玻片3次,每次3 min,吸水纸吸干PBS,在玻片上滴加正常山羊血清,室温封闭30 min;吸水纸吸掉封闭液,每张玻片滴加足够量的稀释好的一抗并放入湿盒,4℃孵育过夜;过夜后加荧光二抗:PBST浸洗爬片3次,每次3 min,吸水纸吸干爬片上多余液体后滴加稀释好的荧光二抗,湿盒中20~37℃孵育1 h,PBST浸洗切片3次,每次3 min;复染核:滴加DAPI避光孵育5 min,对标本进行染核,PBST洗4次,每次5 min洗去多余的DAPI;用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
1.2.5 透射电镜样品制备以及观察实验将实验分为:空白对照组;苦参碱处理组(0.4 mg/ml、0.8 mg/ml)。将IMCD3细胞以2.5×105个/孔铺板于6孔板中,加入含有10%FBS的高糖培养基培养24 h后,按实验设计去原培养基给予相应药物继续培养24 h;分别收集对照组和给药组细胞于无酶EP管内,加入2.5%戊二醛固定液,常温固定5 min,5 000 r/min、4℃下离心2 min;去固定液后重新加入2.5%戊二醛固定液,挑起细胞沉淀至其悬浮;室温避光固定30 min,转移至4℃保存。后用锇酸固定,乙醇逐级脱水、渗透,环氧树脂包埋,超薄切片,铀铅染色,在透射电镜下观察并摄片。
1.2.6 Western blot法 检 测LC3、Beclin-1、ERK、p-ERK、AKT、p-AKT、p-p70S6K、p70S6K、p53等蛋白的表达水平将实验分为空白对照组;不同浓度苦参碱处理组。将对数生长期的IMCD3细胞以2.5×105个/孔加入6孔板中培养,24 h后去除原培养基用PBS清洗2遍后,按实验分组设计分别给药培养24 h。每孔加入500 μl配置好的细胞裂解液,用干净的细胞刮刀刮取干净并转移至1.5 ml EP管中,每3 min涡旋振荡15 s,反复5次使细胞充分裂解;振荡完毕后,以12 000 r/min、4℃离心15 min。吸取上清至新的离心管,采用BCA法测量样品蛋白浓度;测出浓度后将蛋白样品稀释至同一浓度,加入总体积1/5的5×上样缓冲液,涡旋混匀后,金属浴100℃加热变性10 min,冷却后于-30℃保存。使用SDS-PAGE试剂盒配置凝胶,将凝胶中的蛋白样品转移至PVDF膜上,5%BSA中室温封闭2 h,加入对应的一抗,4℃过夜,TBST漂洗3次,每次10 min,对应二抗室温孵育2 h,TBST漂洗3次,每次10 min。加入ECL发光液,用Alpha EaseFC凝胶成像系统进行图像的扫描与采集。
1.3 统计学分析用GraphPad Prism 6进行实验数据的统计学分析,两两比较用独立样本的t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 苦参碱对IMCD3细胞活力的影响通过CCK-8检测发现,与空白对照组相比,不同浓度苦参碱(0.2、0.4、0.8 mg/ml)作用细胞24 h后,细胞活力无明显变化,当苦参碱浓度为1.6 mg/ml时,细胞活力受到明显抑制(P<0.05),见图1。

图1 苦参碱对IMCD3细胞活力的影响Fig.1 Effect of matrine on cell viability in IMCD3 cells
2.2 苦参碱对IMCD3细胞凋亡的影响通过流式细胞术检测分析发现,与空白对照组比较,当苦参碱浓度为0.2、0.4、0.8 mg/ml时,细胞凋亡无明显差异,当苦参碱浓度为1.6 mg/ml时,细胞凋亡率显著增加(P<0.05),见图2。

图2 苦参碱对IMCD3细胞凋亡的影响Fig.2 Effect of matrine on cell apoptosis in IMCD3 cells
2.3 苦参碱对IMCD3细胞自噬的影响通过Western blot检测不同浓度苦参碱对细胞自噬相关蛋白LC3表达的影响,发现随着浓度的增加,LC3蛋白表达明显增强,见图3A。此外,随着处理时间增加,LC3蛋白的表达明显增强,见图3B。以上结果表明,苦参碱对细胞自噬的影响呈浓度和时间依赖性,雷帕霉素是一种经典的自噬诱导剂,将其作为阳性对照。发现雷帕霉素处理组LC3-Ⅱ蛋白表达明显增加,0.8 mg/ml的苦参碱处理LC3-Ⅱ蛋白的表达也明显增加,见图3C。通过免疫荧光染色法检测LC3蛋白的表达,空白对照组中,LC3红色荧光较弱,且呈弥散状态,0.8 mg/ml苦参碱处理组,细胞质中LC3的染色强度明显增强,见图3D。透射电镜分析进一步证实,苦参碱处理后胞浆内自噬小泡的数量明显增多,且呈现浓度梯度依赖性,见图3E。3-methyladenine(3-MA)是自噬的关键调节因子PI3K的抑制剂,可通过阻断自噬早期自噬小泡的形成来抑制自噬。3-MA预处理可降低苦参碱处理组细胞中的LC3-Ⅱ表达,见图3F。说明苦参碱可通过影响自噬小泡形成诱导细胞自噬。
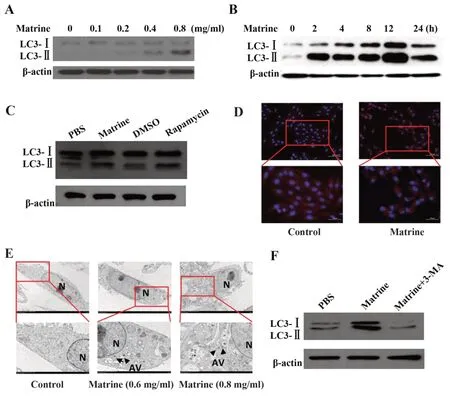
图3 苦参碱诱导IMCD3细胞自噬Fig.3 Matrine induced cell autophagy of IMCD3 cells
2.4 苦参碱影响IMCD3细胞自噬的机制不同浓度苦参碱(0.2、0.4、0.8 mg/ml)处理细胞24 h,随着苦参碱浓度的增加,p-ERK和p-p70S6K的表达明显降低,而Beclin-1、p53、ERK、p-AKT、AKT、p70S6K的表达未见明显变化,见图4。
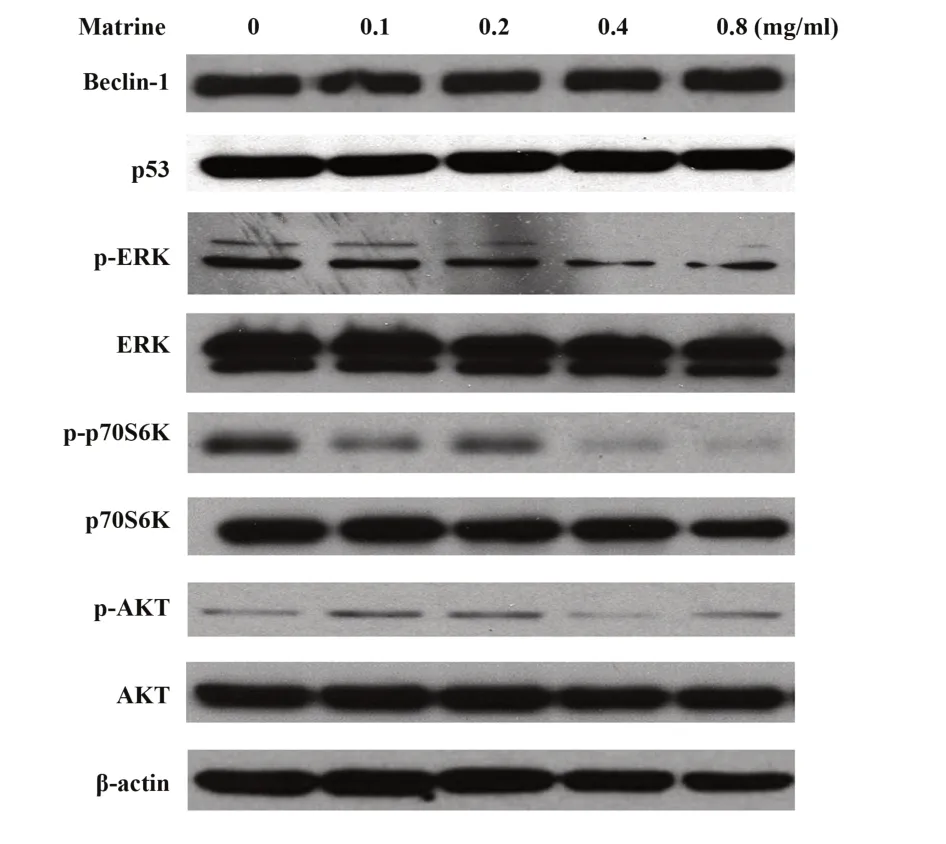
图4 Western blot检测MAPK/mTOR信号通路蛋白表达Fig.4 Expressions of MAPK/mTOR signal pathway related proteins were tested by Western blot
3 讨论
ADPKD以肾囊肿形成、炎症和纤维化为主要特征。自噬可以清除细胞内损伤的蛋白质,在细胞的生物合成、营养和代谢及应激反应中起重要作用,可以维持细胞正常功能和内环境稳态[9],影响自噬的信号通路主要包括mTOR依赖的通路(PI3K/AKT/mTOR通路、AMPK/mTOR通路、MAPK/mTOR通路)和非mTOR依赖的通路。自噬与多种疾病的发生密切相关,如肿瘤,代谢失调等。研究发现,自噬与PKD的发生也密切相关,自噬诱导剂可以缓解PKD的发生与发展。有报道PKD动物模型和PKD患者肾上皮细胞自噬反应强度明显减弱,表明自噬与PKD发生密切相关,在PKD发生过程中发挥重要功能[10-12]。肾上皮细胞初级纤毛对PKD具有保护作用,纤毛的存在是激活自噬所必需的,而自噬缺陷反过来又抑制纤毛的形成,从而促进PKD的发生[13-14]。此外,治疗PKD的试剂和药物,如雷帕霉素和mTOR非依赖性药物卡马西平和米诺地尔,主要通过促进肾上皮细胞自噬而发挥功能[15-16]。异常的mTOR激活与PKD中的自噬受损和纤毛缺陷有关[17]。因此,mTOR信号通路介导的细胞自噬可以保护肾功能,延缓PKD疾病的发生发展过程。本次研究发现苦参碱可以通过抑制MAPK/mTOR信号通路中ERK以及mTOR的磷酸化,诱导IMCD3自噬。
研究发现,苦参碱是一种新型自噬诱导剂,在抗肿瘤方面具有重要功能。苦参碱可以通过下调STAT3抑制自噬,抑制线粒体能量的产生,从而抑制KRAS突变型胰腺癌MIAPACA2和8988T细胞的增殖[18]。苦参碱可诱导人骨肉瘤MG-63细胞凋亡,但也可通过细胞外信号调节激酶(ERK)信号通路诱导MG-63细胞保护性自噬[19]。苦参碱在急性髓系白血病中具有重要功能,可以通过抑制AKT、mTOR及其下游底物p70S6K和真核翻译起始因子4 E结合蛋白1(eIF4EBP1)的磷酸化诱导自噬,抑制细胞的增殖,发挥抗肿瘤活性[20]。YANG等[21]2015年发现,苦参碱可以通过增加LC3-Ⅱ,Beclin-1和PI3KC3的表达水平,降低P62的表达水平来诱导肝癌细胞(HCC)自噬。2015年,XIE等[22]发现,苦参碱在不同的人肝癌细胞中诱导自噬的途径不同,激活自噬相关信号通路不同,在SMMC7721细胞主要通过mTOR信号通路诱导细胞自噬,而在HepG2细胞中主要通过p53/AMPK信号通路诱导细胞自噬。苦参碱抑制AKT和mTOR磷酸化,降低p62蛋白表达,促进自噬相关蛋白LC3表达,通过AKT/mTOR途径诱导细胞自噬从而具有抗乳腺癌活性[23]。但苦参碱在PKD中的功能及调控机制却无报道。
本研究聚焦于自噬,主要探究苦参碱对小鼠肾脏内髓集合管上皮细胞自噬的影响及机制。本次研究采用浓度为0.2、0.4、0.8 mg/ml的苦参碱处理IMCD3细胞,发现与空白对照组相比,苦参碱不同浓度处理组IMCD3细胞的活性无变化,细胞的凋亡率也无明显变化,表明苦参碱浓度≤0.8 mg/ml时,不影响细胞的活性和细胞的凋亡。但与空白对照组相比,细胞中LC3蛋白的表达明显升高,且苦参碱浓度梯度依赖性,表明苦参碱诱导细胞自噬,苦参碱浓度增加,对细胞自噬诱导作用越强,这也进一步说明苦参碱可能通过诱导细胞自噬参与PKD的治疗。不同浓度的苦参碱(0.2、0.4、0.8 mg/ml)处理IMCD3细胞24 h后,与空白对照组相比,自噬相关信号通路蛋白ERK以及p70S6K的磷酸化明显降低,苦参碱浓度越高,蛋白磷酸化水平越弱,说明苦参碱能够有效抑制ERK以及p70S6K蛋白的功能,进而促进细胞自噬。
ADPKD的第一大特征囊肿形成,与肾间质炎症和纤维化密切相关,间质炎症可促进肾组织纤维化,可导致囊肿扩张,损伤肾功能[24]。肾间质炎症与囊肿液中多种炎症性细胞因子如TNF-α、IL-1、IL-6等的表达和积累有关,囊液IL-6和TNF-α可诱导肾脏SMYD2表达,SMYD2转录靶基因Ptpn13,通过Ptpn13介导的磷酸化将SMYD2与其他PKD相关的信号通路相连,包括ERK、mTOR和AKT信号通路,促进PKD囊肿生长[25]。巨噬细胞在调节炎症反应中具有重要的功能,在人类PKD和动物模型中发现巨噬细胞浸润与囊肿形成密切相关,巨噬细胞移动抑制因子(MIF)是ADPKD囊肿生长的重要调节因子,MIF通过激活ERK、mTOR和Rb/E2F通路,促进囊性上皮细胞增殖,促进囊肿形成[26]。苦参碱具有重要的抗炎作用,研究发现在香烟烟雾诱导的气道中性粒细胞炎症模型中,苦参碱通过促进中性粒细胞凋亡,减少气道中性粒细胞炎症[27];苦参碱还可通过调节CCR7信号通路降低促炎细胞因子IL-1β和IL-17的表达,减轻脂多糖诱导的肠道炎症和氧化应激[28];苦参碱通过抑制小鼠气道上皮细胞NF-κB信号转导下调SOCS3表达,以剂量依赖性方式显著抑制OVA诱导的小鼠AHR、炎症细胞浸润、杯状细胞分化和黏液生成。体外实验表明,苦参碱可以抑制LPS诱导的巨噬细胞分泌炎症细胞因子IL-1β和TNF-α[29]。苦参碱能否发挥抑炎功能,通过抑制肾脏炎症,缓解ADPKD的发生发展还有待深入研究。
综上所述,苦参碱主要通过抑制MAPK/mTOR信号通路中ERK以及p70S6K的磷酸化起到促进IMCD3细胞自噬的作用。下一步计划在体内探索苦参碱对PKD的影响,为PKD的新药开发提供理论依据。