三七总皂苷抑制铁死亡和炎症反应减轻大鼠脑缺血再灌注损伤①
王林琳 康智能 刘文鹏 唐标 邓常清
(湖南中医药大学中西医结合病原生物学湖南省点重实验室,长沙 410028)
缺血性脑卒中是全球主要的疾病负担,其治疗手段以溶栓和取栓为主,但血流复灌后常加重损伤,即脑缺血再灌注损伤(cerebral ischemia reperfu⁃sion injury,CIRI)[1-2]。CIRI的损伤机制复杂,与炎症反应和氧化应激等多环节以及细胞凋亡、细胞焦亡和程序性坏死等多种细胞死亡方式有关[3]。铁死亡作为新的细胞死亡方式参与CIRI,已有研究揭示脑缺血再灌注诱导神经元铁死亡,而抑制铁死亡能减轻CIRI,铁死亡成为CIRI干预的重要潜在靶点[4-5]。
三七具有活血散瘀、消肿定痛等功效,是治疗心脑血管疾病的常用中药。三七总皂苷(panax notoginseng saponins,PNS)是三七主要的有效成分,PNS制剂如血栓通和血塞通广泛应用于心脑血管疾病的防治中,疗效确切。已有研究揭示PNS可通过抗炎、抗氧化、促进血管新生等多环节发挥抗CIRI作用[6-7],但PNS是否调控铁死亡从而减轻CIRI尚未见报道。本研究基于PNS对铁死亡的调控作用探讨PNS减轻CIRI的机制。
1 材料与方法
1.1 材料
1.1.1 药物PNS(批号:DS0054)购自成都德思特生物技术有限公司。
1.1.2 实验动物SPF级SD雄性大鼠73只,体质量(220±10)g,购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2019-0004)]。排除手术中出血、再灌注死亡及造模不成功的13只,剩余60只用于后续试验,每组12只,其中全部12只进行神经功能评分,6只用于染色和形态学检测,6只用于试剂盒和Western blot检测。实验方案经湖南中医药大学伦理委员会审核批准后实施(编号:LL2021042803)。
1.1.3 主要试剂线栓(批号:2636A2)购自北京西浓科技有限公司;TTC染料(批号:BCCC4696)、鼠抗β-actin单克隆抗体(批号:A5441)购自Sigma公司;Western及IP细胞裂解液(批号:P0013)、SDSPAGE凝胶配制试剂盒(批号:P0014A)购自碧云天公司;MDA试剂盒(批号:A003-1)、GSH试剂盒(批号:A006-2-1)、组织Fe2+试剂盒(批号:A039-2-1)购自南京建成生物工程研究所;大鼠IL-6试剂盒(批号:CSB-E04640)、TNF-α试剂盒(批号:CSB-E11987)和IL-1β试剂盒(批号:CSB-E08055)购自武汉华美有限公司;GPX4抗体(批号:DF6701)购自Affinity Biosciences公司;山羊抗鼠二抗(批号:ZK-0293P)和山羊抗兔二抗(批号:ZK-0295G-SA)购自Merck Mil⁃lipore公司。
1.1.4 主要仪器电泳仪、转膜仪及凝胶成像系统购自Bio-Rad公司。
1.2 方法
1.2.1 实验分组与CIRI大鼠模型的建立大鼠随机分为假手术组、MCAO/R组和PNS低、中、高剂量组,12只/组。参照前期实验制作模型,操作简述如下:大鼠腹腔注射2%戊巴比妥钠(42 mg/kg)麻醉后,右侧颈外动脉结扎、凝断后剪口,将线栓从颈外动脉插入颈内动脉,并沿颈内动脉轻柔推至大鼠大脑前动脉,线栓头端阻塞大脑中动脉,进线长度距颈总动脉分叉处约为(18±2)mm,固定后缝合。线栓阻断血流2 h后,抽出线栓实施复灌注24 h;假手术组分离血管,不剪口和插线栓。PNS低、中、高剂量组于造模前50 h和26 h、2 h连续灌胃给药3次,剂量分别为20、40、80 mg/kg[8]。假手术组与MCAO/R组灌胃给予等体积生理盐水。
1.2.2 神经功能评分缺血再灌注后各组大鼠参照Longa评分法进行神经功能缺失双盲评分[9],0分:无神经功能缺失症状;1分:提尾时左侧前肢不能完全伸直;2分:爬行时持续性向左侧转圈;3分:行走时身体向左侧倾倒;4分:不能自行行走,意识丧失。评分越高说明大鼠神经功能障碍越严重。有神经功能缺失症状和神经功能评分为造模成功的标准。
1.2.3 脑梗死体积测定采用TTC染色法检测脑梗死体积,断头取脑后于-20℃冰箱放置20~25 min,除去小脑和嗅球,从大脑的额叶向枕叶连续切5片,厚度约为2 mm。脑片于3%TTC溶液中37℃孵育18 min,期间翻面2次,染色分明后取出,放入4%的多聚甲醛中固定过夜后拍照。
1.2.4 脑组织中MDA、GSH、Fe2+含量测定取大鼠右侧皮层组织放入液氮中速冻,然后置于预冷后的研磨钵中研磨成白色粉末状,取粉末称取重量,根据重量和体积1∶9加入预冷的生理盐水进行匀浆。匀浆后,3 500 r/min离心12 min,吸取上清液以备检测,检测按照说明书添加样品及工作试剂,绘制标准曲线计算MDA、Fe2+、GSH含量。
1.2.5 Western blot检测大鼠脑组织GPX4的蛋白表达同前期研究,取大鼠右侧大脑皮质组织裂解后,12 000 r/min离心12 min,取上清测定蛋白浓度并配平和变性。取30 μg蛋白进行电泳、转膜和封闭后,加入GPX4(1∶1 000)或β-actin(1∶10 000)抗体4℃孵育过夜,洗膜后,加入二抗(1∶10 000)室温孵育1 h,洗涤后显影,Image J软件进行条带的定量分析[8]。
1.2.6 脑组织中IL-1β、TNF-α、IL-6含量的测定取大鼠右侧缺血大脑皮质组织匀浆后,4 800 r/min离心6 min,取上清按照试剂盒说明书检测,绘制标准曲线并计算脑组织中IL-1β、TNF-α、IL-6含量。
1.3 统计学分析采用SPSS23.0进行分析,计量资料以±s表示。数据进行方差齐性检验后,用单因素方差分析进行多组间比较,方差齐者采用LSD检验进一步进行两两比较,方差不齐者用Dunnet's T3检验,P<0.05为差异有统计学意义。
2 结果
2.1 PNS对MCAO/R大鼠神经功能评分的影响如表1所示,假手术组大鼠无神经功能缺失症状,评分为0;与假手术组相比,MCAO/R大鼠评分显著增加(P<0.01);与MCAO/R组相比,PNS低、中、高剂量组大鼠评分显著降低(P<0.05或P<0.01)。
表1 PNS对MCAO/R大鼠神经功能评分的影响(±s)Tab.1 Effects of PNS on neurological deficit score of MCAO/R rats(±s)
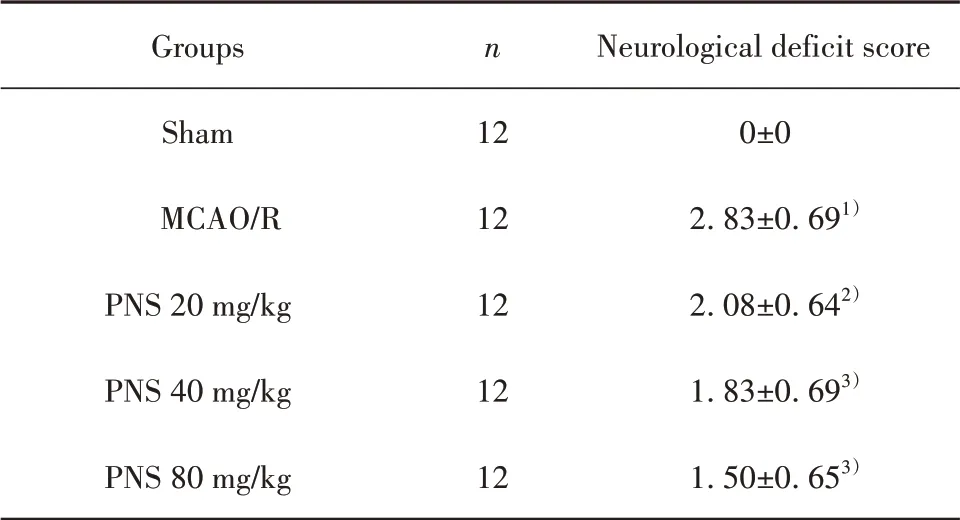
表1 PNS对MCAO/R大鼠神经功能评分的影响(±s)Tab.1 Effects of PNS on neurological deficit score of MCAO/R rats(±s)
Note:Compared with Sham group,1)P<0.01;compared with MCAO/R group,2)P<0.05,3)P<0.01.
Groups Sham MCAO/R PNS 20 mg/kg PNS 40 mg/kg PNS 80 mg/kg n 12 12 12 12 12 Neurological deficit score 0±0 2.83±0.691)2.08±0.642)1.83±0.693)1.50±0.653)
2.2 PNS对MCAO/R大鼠脑梗死体积的影响TTC染色结果如图1所示,红色为脑组织正常区,白色为脑缺血梗死区,假手术组大鼠脑片无梗死区,MCAO/R处理后大鼠脑有明显的白色脑梗死区,而PNS干预后减少大鼠脑梗死区体积。
2.3 PNS对MCAO/R大鼠脑组织中MDA、GSH、Fe2+含量的影响与假手术组相比,MCAO/R组大鼠缺血侧大脑皮质组织中GSH含量显著降低,Fe2+和MDA含量显著升高(P<0.01);与MCAO/R组相比,PNS组大鼠脑组织中GSH含量显著升高,Fe2+和MDA含量显著降低(P<0.01),见表2。
表2 PNS对MCAO/R大鼠脑组织中MDA、GSH、Fe2+含量的影响(±s,nmol/mg,n=6)Tab.2 Effects of PNS on MDA,GSH,Fe2+contents of MCAO/R rats cerebral cortex(±s,nmol/mg,n=6)
Note:Compared with Sham group,1)P<0.01;compared with MCAO/R group,2)P<0.01.
Groups Sham MCAO/R PNS 20 mg/kg PNS 40 mg/kg PNS 80 mg/kg MDA 18.24±1.06 38.64±1.921)30.17±1.352)25.15±1.272)22.83±0.952)GSH 14.25±1.06 5.51±1.301)7.45±0.802)9.33±0.802)10.18±1.022)Fe2+0.044±0.011 0.091±0.0141)0.076±0.0072)0.072±0.0052)0.068±0.0072)
2.4 PNS对MCAO/R大鼠脑组织中GPX4表达水平的影响如图2所示,MCAO/R处理后,大鼠缺血侧大脑皮质组织中GPX4表达水平显著降低(P<0.01);而PNS低、中、高剂量干预能显著增加大鼠MCAO/R后大脑组织中GPX4蛋白表达水平(P<0.01)。
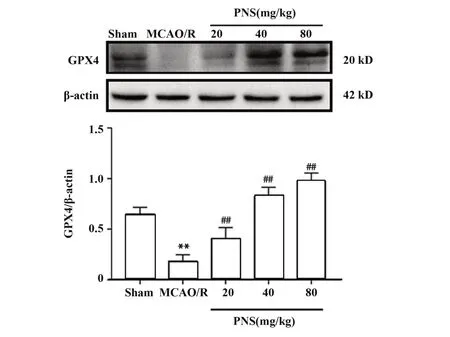
图2 PNS对MCAO/R大鼠脑组织中GPX4表达水平的影响Fig.2 Effect of PNS on GPX4 expression of MCAO/R rats cerebral cortex
2.5 PNS对MCAO/R大鼠脑组织中IL-1β、TNF-α、IL-6含量的影响MCAO/R处理后,大鼠皮层脑组织中IL-1β、TNF-α、IL-6含量显著升高(P<0.01);PNS低、中、高剂量干预后,MCAO/R大鼠脑组织中IL-1β、TNF-α、IL-6含量显著降低(P<0.01),见表3。
表3 PNS对MCAO/R大鼠脑组织中IL-1β、TNF-α、IL-6含量的影响(±s,pg/mg,n=6)Tab.3 Effects of PNS on IL-1β,TNF-α,IL-6 contents of MCAO/R rats cerebral cortex(±s,pg/mg,n=6)

表3 PNS对MCAO/R大鼠脑组织中IL-1β、TNF-α、IL-6含量的影响(±s,pg/mg,n=6)Tab.3 Effects of PNS on IL-1β,TNF-α,IL-6 contents of MCAO/R rats cerebral cortex(±s,pg/mg,n=6)
Note:Compared with Sham group,1)P<0.01;compared with MCAO/R group,2)P<0.01.
Groups Sham MCAO/R PNS 20 mg/kg PNS 40 mg/kg PNS 80 mg/kg IL-1β 27.75±4.71 85.67±13.541)71.46±9.052)53.18±5.432)43.16±6.322)TNF-α 8.86±0.96 19.82±0.901)16.37±1.222)14.23±1.452)12.01±1.522)IL-6 0.044±0.003 0.067±0.0061)0.058±0.0032)0.056±0.0022)0.053±0.0042)
3 讨论
本研究揭示MCAO/R处理后,大鼠有明显的神经功能缺失症状和脑梗死区,评分显著增加,缺血侧大脑皮质组织中Fe2+和MDA及促炎因子IL-1β、TNF-α、IL-6含量显著增加,GSH含量和铁死亡关键蛋白GPX4水平显著降低;PNS干预显著降低大鼠MCAO/R后的评分,减少脑梗死区域体积,降低缺血侧脑组中Fe2+和MDA含量,增加GSH含量和GPX4表达水平,降低IL-1β、TNF-α、IL-6含量。已有大量前期体内和体外研究揭示PNS能减轻CIRI[10-12],本研究结果与既往研究结果一致,表明PNS具有减轻CIRI作用。
铁死亡作为一种新的细胞死亡方式介导了癌症、缺血再灌注损等多种疾病的发生和发展过程,参与并加重CIRI,抑制铁死亡,减轻CIRI[13-15]。铁死亡的主要特征是铁依赖的脂质过氧化活化以及过氧化产物蓄积诱导细胞死亡,并常伴随GSH和GPX4抗氧化系统功能下调,在脑缺血再灌注中,铁死亡的发生主要表现为铁超载,GPX4和GSH水平降低及脂质过氧化产物MDA含量增加[16-17]。本研究结果显示MCAO/R大鼠脑组织中Fe2+含量升高,GSH含量和GPX4水平降低,MDA含量升高,表明脑缺血再灌注诱导铁死亡发生。此外,结果显示PNS下调脑组中MDA和Fe2+含量,上调GSH含量和GPX4水平,表明PNS能抑制脑缺血再灌注中的铁死亡,提示PNS可能通过抑制铁死亡发挥抗CIRI作用。
炎症反应是CIRI机制的重要环节,脑缺血再灌注后炎症细胞活化和TNF-α、IL-1β等促炎因子的分泌,进一步加重炎症反应及血脑屏障和神经细胞损伤[18-19]。实验研究表明,多类中药有效成分和中药复方均能减轻促炎因子的释放和增加抗炎因子的表达,有效控制炎症反应减轻CIRI[20-21]。本研究结果显示,MCAO/R处理后,大鼠缺血侧大脑皮质组织IL-1β、TNF-α和IL-6含量显著升高,而PNS的干预显著降低皮层组织中促炎因子含量,表明PNS在CIRI中能降低促炎因子的含量抑制炎症反应。此外有研究报道铁死亡有较强的促炎作用,铁死亡会导致损伤模式相关分子的释放激活固有免疫,释放促炎因子和活化促炎通路加重炎症反应[22],既往研究揭示铁死亡抑制剂可抑制铁死亡,降低组织中IL-1β和TNF-α含量,抑制炎症反应有效干预脑出血、非酒精肝炎和急性肾损伤等疾病[23-25]。但PNS是否通过抑制铁死亡从而减少促炎因子的释放抑制炎症反应减轻CIRI尚需进一步研究。
综上所述,PNS可减轻MCAO/R大鼠CIRI,其机制可能与抑制铁死亡和炎症反应有关。