白果内酯激活Nrf2/HO-1通路抑制星形胶质细胞的氧化应激缓解CPZ诱导的髓鞘脱失①
鞠文媛 陈阳阳 褚果果 李晓慧 张海飞 宋丽娟 王青 尉杰忠 肖保国 马存根
(山西中医药大学神经生物学研究中心,国家中医药管理局多发性硬化益气活血重点研究室,晋中 030619)
星形胶质细胞是大脑中最大的胶质细胞群体,中枢一旦受损,星形胶质细胞迅速被激活,修复受损组织,恢复神经功能[1]。同时,星形胶质细胞作为血脑屏障后的第一类实质细胞,是抵抗外源性氧化损伤的第一道防线,有其自身的抗氧化防御系统。高活性的抗氧化酶如谷胱甘肽过氧化物酶(glutathi⁃one peroxidase,GSH-Px)、过 氧 化 氢 酶(catalase,CAT)和超氧化 物 歧化酶(superoxide dismutase,SOD)和核因子E2相关因子2/血红素加氧酶-1
(nuclear factor erythroid-2-related factor 2/heme oxy⁃genase 1,Nrf2/HO-1)抗氧化通路等共同抵抗氧化损伤[2]。但在中枢神经系统(central nervous system,CNS)变性疾病中,持续的致病因素的刺激,使得星形胶质细胞的抗氧化体系失控,造成氧化产物释放增多,抗氧化酶的表达降低[3]。所以在该类疾病中,调控星形胶质细胞的抗氧化体系,对于治疗疾病是一种重要的策略。
白果内酯(bilobalide,BB)是从银杏叶中提取出的一种倍半萜内酯,本课题组既往的研究显示其可缓解双环己酮草酰二腙(cuprizone,CPZ)诱导的髓鞘脱失,同时发现BB对CPZ模型病灶区的星形胶质细胞的数量和形态有明显的影响,但是否有抗氧化机制参与并不清楚[4]。另外,有报道在缺血/再灌注模型中,BB可通过对抗缺血/再灌注诱导的氧化应激反应而发挥神经保护作用[5]。基于氧化应激在髓鞘脱失中的重要作用,本研究初步探索了BB对CPZ诱导的脱髓鞘模型中星形胶质细胞氧化应激的影响和作用机制,以期为进一步的深入研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 动物10~12周龄的C57BL/6雄性小鼠共24只,购自北京维通利华实验动物有限公司,许可证号:SCXK(京)2016-0006。实验经山西中医药大学伦理委员会批准。动物在清洁级动物房进行适应性喂养1周后,再进行实验。
1.1.2 试剂与仪器BB(中国南京道斯夫生物科技有限公司);CPZ(美国Sigma公司);脂多糖(lipo⁃polysaccharide,LPS)(中国北京索莱宝科技有限公司);氧化和抗氧化试剂盒(中国上海泛柯实业有限公司);抗体如anti-GFAP(美国Abcam);anti-Nrf2(美国Cell signaling technology);anti-HO-1(中国爱必信);DAPI溶液(中国北京索莱宝科技有限公司);TRITC标记的山羊抗兔IgG二抗(美国Jackson immunoResearch);Alex Flour 488标记的驴抗鸡IgG二抗(美国Jackson immunoResearch);辣根过氧化物酶标记的山羊抗兔IgG二抗(中国武汉博士德生物工程有限公司);荧光显微镜(美国Leica);冷冻切片机(德国Leica)。
1.2 方法
1.2.1 分组与给药24只小鼠按照体质量随机分为正常组、模型组和BB治疗组,每组8只。在饲料粉末中混入0.2%的CPZ制成CPZ饲料。模型组和BB治疗组每天喂食CPZ饲料,正常组喂养正常饲料,共6周。BB治疗组从喂食CPZ饲料的第4周末开始,每天腹腔注射BB 40 mg/(kg·d)1次,200 μl/只,持续给药到第6周末,共2周。正常对照组和模型组每天持续腹腔注射等量的生理盐水2周。
1.2.2 组织制备小鼠用10%水合氯醛麻醉完全后,解剖胸部,暴露心脏,每组随机选取4只,用生理盐水进行心脏灌注后,再用4%多聚甲醛进行心脏灌注,固定完全后取出完整的脑组织,4%多聚甲醛4℃固定2 h,蔗糖梯度脱水,OCT包埋脑组织,制成10 μm的冷冻切片,用于组织的免疫荧光染色。每组中剩下的4只,用生理盐水进行心脏灌注后,冰上取出脑组织,置于玻璃研磨器中,并按照每20 mg组织加入150 μl的比例加入组织裂解液进行研磨,4℃、12 000 r/min离心30 min,取上清液,即为各组脑蛋白提取液,-80℃冰箱保存。
1.2.3 卢卡斯快蓝染色检测胼胝体区域髓鞘脱失情况将脑切片放入提前配好的固蓝染液中,56℃浸泡过夜。次日,95%乙醇和去离子水洗涤,以去除多余的固蓝染液,碳酸锂溶液、75%乙醇溶液和去离子水中反复浸洗,直到能够明显区分灰质和白质。最后,置于梯度乙醇溶液中进行脱水,二甲苯中透明,中性树胶封片,光镜下观察并收集图片,Image-ProPlus6.0计算胼胝体区域的累积光密度。
1.2.4 免疫荧光染色检测脑组织中Nrf2和HO-1的表达脑组织切片从-80℃冰箱取出,室温中静置片刻,置于4%多聚甲醛固定20 min。PBS淋洗,1%BSA封 闭1 h,加入 一 抗anti-GFAP、anti-Nrf2、anti-HO-1,4℃冰箱过夜。次日,PBS淋洗后,加入相应的二抗,室温孵育2 h,PBS淋洗,加入DAPI溶液染10 min,PBS淋洗,50%甘油封片,荧光显微镜下观察拍照,Image-ProPlus6.0软件分析结果。
1.2.5 原代星形胶质细胞的制备新生的C57BL/6小鼠(24 h内出生)若干,75%的乙醇消毒皮肤,无菌超净台中断头,分离出大脑皮层,放于DMEM基础培养液中,用吸管反复吹打,制成细胞悬液。4℃、3 000 r/min离心10 min,弃掉上清,细胞沉淀重悬于DMEM完全培养液(10%胎牛血清,1%青链霉素混合液)中,滤网过滤后,用吸管吹打成单细胞悬液,置于75 cm2培养瓶,在37℃、5%CO2培养箱中培养。第2天更换DMEM完全培养液,培养至第7天,待细胞生长密度达到90%时,置于摇床上,180 r/min持续摇晃12 h,去除小胶质细胞,以达到纯化星形胶质细胞的目的。以上过程重复2~3次。
1.2.6 氧化和抗氧化指标检测收集各组细胞培养上清液,3 000 r/min,离心15 min,取上清液备用。各组脑蛋白提取液,用BCA法定量至相同的蛋白浓度。参照氧化和抗氧化试剂盒说明书检测相关氧化指标如活性氧(reactive oxygen species,ROS)、活性氮(reactive nitrogen species,RNS)和丙二醛(malondialdehyde,MDA)水平和抗氧化指标如CAT、GSH-Px和SOD水平。
1.2.7 Western blot检测原代星形胶质细胞Nrf2和HO-1的表达各组细胞蛋白提取液,按每40 μl的蛋白样本加入10 μl的5×loading Buffer后,沸水煮10 min。根据检测指标的蛋白分子量制胶,进行SDS-PAGE凝胶电泳,后转到PVDF膜上,5%脱脂牛奶封闭1 h后,用TBST稀释一抗Nrf2(1∶500)和HO-1(1∶300),加入到PVDF膜上,4℃过夜。次日,TBST洗去膜上多余的一抗,加入相对应的二抗,室温孵育2 h,TBST漂洗,加入ECL显色液进行显色、拍照。Image J计算每组的灰度值。
1.3 统计学分析应用Graph Pad8.0软件进行统计分析,实验数据符合正态分布用±s表示。多组间比较采用单因素方差分析,两组间均数比较选用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 BB改善了CPZ小鼠的行为学和髓鞘脱失对小鼠进行高架十字迷宫和T迷宫测试,以检测小鼠的焦虑状态和学习能力。如图1所示,高架十字迷宫结果显示,与正常组相比,CPZ组小鼠进入开放臂的次数减少(P<0.001)。与CPZ组相比,BB治疗组小鼠进入开放臂的次数增多(P<0.05)。T迷宫测试结果显示,与正常组相比,CPZ组小鼠在食物臂的运动距离明显缩短(P<0.001)。与CPZ组相比,BB治疗组小鼠在食物臂的运动距离增长(P<0.05)。以上结果表明,BB用药后改善了小鼠的焦虑情绪,提高了学习能力。卢卡斯快蓝染色结果显示,与正常组相比,CPZ组胼胝体区域的髓鞘脱失严重(P<0.01),与CPZ组相比,BB用药组减轻了胼胝体区域的髓鞘脱失(P<0.01)。
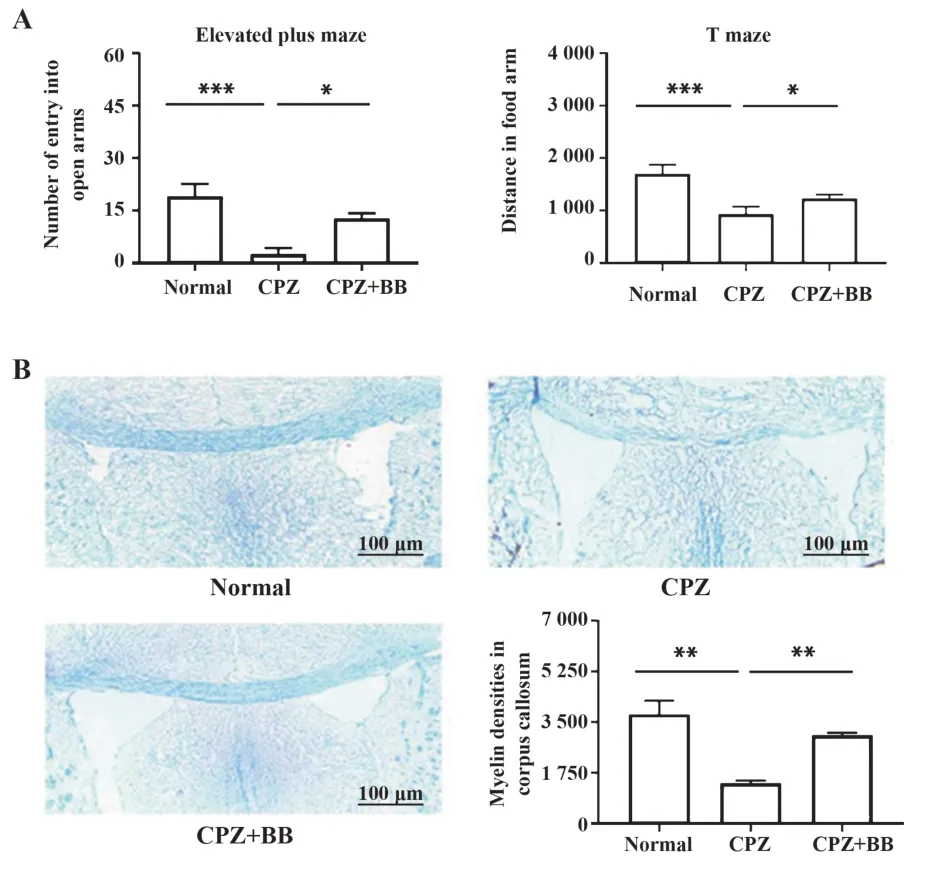
图1 各组小鼠的行为学测试和病理学染色(×50)Fig.1 Behavioral test and pathological staining of mice in each group(×50)
2.2 BB抑制CPZ小鼠氧化应激如图2所示,体内实验结果表明,与正常组相比,CPZ组脑组织中ROS、RNS和MDA等氧化产物的含量增加(P<0.01或P<0.05);CAT、GSH-Px和SOD等抗氧化酶的含量减少(P<0.01或P<0.001)。与CPZ组相比,BB干预后显著下调了小鼠脑组织中氧化产物ROS、RNS和MDA水平(P<0.05),上调了抗氧化酶CAT、GSH-Px和SOD水平(P<0.05)。

图2 BB对CPZ小鼠氧化应激的影响Fig.2 Effects of BB on oxidative stress in CPZ mice
2.3 BB激活CPZ小鼠Nrf2/HO-1信号通路为探究星形胶质细胞是否参与CPZ小鼠脑内的抗氧化过程,小鼠脑片的星形胶质细胞和Nrf2/HO-1抗氧化通路进行免疫荧光染色。如图3所示,与正常组相比,CPZ组小鼠脑内GFAP+Nrf2+/HO-1+的细胞表达增多,并出现Nrf2核转移的情况(P<0.01或P<0.001),表明在氧化应激下,激活了Nrf2/HO-1抗氧化通路。与CPZ组相比,BB用药组小鼠脑内GFAP+Nrf2+/HO-1+细胞表达进一步增多,并且出现Nrf2核转移的星形胶质细胞表达增多(P<0.01),表明BB治疗后可进一步激活脑内Nrf2/HO-1抗氧化通路,并且星形胶质细胞参与到CPZ小鼠体内的抗氧化过程。

图3 BB对CPZ小鼠Nrf2/HO-1通路的影响(×100)Fig.3 Effect of BB on Nrf2/HO-1 pathway in CPZ mice(×100)
2.4 BB抑制LPS刺激的原代星形胶质细胞的氧化应激如图4所示,与正常组相比,LPS组的星形胶质细胞分泌的ROS、RNS和MDA氧化产物增多(P<0.01或P<0.001),分泌的CAT、GSH-Px和SOD抗氧化酶减少(P<0.01或P<0.001)。与LPS组相比,BB用药组显著下调了星形胶质细胞的ROS、RNS和MDA水平(P<0.05或P<0.01),上调了原代星形胶质细胞抗氧化酶CAT、GSH-Px和SOD水平(P<0.05)。
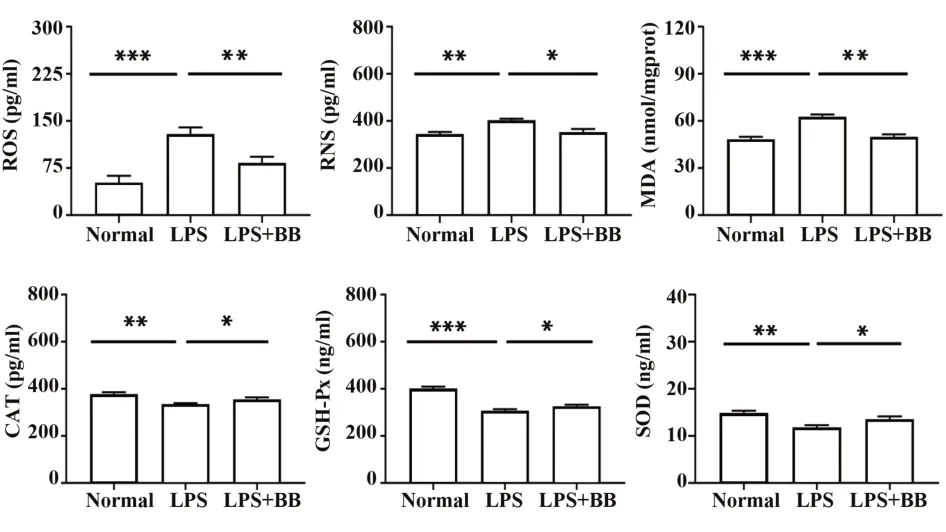
图4 BB对原代星形胶质细胞氧化应激的影响Fig.4 Effect of BB on oxidative stress of primary astrocytes
2.5 BB增加LPS刺激的原代星形胶质细胞Nrf2和HO-1蛋白表达如图5所示,与正常组相比,LPS组中原代星形胶质细胞中Nrf2/HO-1的表达增加(P<0.05);与LPS组相比,BB用药组中原代星形胶质细胞中Nrf2和HO-1蛋白表达显著增加(P<0.01或P<0.001)。
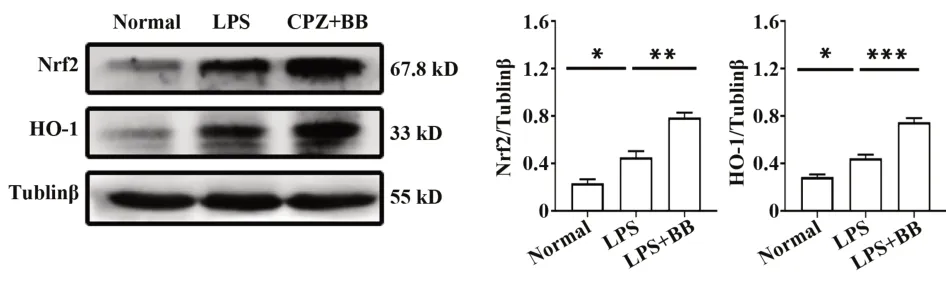
图5 各组原代星形胶质细胞中Nrf2和HO-1蛋白表达Fig.5 Expressions of Nrf2 and HO-1 protein in primary astrocytes of each group
3 讨论
实验结果证实了BB具有良好的抗氧化作用,可以通过抑制星形胶质细胞的氧化应激反应缓解髓鞘脱失。在CPZ小鼠模型中,BB可抑制脑组织中ROS、RNS和MDA氧化产物的产生,上调抗氧化酶CAT、GSH-Px和SOD的水平,并且激活脑内的Nrf2/HO-1抗氧化通路。在星形胶质细胞的体外模型中,BB用药后抑制了氧化产物ROS、RNS和MDA的产生,增加抗氧化酶CAT、GSH-Px和SOD的表达,并且促进了原代星形胶质细胞中Nrf2和HO-1蛋白的表达,表明BB的抗氧化作用可能与其促进星形胶质细胞中Nrf2和HO-1蛋白的表达有关。
星形胶质细胞的异常活化是多发性硬化(multiple slerosis,MS)等CNS炎症变性疾病的主要病理标志之一[6]。在该类疾病中,大多都存在星形胶质细胞功能障碍和抗氧化系统的紊乱,造成神经元死亡等,这可能是其重要的发病机制[7-8]。所以,靶向星形胶质细胞成为当前治疗CNS炎症变性疾病的研究热点。本实验中,本课题组重点关注了星形胶质细胞的氧化应激,通过减轻星形胶质细胞的氧化损伤,达到了保护髓鞘的目的。BB是从银杏叶中提取出的一种安全有效的活性单体[9],文献报道了BB对于神经系统的保护作用[10-11]。另外,文献对BB是否能够通过血脑屏障进行了论述,在体外实验中使用血脑屏障渗透率的模型检测了BB的血脑屏障透过率,体内实验中使用大鼠模型评估了BB的脑内分布,结果发现BB可以较好地通过血脑屏障[12]。在之前的研究中发现,BB具有很好的抗氧化的作用,但是没有关于BB在靶向星形胶质细胞缓解髓鞘脱失方面的研究。
氧化损伤在多种CNS疾病中起关键作用[13]。ROS和RNS的过量产生会导致线粒体功能障碍和细胞死亡[14],研究发现在MS等疾病患者的脑内,氧化应激导致ROS等氧化产物增多,与胶质细胞异常活化和神经元损伤有很大的关系[15-16]。因此,减轻氧化应激是治疗和预防MS等神经炎症变性疾病的潜在策略。在机体的抗氧化防御体系中,CAT、GSH-Px和SOD是最常见的抗氧化酶,也是清除ROS、RNS和MDA等氧化产物的重要指标[17]。SOD是活性氧损伤的第一道防线,可降低过高浓度的活性氧物质,并把他们分解为危害较小的过氧化氢和水,保护细胞免受损伤[18]。CAT则通过将过氧化氢分解水和氧分子,进一步对抗氧化损伤[19]。GSH-Px是一种体内抵抗氧化应激过程中重要的过氧化物分解酶,通过把有毒的氧化产物谷胱甘肽催化为无毒的氧化型谷胱甘肽,从而保护细胞免受氧化物的损伤[20]。本研究发现,BB可增加星形胶质细胞中这些抗氧化酶的表达,其机制可能与激活Nrf2/HO-1抗氧化通路有关。抗氧化的信号通路有很多种,Nrf2/HO-1信号通路是其中一条重要的通路[21]。Nrf2是抗氧化反应中不可或缺的调控因子,在正常情况下,其活性被抑制,kelch样ech相关蛋白1(kelch-like ech-associated protein 1,Keap1)与Nrf2在细胞质中结合,这时Nrf2是处于未激活状态;如果一直未激活,Nrf2会被泛素化进而被降解;在氧化应激状态下,Nrf2被激活。Nrf2从Keap1中释放,转移至细胞核,激活下游抗氧化基因的表达,包括HO-1以及抗氧化酶CAT、GSH-Px和SOD[22-23]。本次研究表明,BB干预促进Nrf2向细胞核内的转移,促进Nrf2下 游 基 因HO-1及 抗 氧 化 酶CAT、GSH-Px和SOD的表达。研究显示,通过上调Nrf2和HO-1的表达来保护细胞损伤,对MS等疾病都有神经保护作用[24]。在临床上,靶向Nrf2的药物富马酸二甲酯是治疗进展型MS的高效药物,与其可以透过血脑屏障、减少炎症细胞迁移、减少细胞的氧化损伤有关,从而可降低患者的复发率[25]。而BB对星形细胞Nrf2/HO-1信号通路的作用,为其治疗MS等脱髓鞘疾病提供了新的理论支持。
大量实验研究提示氧化应激和脱髓鞘之间存在某种因果关系[25-27]。氧化应激是导致CPZ模型中发生脱髓鞘病变的主要原因之一。氧化应激可产生过多的氧自由基及其代谢产物,引发细胞脂质和线粒体损伤,导致髓鞘脱失。在疾病的早期阶段,氧化应激是导致脑内脱髓鞘的主要病因,而随着病情的发展,体内内环境的紊乱,使得体内氧化应激和脱髓鞘病变互为因果,使得病情进一步加重[28]。本课题组利用CPZ诱导的中枢脱髓鞘模型,发现BB干预可有效保护髓鞘脱失,诱导Nrf2/HO-1信号通路,从而增加抗氧化产物形成,抑制氧化应激反应,推测可能与髓鞘保护有关。在此基础上,利用体外原代星形胶质细胞,验证了BB干预可诱导星形胶质细胞Nrf2/HO-1信号分子表达,从而增加抗氧化产物形成,抑制氧化应激反应。基于前人研究和本文的结果,本课题组推测BB干预缓解髓鞘脱失,可能与促进星形胶质细胞Nrf2/HO-1信号通路,产生抗氧化产物,抑制氧化应激有关。但鉴于星形胶质细胞氧化应激与脱髓鞘之间的重要关系,下一步将进行深入的探讨。
综上所述,本实验表明,BB可以抑制星形胶质细胞的氧化应激反应,可能通过激活Nrf2/HO-1抗氧化通路发挥髓鞘保护作用,为下一步深入的研究奠定了基础。