薏米和芡实对实验小鼠肠道菌群的影响
邢志青 丁海燕 王金龙 任国领 胡敏 张奕婷 邵小强 于波

摘 要:为探究薏米、芡实对小鼠肠道菌群的调节作用,将小鼠分薏米、芡实、对照3组喂养,喂食15d,观察3组小鼠状况、体重和肠道菌群的变化,取喂养15d的小鼠粪便为实验材料,16s基因测序法对肠道菌群多样性检测。结果表明,薏米、芡实均可以使小鼠体内的乳酸菌增多,大肠杆菌减少,喂食薏米和芡实15d均使小鼠肠道菌群的多样性降低。
关键词:肠道菌群;微生态调节;薏米;芡实
中图分类号 R285 文献标识码 A 文章编号 1007-7731(2022)02-0048-03
Abstract: In order to explore the regulatory effect of Coix seed and Gordon euryale seed on intestinal microflora of mice, the mice were divided into coix seed, Gordon euryale seed and control group and fed for 15 days. The body weight and intestinal microflora of the mice in the three groups were observed. Feces of mice fed for 15 days were used as experimental materials, and the diversity of intestinal flora was detected by 16S gene sequencing method. The results showed that coix seed and Euryale seed could increase lactobacillus and decrease escherichia coli in mice. Feeding coix seed and Euryale seed for 15 days reduced the diversity of intestinal flora in mice.
Key words: Intestinal flora; Microecological regulation; Coix seed; Gordon euryale seed
薏米、芡实是中药,也是生活中常食用的保健粮食。薏米有许多药用价值,常食薏米可促进新陈代谢和血液循环;芡实具有益肾固精、补脾止泻、祛湿止带的功效。近年来,随着微生态学的理论、研究方法及与中药学的研究相结合,许多研究学者发现中药药理有着维持肠道内菌群平衡的作用[1]。中药从消化、营养吸收、脂肪代谢、免疫调节、药物代谢等诸多方面影响着人和动物的健康状况[2]。肠道正常菌群因环境、饵料、宿主行为和基因型等的不同而有所差异,但总体上处于相对稳定的状态。通过改变饮食习惯,改变肠道内的微观环境,同时肠道微生物可通过还原反应、水解反应等方式对中药进行代谢转化[3]。经过一系列反应后被人体吸收,从而达到治疗效果。在实验动物中,目前已经有小鼠的肠道菌群代谢产物研究,肠道菌群多样性影响因素研究等[4]。王广在党参多糖对肠道菌群失调小鼠的研究中发现,党参多糖对双歧杆菌有促进生长的作用[5]。党参多糖能够对肠道一些致病菌发挥生物拮抗作用[6]。鄢伟伦研究证实,白术高剂量组的双歧杆菌和乳杆菌的数量增多,肠杆菌减少[7]。郭丽双等对肠道菌群失调小鼠模型灌胃后,结果显示,长期灌胃山药多糖对小鼠的肠道菌群有着显著影响[8]。小鼠肠道肠杆菌、肠球菌水平受抑制,而双歧杆菌、类杆菌水平明显升高[9]。此外,诸多清热解毒中药也具有调节肠道菌群的能力[10]。
在肠道微生态系统中,各种微生物与宿主经过长期的协同进化,在调节宿主生理生化反应、介导宿主免疫应答和抵制宿主疾病发生等方面发挥着重要的作用,以至于被认为是动物额外的器官。动物肠道内生活着大量的微生物,包括真核微生物、细菌、古菌和病毒等。这些与肠道联系紧密的共生菌群,与宿主相互作用,共同维系整个肠道生态系统平衡与稳定。中药的单一成分、或不同剂量均可影响肠道菌群的数量和组成结构,不同种类和不同浓度的中药对肠道菌群的影响也不尽相同。为此,笔者通过薏米、芡实对小鼠肠道微生物的影响研究,以期为探索饮食对人体肠道微生态的调控及影响关系提供参考。
1 材料与方法
1.1 材料
1.1.1 实验小白鼠 购于长春市亿斯实验动物技术有限责任公司,微生物等级为SPF级。
1.1.2 试剂 常规鼠粮、薏米鼠粮、芡实鼠粮、DNA提取试剂盒等。
1.2 方法
1.2.1 鼠粮制备 将400g薏米打成粉加水100mL,揉捏成短棒状与小鼠常规鼠粮一样大小,放入100℃烘箱烘3h;取芡实400g也打成粉狀,加水100mL揉捏成短棒状,与薏米一同放入烘箱烘干。
1.2.2 小鼠处理 将小鼠分成3组,即薏米组、芡实组、对照组,各5只。薏米组小鼠每只每天喂食4g薏米+4g鼠粮;芡实组小鼠每只每天喂食4g芡实+4g鼠粮;对照组每天每只喂食8g鼠粮。给予15只小鼠每天充足的自来水。每天观察小鼠活动状态,2~3d更换1次垫料,喂食15d[11]。
1.2.3 收集小鼠粪便 将吸水纸裁成鼠笼底部大小。将镊子、冻存管、吸水纸于高压灭菌锅121℃灭菌15min,将灭菌后晾干的吸水纸铺在清洁好的鼠笼内底部,将小鼠放入,用灭过菌的镊子收集其排在纸上的粪便迅速放入冻存管中。
1.2.4 16SrDNA高通量测序 样本基因组DNA的提取与质检,16S/18S/ITS rDNA可变区扩增与测序文库构建,高通量测序,在金维智生物公司完成。
2 结果与分析
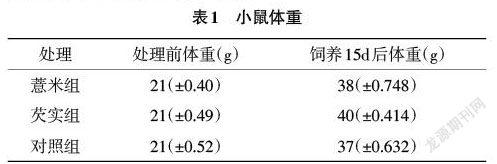
2.1 对小鼠体重的影响 由表1可知,喂食芡实和薏米的小鼠的体重都比喂食正常鼠粮的小鼠增长得快,其中喂食芡实的小鼠体重增长最快。
2.2 16SrDNA检测结果分析
2.2.1 样本物种 喂食不同鼠粮对小鼠肠道菌群的影响,各样本在不同分列水平下物种数目统计见表2。表中的数字代表各样本在其水平上有多少个物种,薏米在纲水平上的物种数有12种,芡实和对照在纲水平上的物种数有14种;薏米在属水平上的物种数有26种,芡实在属水平上的物种数有28种,对照组在属水平上的物种数有32种。
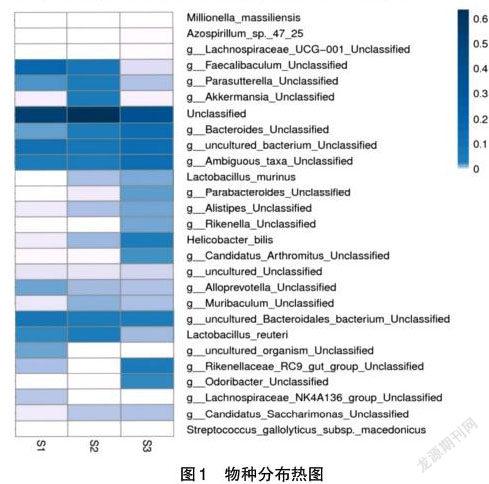
根据各样本在不同水平下(门、纲、目、科、属、种)Top30的物种分布绘制为聚类热图,通过热图颜色差异可直观显示各物种丰度的相似性与差异性,以不同分类水平各样本的菌种分布绘制热图展示如图1所示。
在上图中第一列S1为薏米组物种分布,S2为芡实组的物种分布,S3为对照组的物种分布。S1中排在前5位的優势菌群分别有Unclassified(未归类的)、Faecalibaculum(粪便细菌)、uncultured bacterium Unclassified(未培养细菌)、Ambiguous taxa unclassified(模糊的分散群)、uncultured bacteroidales bacterium Unclassified(未分类培养的拟杆菌),在S2中排在前5位的优势菌群有Unclassified(未归类的)、Faecalibaculum unclassified(未分类的粪便细菌)、Akkermansia unclassified(杜尔氏菌属)、Bacteroides(类杆菌属)、Lactobacillus reuteri(罗伊氏乳杆菌),S3中排在前5位的优势菌群有Unclassified(未归类的)、Bacteroides(类杆菌属)、uncultured bacterium Unclassified(未培养细菌)、Helicobacter bilis(胆汁螺杆菌)、Rikenellaceae(理研菌科)。
各样本在属水平序列数统计排在前5位的详见表3。由表3可知,薏米组乳酸杆菌序列数为6020,芡实组乳酸杆菌序列数为5936,对照组乳酸杆菌序列数为794个,所以薏米、芡实使小鼠肠道内的乳酸杆菌数量明显高于对照组,且二者均抑制类杆菌属生长。薏米组的双歧杆菌的序列数是对照组的20多倍。
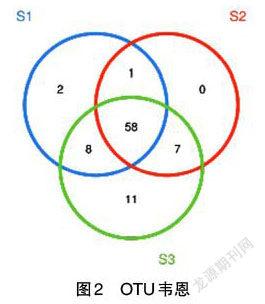
2.2.2 物种相对丰度分析 如图2所示,不同颜色的圈表示不同的样本,数字分别代表了每个样本特有或共有的OTU数目。个OTU即代表个菌群。图中S3是对照组绿色的圆圈,包含84个OTU,个OTU可视为个菌群,即84个群落,其中有58个OTU为3个样本共有,S2是芡实组红色的圆圈,包含66个OTU,其中有65个OTU与对照组相同,仅有1个与对照组不同,S1是薏米组蓝色的圆圈,包含69个OTU,有3个不同于对照组的OTU。从菌群的种类数上看,薏米和芡实组的菌群丰度明显低于对照组。
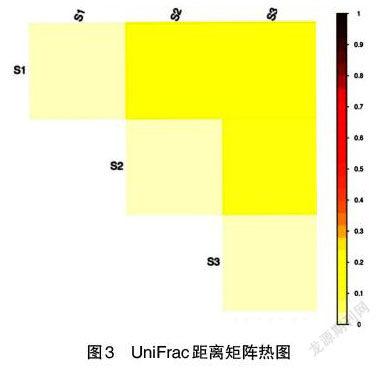
2.2.3 菌群β多样性分析 β多样性值为2个样本间的相异系数,反映不同样本间的多样性的差异,利用各样本序列间的进化和丰度信息计算样本间的距离,反映样本间是否有显著的微生物群落差异,可通过UniFrac分析实现。在图3,距离矩阵热图中颜色深浅代表了样本两两之间的相异程度,颜色越浅表示2个样本相异系数越小,物种多样性的差异越小。由图3可知,S1薏米组和S3对照组的微生物群落差距呈黄色在0.2以上,S2芡实组和S3对照组差异较小呈浅黄色在0.1~0.2。
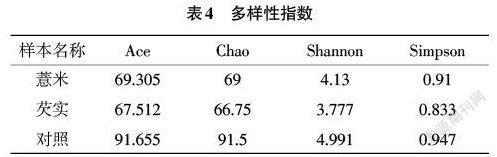
2.2.4 菌群α多样性分析 群落生态学中,α多样性可以反映微生物群落中物种的数目,通过一系列统计学指数的分析来估计环境群落的物种丰度和多样性。表4为α多样性指数统计表。其中ACE和Chao是生态学中用来估计物种总数的常用指数,其数值越高表示其菌群丰度越高,其中Shannon和Simpson是生态学中用来描述微生物多样性。从表4中可以看出,喂食薏米和芡实均会影响小鼠肠道菌群的丰度,喂食薏米和芡实这2种食用型中药会使肠道菌群丰度降低,肠道菌群多样性也比对照组略低。
3 讨论
薏米和芡实喂量对菌群的影响,小鼠每天食用的鼠粮是一定的,但是中药和鼠粮的比例对实验结果有一定影响[12-13],本次实验选择中药与鼠粮1∶1的比例进行喂食,2∶1或者1∶2等其他比例喂食对肠道菌群有什么样的影响还有待研究。薏米、芡实均可以使小鼠体内的乳酸菌增多,大肠杆菌减少,喂食薏米和芡实15d均使小鼠肠道菌群多样性降低,薏米和芡实对脾胃的调理作用的机制可能与它们影响肠道菌群的微生态有关。
参考文献
[1]王瑶,季宇彬,陈明苍.中药与肠道菌群相互作用的研究进展[J].中国医药导报,2012,9(02):12-13.
[2]李伟.几种常用实验动物与人肠道主要菌群多样性比较[D].重庆:西南大学,2011:4-5.
[3]李寒冰,吴宿慧,张颜语,等.中药与肠道菌相互作用研究进展[J].中成药,2016,38(01):147-151.
[4]丁硕.九种健脾胃中草药对三种典型益生菌体外生长及溃疡性结肠炎大鼠的影响[D].保定:河北农业大学,2013:2-4.
[5]Savage. Microbial Ecology of the Gastrointestinal Tract[J]. Annual Review of Microbiology,1977,31:107-133.
[6]王广.党参多糖对肠道菌群失调小鼠的调整作用机制的初步研究[D].佳木斯:佳木斯大学,2010:8-9.
[7]罗瑞静,柴维汉.中草药对肠道菌群影响的研究进展[D].上海中医药大学学报,2013,30:86,89.
[8]高启禹,赵英政,张凌波,等.山药多糖对昆明种小鼠生长性能及肠道菌群的影响.中国老年学杂志,2015,10:5685-5687.
[9]郭蕾.乳酸菌对小鼠肠道菌群失衡的调节作用研究[D].扬州:扬州大学,2017:6-7.
[10]Yamashiro.Gut Microbiota in Health and Disease[J].Annals of Nutrition &Metabolism,2018,71(3-4):242-246.
[11]姜美娟,梁冰.人体肠道菌群定量技术研究进展[J].航空航天医学杂志,2011,22(03):281-283.
[12]靳志敏,张宏博,刘夏炜,等.不同剂量植物乳杆菌对小鼠肠道菌群的影响[J].食品工业科技,2014,11(36-37):342-345.
[13]张迪,田晔,胡昀昭,等.中药对肠道菌群的影响探讨[D].淮南:安徽理工大学,2018:2-3.
(责编:张宏民)

