脑蛛网膜下腔出血患者血清ICAM-1、TGF-β1、PKC水平与预后的相关性*
任彩霞,余永平,姜 超,孔静渊
1.陕西省榆林市第二医院神经内二科,陕西榆林 719000;2.西安医学院第二附属医院神经内三科,陕西西安 710038;3.陕西中医药大学第一附属医院脑病医院脑病二科,陕西咸阳 712000
蛛网膜下腔出血是一种破坏性疾病,经常导致死亡或神经系统功能缺陷[1]。蛛网膜下腔出血后发生脑血管痉挛被认为是导致高病死率和再出血率的重要原因[2],目前手术治疗取得了一定效果,但是受医疗设施、水平及诊疗手段的限制,蛛网膜下腔出血的预后并不佳,这给家庭和社会带来了沉重的负担。细胞间黏附分子-1(ICAM-1)是一种在白细胞中表达的免疫球蛋白样分子,是淋巴细胞功能相关抗原1和巨噬细胞抗原-1(Mac-1)的重要内皮配体,参与众多炎性反应机制,影响蛛网膜下腔出血后炎性反应和脑血管痉挛[3]。转化生长因子-β1(TGF-β1)属于调节细胞生长和分化的TGF-β超家族,有研究表明,rhDecorin可以通过抑制TGF-β1介导的信号通路途径,防止脑积水的发生和减轻蛛网膜下腔出血后的长期神经认知缺陷,从而抑制细胞外基质的积聚和蛛网膜下纤维化[4]。蛋白激酶C(PKC)是G蛋白偶联受体系统中的效应物,在脑血管痉挛的发生和维持中起着关键作用,PKC抑制剂对蛛网膜下腔出血后脑血管痉挛的具有减轻作用[5]。本研究通过分析脑蛛网膜下腔出血患者血清ICAM-1、TGF-β1、PKC与预后的相关性,以期为脑蛛网膜下腔出血治疗提供研究思路。
1 资料与方法
1.1一般资料 选取2019年4月至2020年3月榆林市第二医院收治并诊断为蛛网膜下腔出血患者48例作为病例组,其中男30例、女18例,年龄37~75岁、平均(53±13)岁。入选标准:符合蛛网膜下腔出血临床诊断标准,经过腰椎穿刺术或颅脑 CT 确诊,无其他严重并发症。对照组来自同期该院体检健康者,共计24例,男、女各12例,年龄21~69岁、平均(51±13)岁。本研究通过医院伦理委员会批准,受试者及家属签订知情同意书。病例组和对照组性别、年龄等一般资料比较,差异无统计学意义(P>0.05)。
1.2血液标本的采集 分别于入院24 h内(急性期)及治疗3周后(恢复期)采集病例组外周静脉血2次,每次4 mL,并收集到无任何添加剂的普通血液收集管中,立即放入4 ℃的冰箱中静置1 h。然后取出标本,室温下以3 500 r/min离心15 min分离血清,保存于-80 ℃。采集对照组体检时空腹静脉血,标本处理同上。
1.3血清ICAM-1、TGF-β1、PKC水平检测 采用酶联免疫吸附试验(ELISA)测定血清ICAM-1和TGF-β1水平,所有操作按照试剂盒说明书进行。采用放射免疫法检测血清PKC水平。
1.4血气分析指标检测 使用血气分析仪检测蛛网膜下腔出血患者急性期、恢复期动脉血氧分压(PaO2)、二氧化碳分压(PaCO2)、pH值。
1.5预后 观察病例组患者急性期、恢复期的格拉斯哥昏迷评分(GCS)。GCS评分包括睁眼反应、语言反应和肢体运动3个方面。(1)睁眼反应。4分:自然睁眼,靠近患者时,患者能自主睁眼,术者不应说话、不应接触患者;3分:呼唤会睁眼,正常音量呼叫患者,或高音量呼叫,不能接触患者;2分:有刺激或痛楚会睁眼,先轻拍或摇晃患者,无反应后予强刺激,如以笔尖刺激患者第2或第3指外侧,并在10 s内增加刺激至最大(若仅皱眉、闭眼、痛苦表情,则不能评为2分);1分:刺激无反应;C分:因眼肿、骨折等不能睁眼。(2)语言反应。5分:说话有条理,定向能力正确,能清晰表达自己的名字、居住城市或当前所在地点、当时年份和月份;4分:可应答,但有答非所问的情形,定向能力障碍,有答错情况;3分:可说出单字,完全不能进行对话,只能说简短句或单个字;2分:可发出声音,对疼痛刺激仅能发出无意义叫声;1分:无任何反应;T分:因气管插管或切开而无法正常发声;D分:平素有言语障碍史。(3)肢体运动。6分:可按指令完成2次不同的动作;5分:施以疼痛刺激时,可定位出疼痛位置,能移动肢体尝试去除刺激(疼痛刺激以压眶上神经为金标准);4分:对疼痛刺激有反应,肢体会回缩;3分:对疼痛刺激有反应,肢体会弯曲,呈“去皮质强直”姿势;2分:对疼痛刺激有反应,肢体会伸直,呈“去脑强直”姿势;1分:无任何反应。得分为整数,最高分为15分,表示意识清楚,12~14分为轻度意识障碍,9~11分为中度意识障碍,8分及以下为昏迷。分数越低则意识障碍越重。
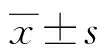
2 结 果
2.1两组血清ICAM-1、TGF-β1、PKC水平比较 病例组急性期和恢复期血清ICAM-1、TGF-β1、PKC水平明显高于对照组(P<0.05),恢复期血清ICAM-1、TGF-β1、PKC水平明显低于急性期(P<0.05),见表1。恢复期患者血清ICAM-1、TGF-β1水平与PKC水平呈正相关(r=0.617、0.589,均P<0.05)。
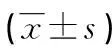
表1 两组血清中ICAM-1、TGF-β1、PKC水平比较
2.2病例组患者急性期、恢复期血气分析指标及GCS评分比较 病例组患者恢复期PaO2、pH值、GCS评分较急性期升高,而PaCO2较急性期下降,差异均有统计学意义(P<0.05)。见表2。
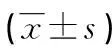
表2 病例组患者急性期、恢复期血气分析指标比较
2.3血清ICAM-1、TGF-β1、PKC水平与血气分析指标、GCS评分的相关性分析 Pearson相关分析结果显示,恢复期患者血清ICAM-1、TGF-β1、PKC水平与pH值、PaO2及GCS 评分呈负相关,与PaCO2呈正相关。见表3。
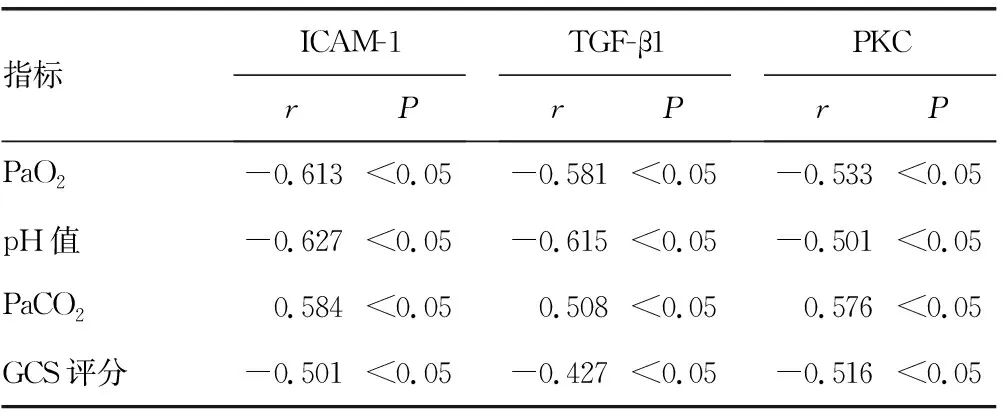
表3 血清ICAM-1、TGF-β1、PKC水平与血气分析指标的相关性
3 讨 论
蛛网膜下腔出血是指蛛网膜下腔——蛛网膜和大脑周围的脑膜之间的区域内,来自血液和血管成分的各种血管活性物质和促炎因子与蛛网膜下腔中的渗出的血液一起释放的过程。在全世界范围内,蛛网膜下腔出血有着高发病率和高死亡率,并且预后不佳[6-7]。迄今为止,尚没有一种可以完全预防蛛网膜下腔出血后脑损伤的明确治疗方法,明确治疗指标与预后的相关性对蛛网膜下腔出血的治疗和预后改善意义重大。
研究表明,与对照组相比,蛛网膜下腔出血患者的ICAM-1水平显著升高[8]。由于存在严重的糖基化和其他结构特征,ICAM-1有许多免疫相关配体的结合位点,研究发现,ICAM-1是淋巴细胞功能相关抗原-1(LFA-1)的配体,LFA-1是白细胞上发现的受体[9]。LFA-1被激活后,白细胞可以通过ICAM-1/LFA-1与内皮细胞结合,然后迁移到组织中[10]。ICAM-1还可以调节基质金属蛋白酶(MMP)家族蛋白的表达[11],参与多种炎性疾病的治疗。结果还表明ICAM-1与蛛网膜下腔出血的病理生理后果有关,蛛网膜细胞可以通过脑脊液中高水平的TNF-α调控ICAM-1的高表达。
TGF-β1参与众多炎性反应机制,在间充质干细胞(MSC)移植治疗蛛网膜下腔出血的研究中发现,MSC移植可明显降低蛛网膜下腔出血后TGF-β1的水平上调和Smad2/3磷酸化,减轻蛛网膜下腔出血诱导的慢性脑积水,炎症细胞因子的上调和行为障碍,并且通过敲低TGF-β1的表达也能发挥同样的作用[4]。有研究表明,蛛网膜下腔出血后脑积水后导致蛛网膜下腔纤维化的致病机制,可能是通过减少脑脊液的循环和吸收[12]。而TGF-β1是促纤维化分子,被发现与慢性脑积水有关。已有研究发现,抑制凝血酶敏感蛋白1(TSP1)介导的TGF-β1活性来抑制蛛网膜下纤维化,预防慢性脑积水的发生并改善蛛网膜下腔出血后的长期神经认知缺陷[13]。CHEN等[4]的研究表明,在蛛网膜下腔出血大鼠模型中发现抑制TGF-β1介导的信号通路途径可减轻慢性脑积水和炎性反应。LI等[14]的研究也表明,凝血酶诱导的TGF-β1过表达及其下游因子的激活可能是蛛网膜下腔出血后脑积水发生的重要原因机制。
PKC在蛛网膜下腔出血发生、发展过程中也发挥着重要作用。SUN等[5]研究表明,抑制PKC信号通路可以有效降低蛛网膜下腔出血后的脑血管痉挛。YANG等[15]研究发现,PKC信号转导途径通过调节连接蛋白43(Cx43)水平,参与蛛网膜下腔出血后脑血管痉挛的发展。在本研究中,通过收集蛛网膜下腔出血患者治疗前后血液标本,检测结果发现,与对照组相比,急性期患者和恢复期患者血清ICAM-1、TGF-β1、PKC水平明显升高;与急性期患者相比,恢复期患者血清ICAM-1、TGF-β1、PKC水平及PaCO2降低,而PaO2、pH值及GCS评分均上升,且恢复期患者血清中ICAM-1、TGF-β1、PKC水平与PaO2水平呈负相关,与pH值水平呈负相关,与GCS评分也呈负相关,而与PaCO2呈正相关。
本研究发现,血清中ICAM-1、TGF-β1、PKC及预后密切相关,可以作为蛛网膜下腔出血的潜在预测指标。但是目前的研究仅停留于理论依据,本结论还需要更多的实验数据验证。

