卵巢癌患者外周血sHLA-G表达水平及临床意义
周李宁,陈 彤,陈 相,洪 宏,赵 枰△
1.江苏省南通市第一人民医院检验科,江苏南通 226001;2.江苏省南通市中医院检验科,江苏南通 226000
卵巢癌是女性最常见的恶性肿瘤之一,死亡率居妇科恶性肿瘤之首,究其原因为其发病隐匿,早期症状不明显致就诊率低下,以及疾病进展迅速,大多数初诊时已属晚期,预后差。目前,仍缺乏有效的卵巢癌早期筛查手段,发病有年轻化的趋势,严重威胁女性的生命健康。糖类抗原125(CA125)及人附睾上皮蛋白4(HE4)是目前临床应用最为广泛的卵巢癌诊断及预后评估的血清学指标,但其受干扰因素较多,诊断准确性不高,卵巢癌确诊除了手术病理仍依赖于有创伤性的穿刺活检。外泌体是由细胞分泌的一种囊泡样小体,起初被认为是细胞分泌垃圾的方式,随后研究发现其携带多种生物活性分子,并介导着细胞间的信号传递,其功能的研究备受关注[1]。外泌体广泛存在于血液、尿液、唾液、腹水、胸腔积液等体液中,具有稳定性好、肿瘤特异性高及与肿瘤的分期和预后相关等优势,有望成为新的肿瘤特异性早期诊断标志物[2]。血浆来源的外泌体可表达一些免疫抑制分子,调节免疫细胞的功能,破坏机体抗肿瘤的免疫力[3]。有报道显示,卵巢癌患者血浆外泌体中富含白细胞介素(IL)-10、转化生长因子β1(TGF-β1)等免疫抑制因子[4]。人类白细胞抗原(HLA)-G属于非经典HLA Ⅰ类分子,其初始转录产物经剪切后可编码产生4种膜结合型和3种可溶性型异构体,是免疫抑制分子之一,可通过与免疫细胞上的受体结合,抑制自然杀伤细胞的活性、效应性T细胞的增殖,诱导调节性T细胞的产生及相关细胞因子的释放等方式参与机体的免疫耐受和肿瘤的免疫逃逸[5-6]。有研究表明,HLA-G不仅表达于肿瘤细胞表面、游离在体液中,还可被整合进外泌体中[7]。但有关卵巢癌患者外泌体可溶性HLA-G(sHLA-G)的功能及临床意义报道甚少。本研究通过检测卵巢癌患者外周血(血浆及外泌体)中sHLA-G的表达水平并分析其临床意义。
1 资料与方法
1.1一般资料 选取2018年1月至2020年12月南通市第一人民医院(以下简称本院)收治的卵巢癌患者41例及卵巢良性肿瘤患者34例分别作为卵巢癌组及卵巢良性肿瘤组。卵巢癌组患者抽血前均未应用激素治疗及放化疗,术后有明确病理诊断,病历资料完整;年龄32~75岁,平均(55.7±12.6)岁;病理类型:浆液性癌19例,非浆液性癌22例;临床分期:Ⅰ~Ⅱ期15例,Ⅲ~Ⅳ期26例;病理分化程度:低分化25例,中、高分化16例。卵巢良性肿瘤组患者年龄35~73岁,平均(50.9±11.4)岁,均排除心、肝、肾等重要脏器疾病及糖尿病等慢性疾病。另选取本院体检中心体检健康女性30例作为健康对照组,年龄36~71岁,平均(50.4±13.8)岁。3组年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。所有受试者对本研究知情并签署知情同意书。本研究经本院伦理委员会审批通过。
1.2仪器与试剂 FACSCalibur流式细胞仪购自美国BD公司。exoEasy Maxi试剂盒购自德国Qiagen公司,PE-Cy7-CD63、Fc受体阻断剂购自美国BD公司,FITC-2A12/HLA-G购自捷克Exbio公司,乳胶微粒购自美国Life Technologies公司,sHLA-G 酶联免疫吸附试验(ELISA)试剂盒购自捷克BioVendor公司。
1.3方法
1.3.1外泌体提取 采集健康体检者体检时及患者术前外周血约2 mL,使用乙二胺四乙酸二钾(EDTA-K2)抗凝,混匀,1 000×g离心10 min,取血浆约1 mL,按照exoEasy Maxi试剂盒说明书操作提取血浆外泌体,洗脱液洗脱至EP管中,-70 ℃冰箱保存备用。
1.3.2FCM检测外泌体sHLA-G 在流式管底部依次加入含外泌体的洗脱液100 μL,磷酸盐缓冲液(PBS)1 mL,轻轻涡动混匀约3 s,静置15 min;加入乳胶微粒溶液5 μL,摇摆孵育30 min,再加入含甘氨酸的BSA溶液1 mL,轻轻涡动混匀约5 s,孵育30 min,3 000×g离心5 min,弃上清,PBS洗涤3次,每次迅速回正,避免乳胶微粒丢失,流式管中约剩200 μL,加入Fc受体阻断剂5 μL,封闭10 min,加入PE-Cy7-CD63抗体和FITC-2A12/HLA-G抗体各5 μL,轻轻涡动混匀约10 s,室温避光孵育1 h,500×g离心5 min,PBS洗涤3次,4%多聚甲醛固定,200 μL缓冲液重悬,上机检测。sHLA-G表达情况以sHLA-G阳性所占CD63阳性比例计,CD63阳性为外泌体标志物。
1.3.3ELISA检测血浆sHLA-G 表达水平 严格按照sHLA-G ELISA试剂盒说明书操作,设置空白管、标准管和待测样品孔对血浆sHLA-G 表达水平进行检测,底物显色后用酶标仪450 nm 波长测定各孔吸光度,再由标准曲线计算出血浆sHLA-G 水平。
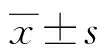
2 结 果
2.13组外周血外泌体sHLA-G阳性占比比较 FCM检测结果显示,卵巢癌组外周血外泌体sHLA-G阳性占比为(73.8±14.7)%,良性肿瘤组为(45.8±11.2)%,健康对照组为(42.9±9.3)%,3组差异有统计学意义(P<0.01);卵巢癌组明显高于良性肿瘤组和健康对照组(P<0.05),而良性肿瘤组与健康对照组差异无统计学意义(P>0.05)。
2.23组血浆sHLA-G水平比较 ELISA检测结果显示,卵巢癌组血浆sHLA-G水平为118.7(80.3,163.4)U/mL,良性肿瘤组为44.3(36.6,51.4)U/mL,健康对照组为41.7(30.6,47.8)U/mL,3组差异有统计学意义(P<0.01);卵巢癌组明显高于良性肿瘤组和健康对照组(P<0.01),而良性肿瘤组与健康对照组差异无统计学意义(P>0.05)。
2.3不同临床病理特征卵巢癌患者外周血sHLA-G水平比较 不同临床分期卵巢癌患者外泌体sHLA-G阳性占比比较,差异有统计学意义(P<0.05);不同病理分化程度卵巢癌患者血浆sHLA-G比较,差异有统计学意义(P<0.05),见表1。Spearman相关分析显示,外泌体sHLA-G与血浆sHLA-G无相关性(r=0.321,P>0.05)。
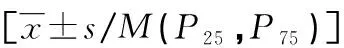
表1 不同临床病理特征卵巢癌患者外周血sHLA-G水平比较
3 讨 论
sHLA-G包括1种由基质金属蛋白酶水解HLA-G1跨膜肽链脱落产生的shedded HLA-G1,以及3种缺乏跨膜区、细胞质区的以分泌可溶性形式存在的HLA-G5、-G6、-G7[8]。sHLA-G能在多种体液中被检测到,包括外周血、尿液、腹水等,血液或体液sHLA-G通过与相应受体结合,可直接发挥免疫抑制效应,亦可诱导调节性T细胞产生及某些细胞因子释放间接发挥长效的免疫抑制作用[9]。sHLA-G异常表达与机体的多种生理、病理过程相关,从最初的母胎界面的免疫耐受到一些免疫豁免组织相关的感染免疫、移植免疫及自身免疫性疾病等,进一步延伸至肿瘤细胞的免疫逃逸等[10-11]。有研究显示,肿瘤细胞自身可以分泌sHLA-G,在大多数实质性肿瘤的病灶区或患者体液中均可检测到sHLA-G的高表达,其发挥着免疫抑制效应,影响肿瘤发生部位微环境及外周循环系统的抗肿瘤免疫应答[12-13]。有研究表明,在卵巢癌患者的恶性腹水中sHLA-G水平呈高表达,sHLA-G水平可以预测卵巢癌的预后,原发性卵巢癌组织中HLA-G表达亦明显增高,体外培养卵巢癌细胞系SKOV3细胞毒试验显示,HLA-G可通过抑制NK92的溶细胞作用,表现为免疫抑制效应使卵巢癌细胞免疫逃逸,提示sHLA-G可作为卵巢癌一个潜在的肿瘤标志物[14]。外泌体是源于细胞膜内陷形成并分泌的多囊泡,含有膜脂质、蛋白质及细胞质中的蛋白质、核酸等,癌症状态下肿瘤细胞源性外泌体的释放量增多,并载有大量肿瘤细胞来源的生物信息,实现肿瘤与微环境中细胞间的交流[15-16]。多项研究表明,卵巢癌源性外泌体携带CA125、上皮细胞黏附分子等肿瘤标志物,还携带激活转录因子2、肿瘤转移相关基因1等促进血管生成因子,亦有唾液酸糖蛋白、四跨膜蛋白与细胞连接、靶细胞的选择相关,以及热休克蛋白、IL-10、TGF-β1与肿瘤免疫调节相关等[17-19]。肿瘤源性外泌体HLA-G的研究尚属起步阶段,相关研究拓宽了sHLA-G参与肿瘤免疫并发挥免疫抑制作用机制的研究途径。有研究表明,外泌体源性sHLA-G与非外泌体源性sHLA-G在肿瘤患者体内可能具有不同的临床意义[20]。同样卵巢癌外泌体源性sHLA-G检测可能为肿瘤的诊疗提供新的思路。
目前,血浆sHLA-G水平在多种疾病中的诊断价值已被广泛研究,尤其在肿瘤方面,如肺癌、胃癌、结直肠癌、乳腺癌、卵巢癌、宫颈癌等多种癌症患者血浆sHLA-G水平均增高,说明sHLA-G作为某种癌症诊断标志物的特异度不高,但可作为卵巢癌诊断的潜在生物标志物之一。本研究结果发现,外泌体sHLA-G与血浆sHLA-G无相关性,这可能是由于两种方法的检测原理不同所致,FCM主要检测乳胶微粒富集的外泌体中HLA-G5、-G6荧光信号,而ELISA检测的是血浆中HLA-G5和shedded HLA-G1的总量,亦表明不同的HLA-G异构体分子在卵巢癌中可能起着不同的生物学作用;不同病理类型卵巢癌患者外周血sHLA-G差异无统计学意义(P>0.05),表明虽然不同组织学类型卵巢肿瘤的生物学行为存在很大差异,但它们发挥免疫抑制效应使卵巢癌细胞免疫逃逸的行为是一致的;卵巢癌病理分期Ⅲ~Ⅳ期患者的外泌体sHLA-G阳性占比高于Ⅰ~Ⅱ期(P<0.05),即卵巢癌临床分期越晚,外泌体sHLA-G的表达越多,提示外泌体sHLA-G可能参与了疾病的进展,有助于肿瘤的转移与扩散;不同病理分化程度卵巢癌患者血浆sHLA-G水平差异有统计学意义(P<0.05),可反映卵巢癌患者不良预后,与临床结局相关。上述结果提示血浆sHLA-G和外泌体sHLA-G有着不同的临床应用价值。
FCM检测外泌体sHLA-G在卵巢癌诊断上具有潜在的价值,为临床提供了另一种备选方法,提示外泌体sHLA-G可能成为卵巢癌诊断的新指标。本研究还存在一些不足之处,如研究样本量相对较少,未分析外周血sHLA-G水平与卵巢癌患者预后关系,未分析卵巢癌患者手术前后外周血sHLA-G水平的变化,以及其与卵巢癌生存率的相关性等。后续研究将扩大样本量验证,并探讨外泌体来源的sHLA-G在卵巢癌中的生物学作用及机制,以进一步明确其在卵巢癌诊断中的价值。
综上所述,卵巢癌患者外周血sHLA-G水平显著增高,表明sHLA-G在卵巢癌的发生、发展中发挥着重要的作用,有望成为卵巢癌诊断的潜在肿瘤标志物。
——外泌体与老年慢性疾病相关性的研究进展

