新型冠状病毒核酸检测的性能验证及评价
周 丹,何进才,李惠贞,黄 涛,谷大伟,张德明,罗胜华
广东省深圳市中医院检验科,广东深圳 518033
《新型冠状病毒肺炎诊疗方案(试行第八版修订版)》[1]指出,对疑似病例采用实时荧光定量聚合酶链反应(RT-qPCR)检测新型冠状病毒(SARS-CoV-2)核酸为阳性即可确诊为SARS-CoV-2感染。核酸检测具有早期、灵敏度高、特异度高、易操作等优势,但对于核酸检测结果的准确性,还需要从标本类型、质量、实验因素、试剂盒性能及患者感染周期等因素来综合分析[2],尤其难诊断的病例应当更加严格地控制。性能验证是保证实验室开展的检验项目所应用的检测系统的分析性能或检验项目的方法学能够满足检测及临床需求,保证患者标本检测结果准确可靠所进行的一系列验证试验。性能验证参数至少应包括精密度、符合率和检出限,同时需要在临床检测过程中累积室内质量控制和临床标本检测得到的数据,并与其他实验室间结果进行对比,开展进一步评价和其他性能指标(如特异度、抗干扰能力等)验证[3]。
为了验证本实验室采用的SARS-CoV-2核酸检测系统的各项性能参数是否符合要求,本研究参照《医学实验室 质量和能力的要求》第1部分通用要求GB/T22576.1-2018[4]、第10部分分子生物检验学领域的要求GB/T22576.10-2018、《CNAS-CL02-A009:2018医学实验室质量和能力认可准则在分子诊断领域的应用说明》[5]等文件要求对本实验室SARS-CoV-2 RT-qPCR检测系统的符合率、重复性、检出限、抗干扰能力、交叉反应等性能特征进行验证及评价,现报道如下。
1 材料与方法
1.1标本来源 国家卫生健康委临床检验中心(以下简称国家临检中心)2020年第1、2次SARS-CoV-2核酸检测室间质评标本,厂家提供的SARS-CoV-2核酸企业参考品(可溯源),SARS-CoV-2核酸检测试剂盒阴、阳性对照,广州邦德盛SARS-CoV-2核酸弱阳性质控品,本实验室检测SARS-CoV-2核酸阴性标本等。所有标本放-70 ℃冰箱内保存备用,避免反复冻融。
1.2仪器与试剂 核酸提取和扩增均采用厦门安普利全自动核酸提纯及RT-qPCR分析系统(Anadas9850),核酸提取试剂购自厦门安普利生物科技有限公司,检测试剂为上海伯杰医疗科技有限公司SARS-CoV-2核酸检测试剂盒(RT-qPCR法,批号:20200604)。
1.3方法 参考《医学实验室 质量和能力的要求》第1部分通用要求GB/T22576.1-2018、第10部分分子生物检验学领域的要求GB/T22576.10-2018、CNAS-CL02-A009:2018《医学实验室质量和能力认可准则在分子诊断领域的应用说明》和CNAS-GL039:2019《分子诊断检验程序性能验证指南》[6]的要求,对SARS-CoV-2核酸检测系统的主要性能指标进行验证。
1.3.1符合率验证 选取国家临检中心2020年第1、2次SARS-CoV-2核酸检测室间质评标本用于符合率验证,共计20份,其中阴性标本8份,阳性标本(含弱阳性和强阳性标本)12份。以国家临检中心公布的结果为靶值,分别计算阳性符合率、阴性符合率和总体符合率,检测结果应在允许范围内,且总体符合率>90%。
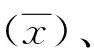
1.3.3检测下限验证 将厂家提供的企业参考品(可溯源,浓度105copies/mL)用无RNA酶DEPC水梯度稀释200倍至厂家声明的检出限浓度500 copies/mL,并进行检测下限的验证,同一批次重复测定5次,需达到100%检出率。
1.3.4交叉反应验证 由于用于交叉反应验证的病毒属于高致病性及传染性病毒,且不易获取,考虑到在二级生物安全实验室进行这些病毒操作的风险,故本研究选取国家临检中心第1次SARS-CoV-2病毒核酸检测室间质评的2020001、2020005、2020006、2020007、2020012号标本用于交叉反应的验证。这5份标本中在室间质评标本结果回馈后,已知其中含有的病原体的真实成分,且经过灭活处理,对操作人员无致病性。分别吸取200 μL标本加入200 μL标本保存液或经确认为阴性的标本中充分混匀,与常规样品一起处理和检测,重复检测3次以上,检测结果需均为阴性,则交叉反应验证通过。
1.3.5抗干扰能力验证 将制备的干扰物质溶液混入弱阳性质控品中进行抗干扰能力的验证。本研究对内源性干扰物质血液和黏蛋白进行抗干扰能力验证。血液干扰液制备:取1 mL血液,加入1 mL弱阳性质控标本中混匀,制成混有50%血液的干扰物质溶液。黏蛋白干扰液的制备:称取黏蛋白315 mg,加入100 mL超纯水,混合均匀,制成3.15 mg/mL溶液,再取3.15 mg/mL溶液100 μL加入3.4 mL弱阳性质控标本中,混合均匀,制成含黏蛋白质量浓度为0.9 mg/mL干扰物质溶液。将以上含干扰物质溶液的标本重复测定2次以上。若检测结果仍为弱阳性,说明在混有血液≤50%、黏蛋白≤0.9 mg/mL等内源性干扰物质时,不影响检测结果的判读,对测定无显著影响。
1.4质控和结果判读 所有检测批次试验均需做3个阴性、1个弱阳性质控,质控在控,结果才有效,否则需要重新检测。同一实验中,需同时满足阴性对照FAM通道、HEX/VIC通道无Ct值,ROX通道不做要求;弱阳性质控FAM通道、HEX/VIC通道、ROX通道均有扩增曲线,且Ct值≤40等要求,否则本次实验无效。在符合质控要求的条件下进行结果的判读,FAM通道和HEX/VIC通道Ct值≤40,SARS-CoV-2核酸检测阳性;FAM通道和HEX/VIC通道无Ct值或Ct值>40,SARS-CoV-2核酸检测阴性;FAM通道无Ct值或Ct值>40,和HEX/VIC通道Ct值≤40或者FAM通道Ct值≤40和HEX/VIC通道无Ct值或Ct值>40(即单靶标阳性)时需要复测,如果复测结果仍为单靶标阳性,则判定为SARS-CoV-2核酸检测阳性;若复测后双靶标Ct值>40,则判定为SARS-CoV-2核酸检测阴性。
1.5统计学处理 采用Excel 2019和SPSS19.0软件进行数据整理和统计学分析,经检验计量资料呈正态分布,计数资料以率表示,组间比较采用χ2检验,以P<0.01为差异有统计学意义。
2 结 果
2.1符合率验证 国家临检中心发放的20份室间质评标本(阳性12份,阴性8份),本实验室检测出阳性11份(其中弱阳性4份),阴性9份,以国家临检中心公布的结果为金标准,阳性符合率=92%,阴性符合率=100%,总符合率=95%,2种方法的检出率比较,差异有统计学意义(χ2=16.29,P<0.01)。该方法的灵敏度为92%,特异度为100%,约登指数为0.92。见表1、2。
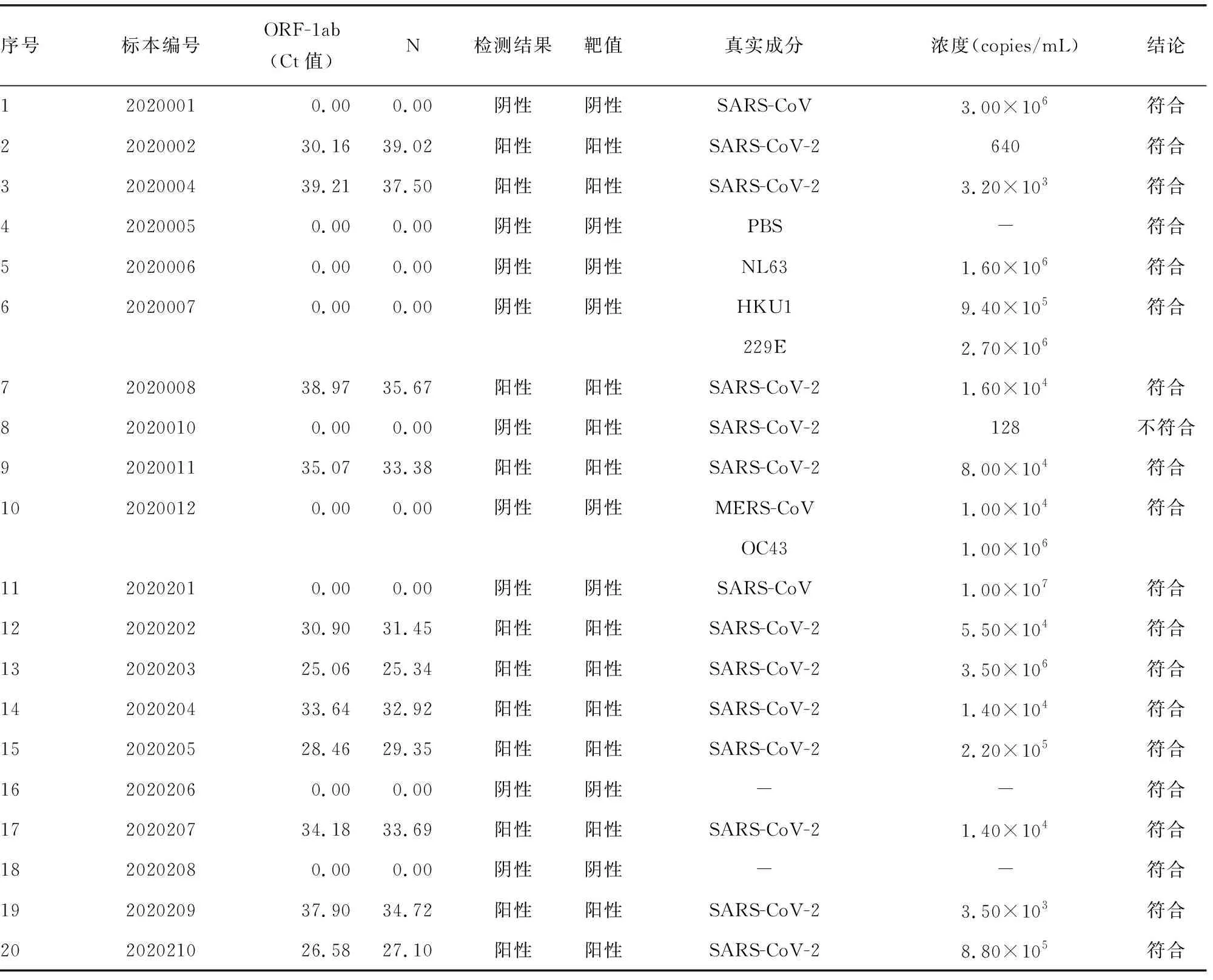
表1 SARS-CoV-2核酸检测符合率验证结果
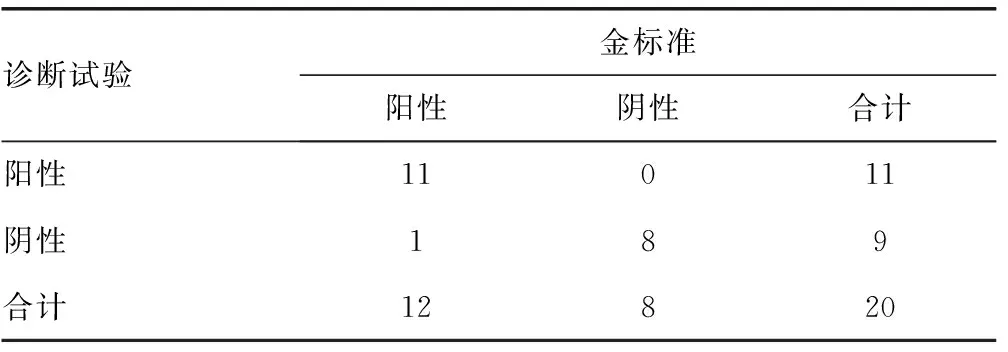
表2 SARS-CoV-2核酸检测符合率验证实验统计(n)
2.2重复性(精密度)验证 2份标本中,一份为阴性,另一份为弱阳性(浓度约为104 copies/mL),进行批内和批间重复性(精密度)验证,试剂盒检测的2个靶基因ORF-1ab和N的Ct值结果见表3。阴性标本检测结果均为阴性,弱阳性标本的2个靶基因ORF-1ab和N的Ct值的批内CV分别为1.38%和1.16%,批间CV分别为1.84%和1.72%,均小于5%,与试剂说明书声称的实验室内、室间的精密度CV≤5%符合,重复性(精密度)验证通过。
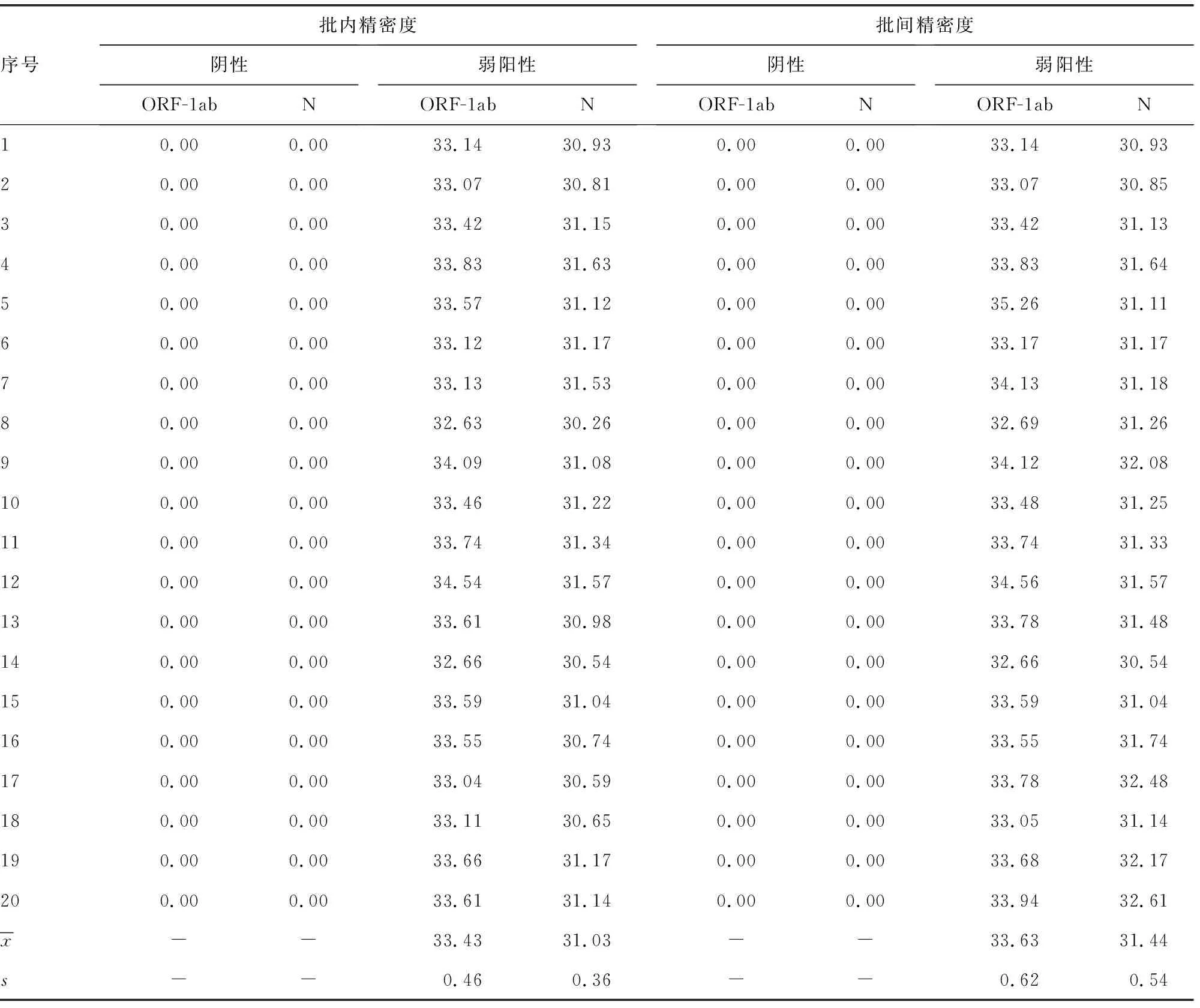
表3 SARS-CoV-2核酸检测重复性(精密度)验证结果(Ct值)
2.3检测下限(灵敏度)验证 重复检测5次检出限浓度500 copies/mL的标本,检测结果均为阳性,满足说明书声称的最低检测限要求,检测下限验证通过。见表4。
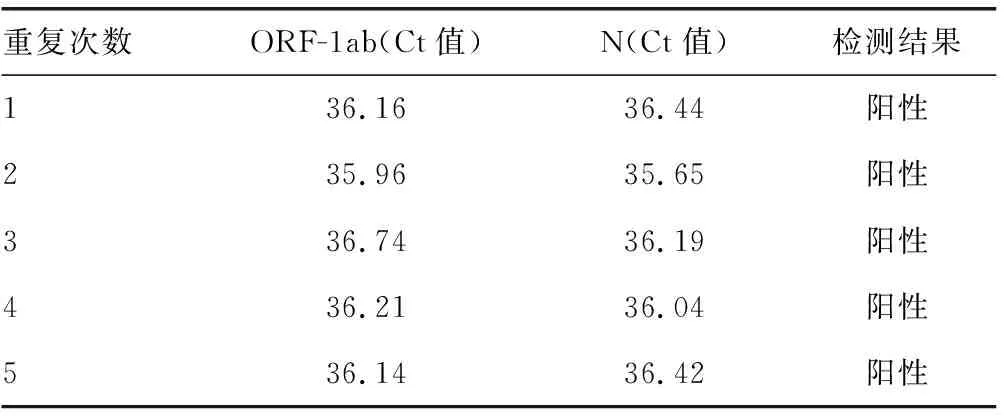
表4 SARS-CoV-2核酸检测下限验证结果
2.4交叉反应验证 将200 μL标本加入200 μL保存液或经确认为阴性的标本中充分混匀,与常规标本一起处理和检测,重复检测3次,检测结果见表5。5个标本检测结果均为阴性,在加入其他病原体后,对检测结果的判读不造成影响,满足试剂说明书中的要求,交叉反应验证通过。
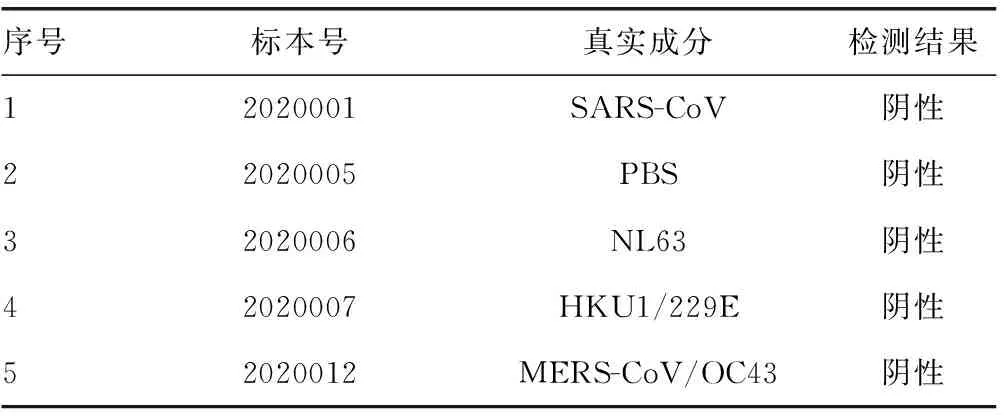
表5 SARS-CoV-2核酸交叉反应验证结果
2.5抗干扰验证 在弱阳性标本中加入干扰物质溶液,使干扰物质的终浓度与厂家声明的浓度相同,将该弱阳性标本重复测定2次,检测结果见表6。加入干扰物质后的弱阳性标本均能检测出阳性结果,说明在混有血液≤50%、黏蛋白≤0.9 mg/mL等内源性干扰物质时,不影响检测结果的判读,对测定无显著影响,满足试剂说明书中的要求,抗干扰验证通过。
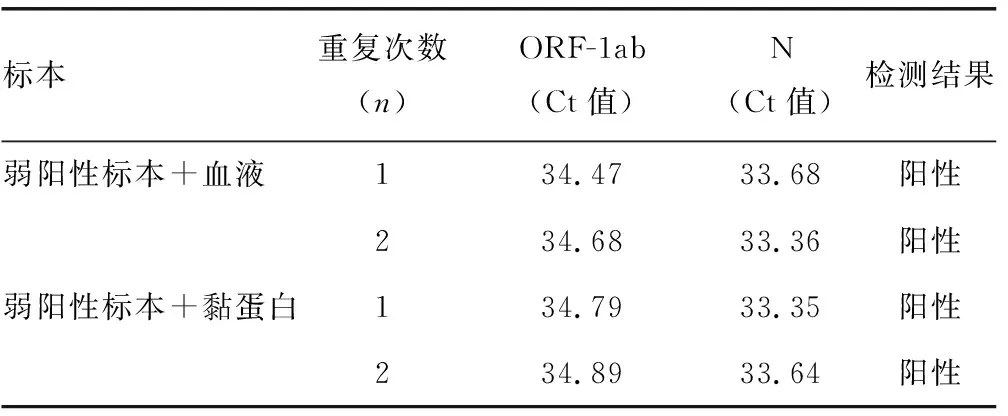
表6 SARS-CoV-2核酸检测抗干扰验证实验结果
3 讨 论
性能验证是指实验室通过实验数据验证检验程序的性能特征是否符合厂商的声明。《医学实验室 质量和能力的要求》第1部分通用要求GB/T22756.1-2018[4]指出,检验方法或试剂在使用前必须经过实验室独立验证,以确保其性能指标在本实验室能达到厂商声明的要求。因此,性能验证不仅是实验室认可的需要,也是确保检测结果准确可靠的内在要求。
在进行符合率验证时,可通过与参比方法进行比较,来判定检测结果的符合率,参比方法通常为诊断的金标准、行业公认方法、经性能验证符合要求能满足临床预期用途的方法,如通过ISO15189认可实验室使用的相同检测方法等。在实际工作中,通常采用参加国家/省临检中心室间质量评价标本结果来进行评价,检测国家/省临检中心质评物,检测结果均在允许范围中,则符合率验证通过。本研究采用国家临检中心发放的室间质评标本进行验证,共20份标本,其中阴性8份,阳性12份,本研究检测到阳性11份,阴性9份,阳性符合率92%,阴性符合率100%,总符合率95%,其中有1例阳性标本未检测出阳性,根据国家临检中心最后公布的结果可知,该标本的真实成分是SARS-CoV-2,其数字PCR定量的浓度是128 copies/mL,已经低于了本检测系统的最低检测限500 copies/mL,未检测出阳性结果在可接受范围内,同时也说明了RT-qPCR检测出核酸的灵敏度还有待提高。此外,还可采用厂商或第三方提供的参考物质的检测来进行符合率的验证。但是,符合率的验证并不等同于正确度的验证,在《WS/T505-2017:定性测定性能评价指南》[7]中也提到,符合率的一个重要缺陷是其并不是一个“正确性”的量度,事实上2种检测方法可能高度符合,但是灵敏度和特异度都很低,相反,2种方法不符合也并不意味着待评估的方法是错误的,比较方法是正确的。其次,在采用室间质评标本进行研究方法的检测性能验证时,由于室间质评标本存在基质效应,可能会带来2种方法比对时结果不一致的错误结论,例如室间质评标本中分析物水平在接近阴性或阳性阈值时,可能无法检测出真实结果。
精密度是在规定条件下,对同一检测对象多次重复测量所得到的结果的一致程度,通常以s或CV表示[8]。定性项目的精密度评价应选择接近临界水平的标本进行试验,每次试验均应设立阴性和阳性质控,质控数据在控为试验数据有效的前提。在疫情防控常态化时期,由于本院为非定点收治医院,阳性标本不易获得,因此本研究用无RNA酶DEPC水10倍稀释厂家提供的企业参考品(可溯源,浓度105copies/mL)获得浓度104copies/mL的弱阳性标本用于重复性验证,结果显示2个靶基因ORF-1ab和N的Ct值的批内CV分别为1.38%和1.16%,批间CV分别为1.84%和1.72%,均小于5%,符合厂家声明,说明试剂性能稳定,重复性较好。
当所有检验程序在厂家试剂使用说明书等有声明检出限时,检测项目在有标准物质时,或以定量形式表达定性结果时,应进行检出限的验证。对检出限的验证,也是对检测系统灵敏度的验证。灵敏度是指仪器或试剂对待测标本的检测能力,若灵敏度过低,则可能导致假阴性出现[9-10]。用于检测限验证的标本应是定值标准物质(国际参考品、国家参考品、厂家参考品),将定值标准物质梯度稀释至厂家声明的检出限浓度,重复测定5次或在不同批次内对该标本进行20次重复测定,如果是5次重复,则需达到100%检出率,如果是分批次20次检测,需至少18次检出核酸,检出率90%以上。本研究用无RNA酶DEPC水梯度稀释厂家提供的企业参考品(可溯源,浓度105copies/mL)200倍至厂家声明的检出限浓度500 copies/mL,用于验证检出限,重复测定5次的检测结果均为阳性,满足说明书的检测限要求,说明该试剂具有足够的检测能力。
交叉反应验证需验证于检测对象可能存在交叉反应的病原体对检测的影响,这类病原体主要是与检测对象核酸序列具有同源性、易引起相同或相似临床症状的病原体,并宜在病原体感染的医学决定水平进行验证。本研究运用了国家临检中心2020年第1次SARS-CoV-2核酸检测的室间质评标本,在室间质评结果回馈后已知其中一些阴性标本的真实成分,这些病原体刚好可用于交叉反应验证,且都经过灭活处理,对操作人员无致病性。本研究分别吸取200 μL已知病原体标本加入200 μL标本保存液或经确认为阴性的标本中充分混匀,与常规样品一起处理和检测,重复检测3次的检测结果均为阴性,检测结果可接受,交叉反应验证通过。
抗干扰能力验证应验证说明书中涉及干扰物质对测定的影响,常见干扰物质主要包括血红蛋白、三酰甘油、胆红素、免疫球蛋白、类风湿因子、黏蛋白、抗核抗体和药物等。SARS-CoV-2核酸检测一般采集的标本为鼻咽或口咽拭子,可能存在血红蛋白或黏蛋白的干扰,因此在本研究中验证了血液和黏蛋白2种内源性干扰物质的影响,在弱阳性标本中加入干扰物质溶液,使干扰物质的终浓度与厂家声明的浓度相同,将含有干扰物质的弱阳性标本重复测定2次,检测结果仍为弱阳性,说明在混有血液≤50%、黏蛋白≤0.9 mg/mL等内源性干扰物质时,不影响检测结果的判读,对测定无显著影响,满足试剂说明书中的要求。
综上所述,核酸检测是SARS-CoV-2诊断的重要方法。本研究结果显示该检测系统的结果准确可靠,精密度好,灵敏度高,抗干扰能力强,与试剂说明书提供的检测性能一致,可以满足目前SARS-CoV-2初筛检测的要求。本研究提供了一套SARS-CoV-2核酸检测的性能验证方案,在阳性标本不易获取的条件下可以适当使用室间质评的标本进行检测系统的性能验证。检测系统的性能验证或评价不仅是实验室认可的需求,更是保证检测结果准确可靠的需求,实验室应建立文件化的性能验证程序,注意性能验证的时机,制订相应的验证方案,在开展新项目时做好性能评价。

