不同因素对包埋质量的影响
张睿,罗锦*,朱正鹏,马健波,徐佳佳
(1湖北医药学院附属国药东风总医院病理科,十堰 442008;2湖北医药学院附属国药东风总医院影像科,十堰 442008)
包埋是指将组织放于受热熔化的载体中,通过载体冷却固化后支撑组织的过程[1],是组织制片中重要的环节之一。日常工作中最常用的包埋方法即石蜡包埋。石蜡包埋质量的好坏会直接影响后续的切片、染色效果,但石蜡包埋的过程中细节多,容易出现包埋不佳的情况。为了达到满意的包埋效果我们进行了技术探索,通过优化操作细节,以期提升包埋质量。
资料与方法
1 材料与分组
从国药东风总医院病理科2020年6月的病理标本中,选取800例标本,其中大标本(直径>0.4 cm)650块,小标本(直径≤0.4 cm)150块,将标本随机分成对照组(325个大标本+75个小标本)和实验组(325个大标本+75个小标本),各400块。
2 方法
对照组:先往常温包埋模具中开始第一次注蜡,一次性注满模具,置于热台上[2],放入组织,盖上包埋盒,进行第二次注蜡,蜡液的液面高度接近包埋盒上缘。实验组:每例取1个加热至70 ℃的包埋模具,将热包埋模具放置包埋机蜡嘴下方热台(温度为70℃),开始第一次注蜡,注蜡量为包埋模具容量的2/3;用加热的包埋镊夹取组织,放入模具底部中央;将包埋模具移至表面添加有少量水的包埋机冷台上,轻压组织,使组织稳稳的黏连在包埋模具上;待模具侧壁的石蜡稍凝固后加盖包埋盒底盒,包埋底盒倾斜一定夹角,先将长轴一侧接触蜡液再缓缓放平,轻压;二次注蜡时包埋模具连同包埋盒倾斜10°~25°(图1),蜡液液面没过包埋盒下缘,置于冻台充分冷却,再进行常规切片,然后行HE染色(表1)。

图1 包埋过程中的操作要点。A,包埋盒盖于包埋模具时,包埋盒倾斜一定夹角,先将长轴一侧接触蜡液再缓缓放平,轻压,可减少气泡的残留;B,二次注蜡时包埋模具连同包埋盒倾斜10°~25°Fig.1 Key points of the embedding procedure.A, when the embedding box was covered with the embedding mold, the embedding box was inclined at a certain angle.First touch the wax liquid on one side of the long axis, then slowly flatten it and press lightly to reduce the residual air bubbles; B, during the second injection of wax, the embedding mold and the embedding box were inclined at an angle of 10°~25°.

表1 实验组与对照组蜡包埋方法对比Tab.1 Comparison of paraffin embedding methods between experimental group and control group
3 观察指标
3.1 组织包埋合格标准
组织蜡块与包埋盒平行无裂隙、包埋组织居中、组织排列整齐、排列方向一致、包埋面准确、包埋面高低一致、石蜡与组织融合、注蜡适宜、蜡块无气泡、包埋无污染。包埋合格率=达到包埋合格标准的蜡块数/蜡块总数。
3.2 撬出蜡块质量标准
甲级:四周边缘无残蜡;乙级:一边或两边仅有少量残蜡;丙级:一边有大量残蜡或三边以上有少量残蜡;丁级:两边及以上有大量残蜡。
3.3 后续工作质量观察指标
由两名高年资医师对HE染色效果进行评判,评判组织结构完整性、细胞透明度和核质对比度,每项10分,根据质量缺陷扣减相应分值,每项指标的分数取其均值。选取两组中进行免疫组化染色的切片各120张,进行阅片评分,分值≥90分为优良切片,分别统计两组的免疫组化切片优良率。评分标准参考《免疫组织化学病理诊断》[3]。
结 果
1 蜡块包埋质量
对照组合格率为86.75%(347/400),实验组包埋合格率为93.50%(374/400),显著高于对照组;其中实验组与对照组在包埋面高低一致、石蜡与组织融合、蜡块无气泡方面也显著优于对照组(表2)。

表2 蜡块包埋质量统计学分析Tab.2 Statistical analysis of wax block embedding quality
2 撬出蜡块质量
对照组蜡块质量甲级率为68.75%,实验组蜡块质量甲级率为98.25%,实验组蜡块质量甲级率显著高于对照组(表3)。

表3 撬出蜡块质量统计学分析Tab.3 Statistical analysis of the quality of pried wax block
3 HE染色切片质量
对HE染色切片比较发现,对照组HE切片完整度欠佳,组织结构欠清晰,细胞核与细胞质对比欠清晰;实验组组织切面较为完整,无刀痕、裂隙、颤痕,切片厚薄均匀,组织结构和细胞形态清晰(图2);实验组的组织结构完整性、细胞显示效果评分均显著高于对照组(表4)。

图2 实验组与对照组包埋质量和切片质量检测。A,对照组蜡块中有气泡残留,且四周残蜡较多(黑框示蜡块周围残蜡,箭头示蜡块中残留气泡);B,实验组蜡块包埋位置居中,排列整齐,包埋面高低一致且无气泡;C和E ,对照组HE染色切片组织结构不完整,细胞细胞核与细胞质对比不清(星号示组织结构不完整);D、F 实验组HE染色切片完整,厚薄均匀,无刀痕、裂隙、颤痕,组织结构和细胞形态清晰。比例尺:C和D,100 μm;E和F,20 μmFig.2 Examination of embedding quality and section quality of experimental group and control group.A, there are bubbles remaining in the wax block of the control group, and there are more residual waxes around (the black frame shows the residual wax around the wax block; the arrow head indicates residual air bubbles in the wax block); B, in the experimental group, the embedding position of the wax block was centered, arranged neatly, and the embedding surface had the same height and no air bubbles; C and E, in the control group, the tissue structure of HE-stained sections was incomplete, and the contrast between the nucleus and cytoplasm was unclear (asterisk indicating incomplete organizational structure); D and F, the HE-stained sections of the experimental group were complete, with uniform thickness, no knife marks, fissures, and chatter marks, and the tissue structure and cell morphology were clear.Scale bar: 100 μm in C and E;20 μm in E and F
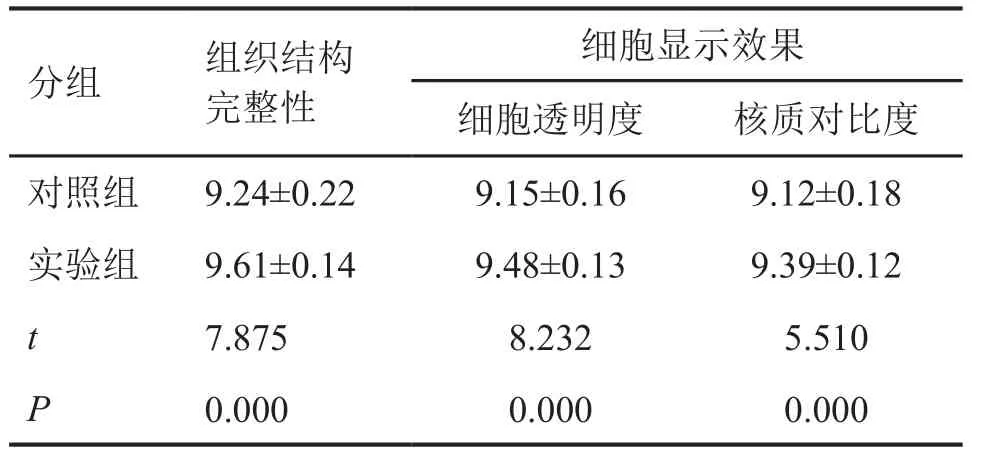
表4 HE染色切片质量统计学分析Tab.4 Statistical analysis of quality of HE stained sections
4 免疫组织化学染色切片质量
对照组切片中皱褶较多,皱褶区域组织结构不清,且有背景着色(图3A、C);实验组切片平整,无皱褶折叠,组织结构清晰,对比鲜明(图3B、D);实验组切片优良率(97.50%)显著高于对照组切片优良率(90.83%)(表5)。

图3 实验组与对照组免疫组织化学染色切片质量比较。A和C,对照组,箭示组织中皱褶;B和D, 实验组;比例尺:A和B,100 μm;C 和D,20 μmFig.3 Comparison of the quality of immunohistochemically stained sections between the experimental group and the control group.A and C, control group, the arrow indicating a wrinkle; B and D, experimental group.Scale bar, 100 μm in A and B; 20 μm in C and D

表5 免疫组织化学染色切片质量统计学分析Tab.5 Statistical analysis of quality of immunohistochemically stained sections
讨 论
包埋是组织制片过程中的重要环节,包埋质量的好坏直接影响到后续的制片效果。随着医疗技术的不断发展,胃肠镜、纤维支气管镜活检及超声引导下粗针穿刺技术的日益发展和成熟,临床送检的体积微小,穿刺标本的数量日益增多,对我们的包埋技术提出了更高的要求。
如果包埋模具常温放置,包埋时只有底部与热台接触受热,其余部分均为常温,注入石蜡后底部石蜡为熔化状态,四周温度迅速下降,很快形成半凝固状态[4],多块组织或细小组织包埋时,难以在短时间内将所有组织包埋在同一平面[5]。特别是细小穿刺组织往往体积小、质量轻,在蜡液中很难沉降到包埋盒底部,如果没有按压平整,极易出现组织不在同一平面上,而造成切片不全影响诊断。通过将包埋模具加热至与石蜡熔点相近的温度70 ℃,可减缓石蜡凝固,保证包埋人员有足够的时间将组织按正确的包埋方向放置到包埋盒底部中央。
对于完成组织定位的包埋模具一般放置于冷台冷却,此种冷却方式,模具只有底部受冷,石蜡凝固缓慢,包埋组织容易发生移位,且放置包埋盒时易发生蜡液上涌。通过在冷台上加入少量的水,包埋模具大部置于水中,受冷面积显著增加,靠近模具的石蜡快速凝固,这样不仅减少组织移位的风险,而且避免加盖包埋盒轻压时石蜡上涌,蜡块四周残蜡较多的情况。
注蜡量的控制是减少残蜡产生的关键,对照组第一次注蜡,一次性注满包埋模具,在放入组织后大量石蜡外涌导致蜡块四周残蜡较多。实验组将注蜡量调整为包埋模具容量的2/3,既有效缓解二次注蜡时的冲击力又避免石蜡的大量涌出。同时将第二次注蜡量调整为没过包埋盒下缘,这样既不影响撬出蜡块和后续切片又降低石蜡漏出的风险。
包埋时二次注蜡的注蜡量较多,如果包埋模具与注蜡方向垂直,液态石蜡的冲击力较大易在包埋面及以下产生气泡。将包埋模具倾斜10°~25°,可缓冲液态石蜡的冲击,减少气泡的产生。结果显示,实验组的组织包埋合格率、撬出蜡块质量明显高于对照组,后期HE和免疫组织化学染色后,切片组织结构完整性、细胞显示效果评分较对照组有所增加,免疫组化染色优良率也高于对照组。
综上,通过优化包埋模具的温度、第一次注蜡量、包埋机冷台、加盖包埋底盒方式、二次注蜡角度等条件,可显著提升包埋质量。
做好组织包埋还需要注意以下几点:①包埋石蜡的选择至关重要,直接影响后续的制片效果。熔点较低的石蜡适用于室温偏低时包埋质软组织,而室温较高时则需要选择熔点较高的石蜡。如果室温较高而选择低熔点石蜡会造成蜡块偏软,切片时易发生卷片、无法连续切片,所制切片皱褶较多难以展开;如果室温偏低而选择高熔点石蜡则蜡块偏硬,切片易产生裂隙。②包埋工作开始前,需保证镊子、组织块储存框、包埋模具储存框及包埋模具处于清洁状态,减少组织污染的风险。③组织块暂存框中的蜡液量应为脱水盒2/3高度左右,保证组织一直处于浸蜡状态,避免出现组织与蜡液不溶。④在包埋时应随时清洁工作台面,用纸擦拭热台的沟槽、台面,包埋时打开一份包埋盒包埋一份组织[6],包埋完成后立即清洁镊子,再进行下一份组织的包埋,避免交叉污染。切不可同时打开多个包埋盒,同时包埋极易造成组织混淆,导致医疗差错。打开包埋盒时动作要轻柔,避免组织崩出,注意包埋盒盖有无组织存留。⑤针对不同的组织选择适宜的包埋方式,如皮肤组织包埋时应将组织块45 ℃倾斜放入石蜡中,宫颈锥切组织应按组织的内膜至浆膜面呈90℃包埋,食管粘膜或标注立埋的组织则需要垂直包埋等。⑥单块组织包埋时应放置于包埋模具中央,多块组织居中呈正方形或长方形排列,组织间聚拢[7]。宫颈、宫腔等组织较松散,包埋时应注意组织块四周与包埋盒底边缘的距离,至少保持1 mm空隙。⑦将包埋盒盖于包埋模具时,包埋盒倾斜一定夹角,先用长轴一侧接触蜡液面再轻轻放下,可减少气泡的残留。操作时动作需迅速平稳,若动作太慢,蜡凝固后加盖包埋盒,易造成组织蜡块与包埋盒不平行。⑧二次注蜡时,动作要轻柔,倾斜角度不宜过大,防止包埋盒底盒移位。液面高度必须没过包埋盒下缘,如注蜡量过少则切片时蜡块易产生震颤,过度蜡块不宜与切片机夹具吻合,影响切片质量。⑨包埋完成后将包埋模具倒扣,置于烤箱中,模具上残留杂质可随融化的残蜡流出,再放置于包埋机中备用。也可定期将包埋模具同包埋框一起放入脱水机,应用清洗程序清洁。⑩建立包埋的质控,登记每日的包埋的蜡块总数,核对每个包埋盒内组织块数。总的蜡块数与切片数,在染色结束后应该核对一下,切片与对应号码的蜡块进行比较:检查是否一致,有无差错,是否切全,有无遗漏,标签是否有误等[8]。
提高包埋质量的关键在于对包埋过程中细节的优化,需要根据不同标本的组织特点制定更加个性化的操作方案[9]。只有在工作中不断的积累经验针对问题作出改进,才能使包埋质量不断提升。本研究样本量有限,对于包埋样本分类不够细致,下一步将进一步细化研究。

