成对框基因2蛋白在C57BL/6J小鼠脑发育进程中的表达
丁彩云,蔚洪恩*,周党侠*
(1西安交通大学医学部病理系,西安 710061;2山西省人民医院神经内科,太原 030012)
成对框基因(paired box gene)是一组编码转录因子的基因,通常作为关键的调节因子参与胚胎发育过程中的细胞增殖、迁移和特异性分化,对不同组织和器官的早期发育具有重要作用[1]。人类和小鼠的Pax基因家族共有9成员,即Pax1—9[2]。Pax2作为Pax家族中一个重要的成员主要参与肾脏、输尿管、耳及眼等器官的表达[3]。
随着对Pax2基因的深入研究,越来越多的证据表明,Pax2与中枢神经系统的发育密切相关。在人类,发现日本人群中Pax2相关的障碍病患者可表现出孤独症谱系障碍、语言延迟等发育异常[4];婴儿期Pax2基因表达异常可出现发育迟缓、智力缺陷以及小头畸形症状[5]。Pax2 5号外显子胞嘧啶缺失的患者容易诱发癫痫发作[6]。在对小鼠的研究中发现Pax2基因纯合突变的小鼠有脑部畸形表现[7]。最新的研究也发现Pax2基因缺失的小鼠可表现出以重复刻板行为为主要特征的神经障碍[8]。由此可见,Pax2基因在人类和小鼠中枢神经系统的发育过程中发挥重要作用。但是Pax2基因在中枢神经系统中的发育规律及其导致相关疾病的分子机制仍不太清楚,因此,本研究观察了正常C57BL/6J小鼠脑发育过程中的形态学变化及其发育中Pax2蛋白的时空表达情况,为后续研究Pax2在中枢神经系统疾病中的作用机制提供理论基础和参考依据。
材料和方法
1 材料
本实验所选用的C57BL/6J 小鼠均购自山西省人民医院实验动物中心。实验动物的生产许可证号为:SYXK(晋)2019-0003。实验小鼠饲养于山西省人民医院SPF级实验动物中心,环境恒温、恒湿,采取24 h昼夜节律,自由饮食。本实验已通过山西省人民医院动物伦理委员会批准。
2 取材及固定
每日下午17:00按雄雌1:2合笼,次日清晨8:00和下午16:00进行检栓,发现阴道口有白色或黄色凝固物者为见栓,记为E0.5,出生第一天记为P0。分别取E11.5、E13.5、E15.5胎鼠头部和E17.5、P0、P7、P14和P30小鼠全脑组织,放入4%多聚甲醛组织固定液中固定24 h后脱水、石蜡包埋。胎头和脑组织均以3 μm厚度进行矢状位连续切片。
3 HE染色
石蜡切片脱蜡水化:二甲苯I、II各10 min,无水乙醇I、II→95%乙醇→80%乙醇→70%乙醇→蒸馏水各2 min;苏木素染液染色10 min,自来水冲洗10 s;分化液分化5 s,自来水冲洗30 s;返蓝液返蓝1 min,自来水冲洗30 s;伊红染色2 min,自来水冲洗5 s;梯度酒精脱水、二甲苯透明、中性树脂封片。
4 免疫组织化学染色
采用罗氏全自动多功能组织病理检测系统(BenchMark ULTRA)进行染色。一抗Pax2(兔单抗,克隆号:EP235)为即用型抗体工作液,购自北京中杉金桥生物技术有限公司。二抗及检测系统采用Ventana公司生产的OptiView DAB IHC Detection Kit。除一抗外,其余试剂均为罗氏配套的封闭试剂。按照设定好的程序进行染色:石蜡切片脱蜡水化,清洗缓冲液清洗;抗原修复液(ULTRA Cell Conditioning Solution)100 ℃修复64 min;降到室温后,清洗缓冲液清洗,滴加过氧化物酶抑制剂(OptiView Peroxidase Inhibitor) 孵育 45 min;清洗缓冲液清洗后,加兔抗Pax2单克隆抗体工作液37 ℃孵育44 min;清洗缓冲液清洗后,分别加HQ Linker(OptiView HQ Universal Linker) 和 HRP 标记二抗(OptiView HRP Multimer)37 ℃各孵育12 min;清洗缓冲液清洗后,滴加DAB显色剂(0.2%DAB+0.04% H2O2)37 ℃呈色8 min;依次滴加苏木素、返蓝液各4 min;程序运行完毕,取出切片,洗洁精清洗后,梯度酒精脱水,二甲苯透明封片。用KF-PRO-005-EX全自动数字病理切片扫描仪40×进行全片扫描后观察、输出图像。
结 果
1 胚中晚期和生后早期小鼠脑的发育变化
HE染色显示:胚胎11.5 d(E11.5),小鼠矢状切面显示脑组织已基本具备完整的5个脑泡结构:端脑、间脑、中脑、后脑和末脑。其中端脑脑泡壁细胞数可达十层左右,大致可分为室管膜层、外套层和边缘层,海马原基和小脑原基出现。从E13.5开始,端脑壁进一步增厚;至E15.5,细胞数可达数十层,由内向外依次可分为室管膜层、室管膜下层、中间层、皮质板层和边缘层。此时,小脑皮质可见明显的外颗粒层;到E17.5,小脑皮质可大致观察到分界模糊的外颗粒层、分子层和浦肯野细胞层;出生时(P0)小鼠基本具有成年鼠的脑形态,大脑皮质、海马纹状体发育尚不完全,小脑开始出现沟回结构。P7至P30小鼠大脑皮质6层结构可见,海马齿状回结构清楚,小脑沟回明显,外颗粒层细胞数开始减少,至P30随着外颗粒层完全消失,小脑皮质形成典型的3层结构即分子层、浦肯野细胞层和颗粒层且皮质与髓质分界清晰(图1)。
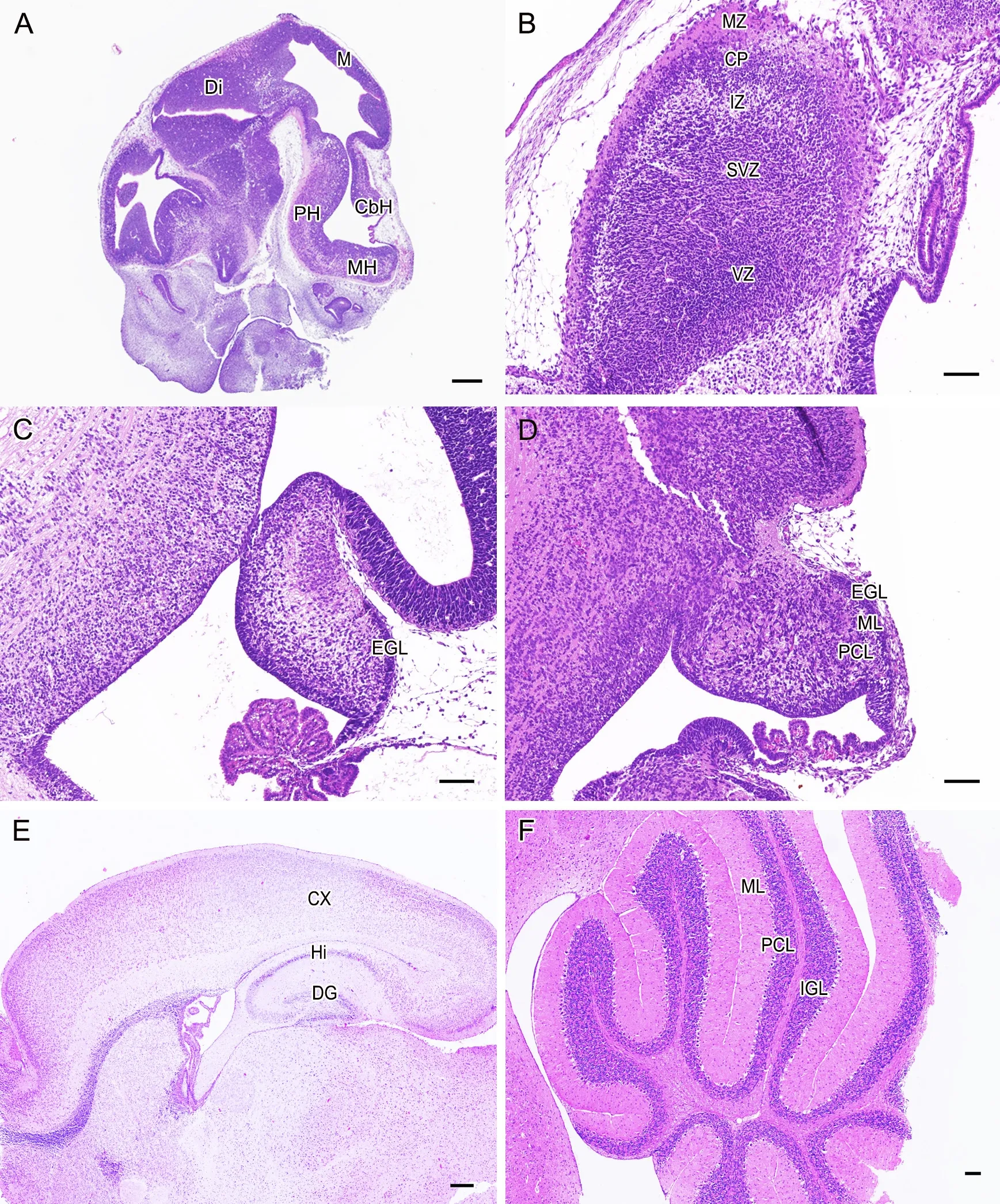
图1 胚中晚期和生后早期小鼠脑发育变化的HE染色。 A,E11.5脑;B和C,E15.5大脑皮质(B)和小脑(C);D,E17.5小脑;E,P7脑;F,P30小脑;T,端脑;Di,间脑;M,中脑;PH,脑桥;MH,延髓;CbH,小脑;MZ,边缘层;CP,皮质板层;IZ,中间层;SVZ,室管膜下层;VZ,室管膜层;CX,大脑皮层;Hi,海马;DG,齿状回;EGL,外颗粒层;ML,分子层;PCL,浦肯野细胞层;IGL,内颗粒层。比例尺:A和E,250 μm;B、C、D和F,80 μmFig.1 HE staining of brain development changes in mice at mid and late embryonic and early postnatal stages.A, the brain at E11.5; B and C, the cerebral cortex (B) and cerebellum (C) at E15.5; D, the cerebellum at E17.5; E, the brain at P7; F, the cerebellum at P30; T, telencephalon; Di, diencephalon;M, midbrain; PH, pontine hindbrain; MH, medullary hindbrain; CbH, cerebellar hemisphere; MZ, marginal zone; CP, cortical plate; IZ, intermediate zone; SVZ, subventricular zone; VZ, ventricular zone; CX, cerebral cortex; H, hippocampus; DG, dentate gyrus; EGL, external granular layer; ML,molecular layer; PC, Purkinje cell layer; IGL, internal granular layer.Scale bars: 250 µm in A and E; 80 µm in B, C, D and F
2 胚中晚期和生后早期小鼠脑内Pax2蛋白发育相关的表达模式
免疫组织化学染色显示:Pax2蛋白在小鼠脑发育不同时期的表达具有一定的时空变化规律。阳性信号主要定位于细胞核和神经纤维上,核周亦有少量染色。阳性染色呈棕色或棕褐色。
从胚胎期到出生后,Pax2蛋白持续高表达的部位较保守,主要集中在小鼠的脑桥、延髓和小脑中;E11.5时,Pax2蛋白在小鼠脑桥及延髓的细胞核和神经纤维上弥漫性表达;在E13.5时到达高峰,此时阳性细胞数量多,核染色强;随着胎龄增加,Pax2蛋白的表达逐渐降低。出生后,Pax2蛋白的阳性表达越来越弱,到P30时只可见少量且染色特别浅的阳性细胞。从E11.5到P30,Pax2蛋白在延髓的表达普遍高于脑桥。
在小鼠小脑中,Pax2蛋白的表达开始于E13.5,此时水平较低;随着胎龄的增长表达逐渐升高,E17.5主要表达于小脑外颗粒层中;出生后其表达水平继续升高,P7 时达到高峰,在内颗粒层和髓质中强烈表达;P14时表达开始降低,至P30时仅在颗粒层细胞中有少量表达。
Pax2蛋白在小鼠不同发育时期脑的其他部位也有少量免疫阳性反应。E13.5时,菱脑峡部和下丘脑Pax2蛋白阳性细胞呈散点状分布;E15.5时,在丘脑、下丘脑少量表达,在上丘和菱脑峡点状分布;E17.5时,Pax2蛋白免疫阳性细胞在菱脑峡极少。胚胎期,Pax2蛋白除在细胞核上有阳性表达外,在间脑、中脑和后脑的一些神经纤维上亦有广泛表达。P0时,在大脑皮层、海马、丘脑、菱脑峡和一些神经纤维上有少量表达,阳性反应产物呈点状分布。P7时,在大脑皮层和海马核周可见Pax2蛋白的散在表达,在丘脑核周呈片状分布,浅色染。P14时,在丘脑和纹状体核周和神经纤维上有阳性表达,数量较多,但染色较浅(图2)。

图2 Pax2蛋白在胚中晚期和生后早期小鼠脑内表达模式的免疫组织化学检测。 A、B、C、H,E11.5(A)、E13.5(B)、E17.5(C)、P30(H)延髓;D,E17.5小脑;E和G,P7和P30小脑;F,P7丘脑;b1和b2,B中方框b1和b2的放大图;c、d、e、f、g和h,C(c)、D(d)、E(e)、F(f)、G(g)和H(h)中方框的放大图; is,峡部;CM,小脑髓质;Th,丘脑;箭头示Pax2阳性细胞;比例尺:A—H,80 μm;b1—h,10 μmFig.2 Immunohistochemical detection of Pax2 protein expression pattern in the brain of mice in the middle late embryonic and early postnatal periods.A, B, C, and H, the medulla oblongata at E11.5 (A), E13.5 (B), E17.5 (C) and P30 (H); D, the cerebellum at E17.5; E and G, the cerebellums at P7 andP30; F, the thalamus at P7; b1 and b2, enlarged views of blocks b1 and b2 in B; c, d, e, f, g and h, enlarged views of blocks in C (c), D (d), E (e), F (f),G (g) and H (h); is, isthmus; CM, cerebellar medulla; Th, thalamus; arrows indicating Pax2 protein positive cells; scale bar, 80 μm in A to H; 10 μm inb1 to h
讨 论
中枢神经系统的发育是一个复杂而又精密的过程,各脑区的发育在特定转录因子和基因的调控下按照一定的规律有序进行[9]。大脑作为中枢神经系统重要的组成部分,其发育的时空顺序对于我们研究中枢神经系统的结构和功能有着至关重要的意义。HE染色结果显示,胚胎11.5 d,小鼠已具备完整的5个脑泡结构。随着神经祖细胞的增殖分化,端脑发育成大脑皮质、海马和嗅叶,间脑发育成视网膜、上下丘脑,中脑泡发育为中脑,后脑发育为小脑和脑桥,末脑发育成延髓。在脑组织按特定的模式进行发育和分化的过程中,一些转录因子的表达决定祖细胞的分化类型。有研究发现,Pax基因与神经管缺陷(NTDs)相关[10],并且对早期神经元的特定分化及细胞定向迁移起决定性作用[11]。
Pax2作为一个重要的发育调控基因,研究发现在人类胚胎发育的早期,Pax2在前脑、中脑、后脑中表达,随后Pax2主要在中脑-后脑边界和小脑中表达[12]。Peter等人还发现Pax2在中枢神经系统早期区域化的建立过程中发挥重要作用[13]。本实验免疫组织化学染色结果显示Pax2蛋白的高表达部位较保守,主要集中在后脑。E11.5时,Pax2蛋白在脑桥及延髓部位弥漫性表达,E13.5达到高峰。以后随着胎龄增加,Pax2蛋白的表达逐渐降低,到出生后P30表达已经很弱。由于胚胎中期和出生早期是脑发育的快速时期,因此,基于Pax2蛋白表达胚胎期明显高于出生后的这一特点,说明Pax2蛋白可能参与胚胎期神经祖细胞的快速增殖以及向脑桥延髓细胞的分化和迁移,从而有助于早期脑桥延髓部位的区域化建立。
众所周知,小脑在中枢神经系统中的作用越来越重要,不仅在控制协调、平衡等运动功能方面有着明确的作用,而且它在感觉统合、高级认知和情感等非运动功能中也发挥着关键作用[14]。颗粒细胞是小脑中数量最多的神经元,因此,颗粒细胞的形成直接影响着小脑的正常发育[15]。HE染色结果显示胚胎11.5 d小脑原基出现,胚胎15.5 d来源于菱唇的颗粒细胞前体迁移形成外颗粒层。出生后,颗粒细胞前体在P7达到增殖高峰,同时分化向小脑内部移动,形成成熟的颗粒细胞。P30随着颗粒细胞前体退出细胞周期,外颗粒层消失,小脑皮质的3层结构形成[16]。本实验的免疫组织化学染色结果显示E13.5 Pax2蛋白在菱唇开始表达,随着胎龄的增加表达逐渐升高,E17.5在外颗粒层中出现表达。出生后其表达水平继续升高,生后7 d达到高峰,主要分布在内颗粒层和髓质中。P14时出现表达量降低,到P30仅在颗粒层细胞中有少量表达。Pax2蛋白在小脑内的动态表达变化与小脑颗粒细胞前体增殖、迁移和成熟的过程一致,说明Pax2蛋白可能参与了小脑颗粒细胞的形成,从而影响小脑层状结构的正常发育。
尽管本文探讨了Pax2蛋白在C57BL/6J小鼠脑发育进程中的作用,但是对于Pax2如何调控脑组织发育的分子机制还不清楚,因此,接下来我们会结合CRISPR/Cas9技术成功构建的Pax2杂合子敲除小鼠模型[17]进一步开展研究,继续探讨中枢神经系统中Pax2基因的致病机制。

