miR-140抑制卵巢癌细胞增殖促进卵巢癌细胞凋亡及靶向抑制CMTM6表达
杨俊,祝徳,段智慧,张子月*
(1巴中市中心医院,巴中 636000;2西部战区总医院老年科,四川 610036)
卵巢癌是女性生殖器官中常见的三大恶性肿瘤之一,每年因卵巢癌病死的妇女就有14万[1,2]。因此迫切需要寻找针对卵巢癌相关早期诊断方法,为卵巢癌的早期诊断提供相应的理论依据。MicroRNA是真核生物中一类小分子非编码RNA,在细胞的增殖、分化、凋亡和肿瘤发生发展过程中起着重要的作用[3-5]。有研究报道,miR-140在胆管癌[6]、胰腺癌[7]、乳腺癌[8]等多种肿瘤中起着重要的作用。然而,miR-140在卵巢癌中的表达模式及对卵巢癌细胞增殖和凋亡的影响,尚不清楚。趋化素样因子超家族6(chemokine-like factor superfamily 6,CMTM6)广泛存在于人体正常组织中,主要存在于细胞膜上和参与胞内物质循环的胞内体上[9]。Guan[10]等通过分析TCGA数据库和全基因组分析发现,CMTM6能够调控T细胞进行肿瘤细胞的杀伤,提示CMTM6可能促进肿瘤的发生发展,但具体机制尚不清楚。有研究发现,程序性死亡受体-配体1(programmed death receptor ligand 1,PD-L1)在人三阴性乳腺癌[11]细胞中高表达。进一步有研究表明,CMTM6与PD-L1表达呈正相关,共同调控着肿瘤的发生发展[12]。目前关于miR-140是否可能通过调控CMTM6表达影响卵巢癌进展尚不清楚,因此,本研究将探究miR-140是否调控CMTM6及PD-L1的表达及其与卵巢癌细胞增殖、凋亡的关系,为明确miR-140在卵巢癌中发挥的作用提供线索。
材料与方法
1 试剂与仪器设备
人源卵巢癌细胞株SKOV3(货号:40384840451)购自中科院上海细胞库。RPMI-1640培养基(货号:SH30809.01)、胎牛血清(货号:SH30080.03)、0.25%的胰酶消化液(货号:SH30042.01)均购自美国Gibco公司;BCA蛋白检测试剂盒(货号:23250)、MTT检测试剂盒(货号:4890-025-K)购自上海嵘崴达实业有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒(货号:556547)购自美国BD公司;EdU细胞增殖检测试剂盒(货号:CA1170)购自北京索莱宝科技有限公司;TUNEL细胞凋亡检测试剂盒(货号:KGA7037-1)购自上海圻明生物科技有限公司;双荧光素酶报告基因检测试剂盒(货号:KA3784)购自上海群己生物科技有限公司;脂质体LipofectamineTM2000(货号:11668027)购自美国Invitrogen;对照miR-140 inhibitor(Inhibitor NC)、miR-140 inhibitors(Inhibitor)、对照miR-140 mimic(Mimic NC)、miR-140 mimics(Mimic)、pcDNA3.0-CMTM6质 粒 由 生工生物有限公司合成。PrimeScriptTMRT reagent Kit with gDNA Eraser Kit(Perfect Real Time)(货号:RR047AA)、SYBR Premix Ex TaqTM(Tli RNaseH Plus)(货号:RR820A)购自日本TAKARA公司;兔抗人CMTM6(货号:Ab198284)购于英国Abcam公司,兔抗人PD-L1(货号:#15165)购于美国Cell Signaling公司;兔抗人c-Myc(货号:MAB3696)、兔抗人cyclin D1(货号:MAB4314)、鼠抗人Bcl-2(货号:AF810)、鼠抗人Bax(货号:AF820)、鼠抗人Caspase-3(货号:AF835)购于美国R&D;GAPDH抗体和辣根过氧化物酶(HRP)标记的二抗购自美国Santa Cruz公司;FACSCanto II流式细胞仪购自美国BD公司;二氧化碳恒温细胞培养箱购自美国SHEL-LAB公司;酶联免疫标记分析仪购自芬兰雷勃Multiskan MK-3;倒置显微镜购自日本OLYMPUS公司;荧光定量PCR仪购自美国ABI公司;Invitrogen凝胶成像仪购自赛默飞。
2 细胞培养
SKOV3细胞置于10% FBS RPMI-1640培养基,于37 ℃、5% CO2培养箱培养。每天观察细胞状态,每隔两天换一次液,细胞融合度为80%时进行传代培养。
3 分组与处理方法
将SKOV3细胞以1×106cell/mL密度接种1 mL于6孔细胞培养板中,贴壁后分6组:空白对照组(Con)、Inhibitor-NC组、miR-140 inhibitor(Inhibitor)组、Mimic-NC 组、miR-140 mimic (Mimic)组、miR-140 mimic+pcDNA3.0-CMTM6(Mimic+CMTM6)组,按照LipofectamineTM2000说明书进行转染。
4 MTT法及EdU染色测定细胞增殖
MTT法:按方法3处理细胞,以1×105cell/mL接种100 μL于96孔板,4 8h后按照MTT试剂盒说明书在每孔细胞中加入150 μL MTT试剂,孵育4 h,去除上清液加入100 μL二甲基亚砜,待沉淀溶解后在490 nm波长下检测各孔细胞吸光度(optical density,OD)。计算细胞存活率:细胞存活率(%)=实验组OD/空白对照组OD×100%。
EdU染色:将各组SKOV3细胞接种在24孔板培养,24 h后加入适量EdU试剂,按照EdU细胞增殖检测试剂盒步骤检测细胞EdU阳性率:EdU阳性率(%)=(阳性EdU细胞数目/总细胞数目)×100%。
5 流式细胞术及TUNEL染色检测细胞凋亡
流式细胞术:Annexin V-FITC/PI凋亡检测试剂盒用于检测细胞凋亡。按方法3处理细胞,培养24 h后,按照试剂盒的说明书,分别在细胞中先添加FITC-AnnexinV 5 μL 再添加 PI 5 μL,然后室温避光反应20 min,流式细胞仪检测分析。
TUNEL染色:将各组细胞进行细胞爬片,多聚甲醛(4%)固定细胞后PBS洗涤, 含0.1% Triton X-100的PBS孵育2 min,于荧光显微镜下观察,绿色为凋亡细胞,蓝色为细胞核(DAPI),凋亡指数(%)=(凋亡细胞数/总细胞数)×100%。
6 RT-qPCR检测SKOV3细胞CMTM6、PD-L1 mRNA表达水平
按方法3处理细胞,24 h后用Trizol试剂提取细胞总RNA。按RT-PCR试剂盒说明书操作,使用反转录试剂盒合成cDNA,并通过SYBR Green试剂盒检测CMTM6、PD-L1的 mRNA表达水平。循环条件如下:95 ℃ 10 min,然后 94 ℃ 10 s,58 ℃ 25 s和72 ℃ 30 s,32个循环,然后72℃ 10 s。

表1 qRT-PCR引物序列Tab.1 Sequences of qRT-PCR primers
7 Western blot检测CMTM6、PD-L1、增殖和凋亡相关蛋白水平
按方法3处理细胞,24 h后用预冷的PBS将细胞洗涤3次,细胞刮将细胞收集到2 mL的EP管加入蛋白酶抑制剂RAPI裂解液,冰上裂解15 min,13000 r/min离心10 min,取上清液即为细胞总蛋白。用BCA试剂盒检测蛋白浓度。蛋白变性5 min,SDS-PAGE凝胶电泳分离蛋白,恒压转移至PVDF膜后,封闭1 h,加入CMTM6(1∶1000)、PD-L1(1∶1000)、c-Myc(1∶1000)、cyclin D1(1∶1000)、Bcl-2(1∶1000)、Bax(1∶1000)、Caspase-3(1∶ 1000)、GAPDH(1∶ 1000) 抗体,4℃冰箱孵育过夜,TBST洗涤后加入HRP标记的二抗(1∶2000)孵育1 h,ECL底物显色,Invitrogen凝胶成像仪成像,Image J软件测定蛋白条带光密度值,以目的蛋白条带光密度与内参蛋白光密度比值作为目的蛋白相对表达水平。
8 双荧光素酶报告基因分析检测miR-140与CMTM6的靶向关系
应用TargetScan网站确定miR-140与CMTM6结合位点。扩增CMTM6上与miR-140序列相结合的3’-UTR片段,构建pmirGLO-CMTM6-wt野生型载体,经基因突变技术突变结合位点以构建pmirGLOCMTM6-mut突变型载体;将两个重组载体分别与miR-140 mimic、对照miR(miR-NC)共转染至SKOV3细胞,分为CMTM6-WT+Mimic组、CMTM6-WT+miR-NC组、CMTM6-Mut+Mimic组、CMTM6-Mut+miR-NC组,48 h后使用双荧光素酶报告基因检测试剂盒测定SKOV3细胞荧光素酶相对活性。
9 统计学方法
采用SPSS 20.0进行统计学分析。计量数据采用平均数±标准差表示,多组间比较采用方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
结 果
1 沉默miR-140促进SKOV3细胞增殖
为了明确miR-140是否与卵巢癌细胞活力和增殖有关,分析了沉默miR-140对SKOV3细胞增殖的影响。结果显示:与Con组相比,inhibitor-NC组miR-140表达、细胞存活率、EdU阳性率、c-Myc、cyclin D1水平没有显著变化,而miR-140 inhibitor组miR-140表达显著降低,SKOV3细胞活力、EdU阳性率明显增加,c-Myc、cyclin D1等增殖相关蛋白水平也显著增加(表2,图1、2)。

表2 沉默miR-140对SKOV3细胞活力、增殖相关蛋白水平和增殖能力影响的统计学分析Tab.2 Statistical analysis for the effect of silencing miR-140 on the viability, the levels of proliferation-related proteins and the proliferation ability of SKOV3 cells

图1 沉默miR-140对SKOV3细胞增殖的影响。A,SKOV3细胞增殖相关蛋白水平的代表性Western blot 检测;B,SKOV3细胞增殖能力的代表性EdU染色检测Fig.1 Effect of miR-140 inhibitor on proliferation of SKOV3 cells.A, representative Western blot detection for the levels of proliferation-related proteins in the SKOV3 cells; B, representative detection by EdU staining for proliferation of SKOV3 cells
2 沉默miR-140表达抑制SKOV3细胞凋亡
对miR-140表达水平与卵巢癌细胞凋亡的关系分析显示:与对照组相比,Inhibitor-NC组凋亡率、凋亡指数、Bcl-2、Bax、Caspase-3没有显著变化,Inhibitor组细胞凋亡率、凋亡指数和Bax、Caspase-3水平显著降低,Bcl-2水平显著升高(图2,表3)。

图2 沉默miR-140对SKOV3细胞凋亡的影响。A,细胞凋亡的Annexin V-FITC/PI法流式细胞术检测;B,细胞凋亡的TUNEL染色检测;C,细胞凋亡相关蛋白水平的Western blot检测Fig.2 Effect of miR-140 inhibitor on apoptosis of SKOV3 cells.A, detection of apoptosis by Annexin V-FITC / PI flow cytometry; B, detection of apoptosis by TUNEL staining; C, detection of apoptosis related proteins by Western blot

表3 沉默miR-140对SKOV3细胞凋亡影响的统计学分析Tab.3 Statistical analysis for the effect of miR-140 inhibitor on apoptosis of SKOV3 cells
3 沉默miR-140上调SKOV3细胞CMTM6和PDL1 表达
CMTM6和PD-L1参与多种癌症的发生[10-12],为了了解miR-140是否通过调控CMTM6及PD-L1影响卵巢癌细胞增殖和凋亡,应用Western blot和qRTPCR检测了沉默miR-140对SKOV3细胞内CMTM6和PD-L1表达的影响。结果显示:与对照组相比,Inhibitor-NC组CMTM6和PD-L1 蛋白和mRNA水平无显著变化,而inhibitor组CMTM6和PD-L1 蛋白和mRNA水平显著增加(图3),即沉默miR-140使SKOV3细胞CMTM6和PD-L1的表达增加,提示miR-140能调节CMTM6及PD-L1的表达。

图3 沉默miR-140对SKOV3细胞CMTM6和PD-L1 表达的影响。A,CMTM6和PD-L1水平的代表性Western blot检测和统计学分析;B,CMTM6和PD-L1 mRNA表达的qRT-PCR检测;与对照组相比:aP<0.05Fig.3.Effect of miR-140 inhibitor on the expression of CMTM6 and PD-L1 in the SKOV3 cells.A, aP<0.05 compared with control group.A, representative Western blot detection and statistical analysis of the level of CMTM6 and PD-L1; B, qRT-PCR assay for mRNA expression of CMTM6 and PD-L1; aP<0.05, compared with the control group
4 过表达CMTM6减弱miR-140过表达对SKOV3细胞增殖的抑制
进一步对CMTM6在miR-140影响SKOV3细胞增殖中的作用检测显示:Mimic-NC组miR-140表达、细胞活力、c-Myc、cyclin D1增殖蛋白水平和EdU阳性率与对照组没有显著差异;与对照组比较,过表达miR-140的Mimic组miR-140表达显著增加,SKOV3细胞活力、EdU阳性率明显降低,c-Myc、cyclin D1增殖相关蛋白水平也显著降低,miR-140过表达所致的这些变化可被过表达CMTM6明显减弱(表4,图4)。
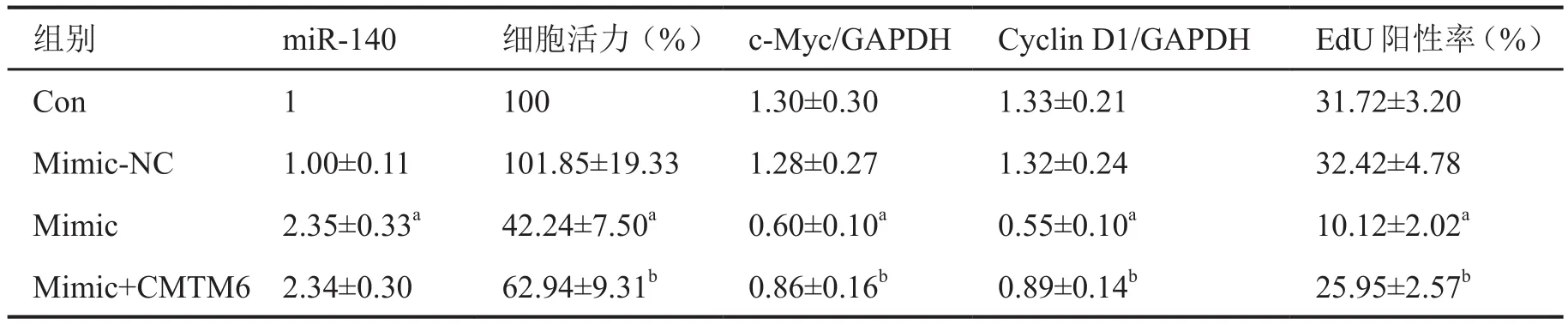
表4 过表达miR-140对SKOV3细胞活力、增殖相关蛋白水平和增殖能力影响的统计学分析Tab.4 Statistical analysis for the effect of smiR-140-overexpression on the viability, the levels of proliferation-related proteins and the proliferation ability of SKOV3 cell
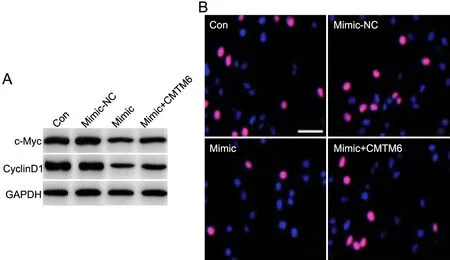
图4 过表达miR-140对SKOV3细胞增殖的影响。A,SKOV3细胞增殖相关蛋白水平的代表性Western blot 检测;B,SKOV3细胞增殖的代表性EdU染色检测(比例尺,50 µm)Fig.4 Effect of miR-140-overexpression on the proliferation of SKOV3 cells.Representative Western blot detection for the levels of proliferation-related proteins in the SKOV3 cells; B, detection by EdU staining for the proliferation of SKOV3 cells; scale bar, 50 µm
5 过表达CMTM6抑制miR-140过表达对SKOV3细胞凋亡的促进
对CMTM6在miR-140影响SKOV3细胞凋亡中的作用检测显示:与对照组相比,Mimic-NC组凋亡率、凋亡指数、Bcl-2、Bax、Caspase-3没有显著变化,过表达miR-140 (Mimic组)细胞凋亡率、凋亡指数、Bax、Caspase-3显著升高,Bcl-2显著降低;与Mimic组相比,Mimic+ CMTM6组凋亡率、凋亡指数、Bax、Caspase-3显著降低,Bcl-2显著升高,即过表达CMTM6能显著抑制过表达miR-140对SKOV3细胞凋亡的促进(图5,表5)

图5 过表达CMTM6对miR-140过表达促进SKOV3细胞凋亡作用的影响。A,细胞凋亡的代表性流式细胞术分析;B,凋亡相关蛋白水平的代表性Western blot检测;C,细胞凋亡的代表性TUNEL染色(比例尺,100 µm)Fig.5 Effect of overexpression of CMTM6 on overexpression of miR-140’s promoting effect on apoptosis of SKOV3 cells

表5 过表达CMTM6对miR-140过表达促进SKOV3细胞凋亡作用影响的统计学分析Tab.5 Statistical analysis for effect of overexpression of CMTM6 on overexpression of miR-140’s promoting effect on apoptosis of SKOV3 cells
6 过表达CMTM6减少miR-140过表达对PD-L1表达的抑制
为了明确miR-140是否通过CMTM6影响PDL1的表达,继而检测了过表达CMTM6对过表达miR-140的SKOV3细胞中PD-L1表达的影响。Western blot检测显示:与对照组相比,Mimic-NC组中CMTM6和PD-L1水平没有显著变化,Mimic组中CMTM6和PD-L1水平显著降低;而与Mimic组相比,Mimic+ CMTM6组中CMTM6和PD-L1 mRNA表达水平显著升高(图6A)。qRT-PCR检测显示:与对照组相比,Mimic-NC组中CMTM6和PD-L1 mRNA表达水平没有显著变化,Mimic组中CMTM6和PD-L1 mRNA表达水平显著降低;而与Mimic组相比,Mimic+ CMTM6组中CMTM6和PDL1 mRNA表达水平显著升高(图6B)。

图6 CMTM6在miR-140过表达对SKOV3细胞PD-L1表达影响中的作用检测。A,CMTM6和PD- L1水平的Western blot检测;A1,CMTM6和PD- L1水平的代表性 Westernblot检测结果;A2,CMTM6和PD- L1水平的统计学分析;B,qRT-PCR检测CMTM6和PD- L1 mRNA水平的统计学分析;与Con相比,aP<0.05;与Mimic组相比,bP<0.05;n=6Fig.6 Detection for the role of CMTM6 in the effect of overexpression of miR-140 on PD-L1 expression in SKOV3 cells.A, representative Western blot examination of the levels of CMTM6 and PD-L1; B, statistical analysis for the levels of CMTM6 and PD-L1; aP<0.05, compared with control group;bP<0.05, compared with miR-140 mimics group; n=6
7 miR-140靶向抑制CMTM6表达
TargetScan预测显示:miR-140和CMTM6间存在结合位点(图7A)。双荧光素酶报告基因分析显示:miR-140 mimics能显著抑制野生型CMTM6表达,对突变型CMTM6的表达无明显影响(图7B),证明miR-140能靶向抑制CMTM6的表达。

图7 miR-140对CMTM6靶向作用分析。A,miR-140与CMTM6靶向结合位点的TargetScan预测;B,miR-140对CMTM6靶向作用的双荧光素酶报告基因分析;与Mimic-NC组比较,aP<0.05;n=6。Fig.7 Analysis of the targeting effect of miR-140 on CMTM6.A, TargetScan prediction of targeted binding sites of miR-140 and CMTM6; B, analysis of double luciferase reporter gene for the targeting effect of miR-140 on CMTM6; aP<0.05, compared with Mimic-NC group; n=6.
讨 论
卵巢癌在女性生殖器官肿瘤中被认为是最致命的妇科肿瘤疾病,由于早期发病不容易察觉,并且诊断困难,导致其发病率和死亡率较高[13]。随着医学的发展针对卵巢癌的治疗有些改善,但是卵巢癌治疗效果不理想及预后较差。因此寻找新的靶点对于提高卵巢癌的治疗效果非常重要。
microRNA是由长约22个核苷酸组成的一类小分子非编码RNA。研究发现,它通过调控重要的靶基因在肿瘤的发生发展过程中参与肿瘤的调节。miR-140最初被发现在软骨组织中,编码该基因位于16号染色体上[14]。有研究表明,过表达miR-140
可抑制肺癌细胞的迁移和侵袭从而抑制肺癌发生发展[15];miR-140通过靶向抑制YES1基因的表达从而抑制胃癌细胞的增殖、迁移及侵袭[16];miR-140通过调控自噬及Smad2的表达抑制结直肠癌干细胞的存活及侵袭能力[17];沉默miR-140能够促进早期乳腺癌癌症干细胞的形成[18],然而,miR-140对乳腺癌细胞的调控机制尚不清楚。本研究发现,下调miR-140表达可促进卵巢癌细胞增殖、c-Myc、cyclin D1、Bcl-2水平,抑制细胞凋亡、Bax、Caspase-3蛋白水平。该结果表明,miR-140表达沉默促进卵巢癌细胞恶性生物学行为;而过表达miR-140能显著抑制卵巢癌细胞增殖及下调c-Myc、cyclin D1、Bcl-2蛋白,促进细胞的凋亡,并上调Bax、Caspase-3蛋白水平。这说明miR-140过表达可能有助于抑制SKOV3细胞的恶性增殖,可能通过某些机制来调节卵巢癌细胞的增殖。
肿瘤的发生和免疫系统有着密切的关系。PDL1在多种肿瘤细胞的表面表达上调,包括卵巢癌、肾癌、肺癌、黑色素瘤等,与受体PD-1结合能对T细胞的增殖、转移、免疫效能的发生产生抑制作用,实现肿瘤免疫逃逸[19,20]。因此阻断PD-L1与受体PD-1结合已经成为肿瘤治疗的热点。CMTM6存在于不同的细胞器上,它在不同的肿瘤组织中表达的水平有差异,在肝癌、卵巢癌组织中高表达,而在肺癌、肾癌组织中呈低表达。Burr[21]等通过用全基因组研究发现,CMTM6可以与PD-L1结合并在细胞表面进行停留,进而调控肿瘤的发生发展,说明CMTM6对PD-L1的调控起着关键作用。但是他们是如何进行调控的我们目前的研究还不是很清楚,也不确定CMTM6在肿瘤中处于一种什么样的状态。Mezzadral[22]等通过基因敲除CMTM6观察到,敲除CMTM6能抑制PD-L1泛素化起到保护PD-L1的作用,从而促进肿瘤细胞的增殖。本研究发现,下调miR-140表达可促进CMTM6及PD-L1表达,而miR-140过表达可显著抑制CMTM6及PD-L1表达,该结果表明miR-140对SKOV3细胞增殖、凋亡的影响可能与其调控CMTM6表达有关。基于此,本研究通过对其验证发现,CMTM6高表达可促进PD-L1表达,同时也促进卵巢癌细胞的增殖,抑制细胞的凋亡;本研究通过双荧光素酶报告基因实验验证了CMTM6与miR-140的靶向关系,结果显示,CMTM6是miR-140的靶基因,这说明miR-140过表达可能通过负调控CMTM6来抑制SKOV3细胞的增殖、凋亡及PD-L1的表达。
综上所述,过表达miR-140可能通过抑制CMTM6表达抑制卵巢癌细胞的增殖,诱导细胞凋亡、下调PD-L1的表达。本研究不仅对miR-140与CMTM6的靶向关系进行了研究,还对卵巢癌的发生机制研究具有重要意义。然而,miR-140通过调控CMTM6来调节卵巢癌细胞增殖、凋亡及PD-L1表达的分子机制仍需进一步研究。

