热敏蛋白TRPV1在小鼠睾丸生精小管中的表达特征
赵妍秋,刘博,魏金花*,李臻*
(1延安大学医学院组织学与胚胎学教研室,延安 716000;2空军军医大学人体解剖与组织胚胎学教研室,西安 710032;3中国人民解放军中部战区空军医院,大同 037000)
正常的精子发生过程对于维持物种的繁衍稳定至关重要,睾丸生精上皮是正常的精子发生过程的场所。精子的发生过程包括精原细胞的增殖分化、精母细胞的减数分裂以及精子细胞的成熟。这些过程受到激素、旁分泌因子、基因和表观遗传调控因子等内在因素的参与调控[1],同时外界环境因素,例如辐射,重金属和有害的化学物质,以及不良生活习惯也会影响精子发生过程[2]。其中,环境温度的变化对于精子的发生过程具有重要影响[3]。睾丸的温度通常保持低于身体核心温度2~6 ℃,当睾丸温度升高或机体体温调节障碍时,导致精子生成减少[4],诱导生殖细胞凋亡和DNA损伤,影响精子质量,造成雄性不育或者生育力降低[5]。
瞬时受体电位香草酸亚型1(transient receptor potential vanilloid receptor-1, TRPV1)是一种广泛存在于哺乳动物体内的热敏通道,可以被高温(>43 °C)、细胞外酸性环境和辣椒素等配体激活[6],并且这些因素可以协同促进TRPV1活性[7]。TRPV1属于非选择性阳离子通道,对Na+和Ca2+有较高通透性,在口腔和皮肤等器官中参与炎症和疼痛等过程[8]。除此之外,TRPV1在非感觉神经元中有具有重要作用,广泛参与细胞增殖、凋亡和体内多种生理病理过程[9]。另有研究发现TRPV1在人和大鼠的前列腺、睾丸、阴茎和膀胱组织中有表达[10],但其在小鼠睾丸中的具体细胞定位尚无系统研究。本研究采用实时荧光定量PCR(qPCR)、蛋白免疫印迹、免疫组织化学染色和免疫荧光双重染色技术,检测TRPV1在小鼠睾丸发育阶段和生精周期的表达,以及其在小鼠睾丸各生精上皮中的定位情况,为今后深入研究其在睾丸热应激中的功能与作用提供基础。
材料与方法
1 实验动物
出生后 7 d、14 d、21 d、28 d、35 d、56 d SPF级C57小鼠各3只,体重(20±10)g成年小鼠20只,均购自空军军医大学实验动物中心。
2 主要试剂
RNA提取液Trizol plus、反转录试剂盒PrimeS-cript™ RT reagent Kit和荧光定量试剂盒SYBR Primix Ex Taq II均购自日本Takara公司;定量PCR所用引物由武汉奥科生物技术有限公司合成;免疫组织化学染色试剂盒VECTASTAIN ABC Kit购自美国Vector Laboratories公司;兔抗TRPV1(ab31895)和鼠抗SYCP3(ab97672)购自Abcam公司;鼠抗SOX9(14-9765-95)购自美国Invitrogen公司;鼠抗PLZF(sc-28319)购自Santa Cruz公司;鼠抗β-actin(T0022)购自Affinity公司;山羊抗小鼠IgG(ZB-2305)购自中杉金桥;山羊抗兔IgG(SGA10002)购自AntiProtech公司;FITC标记的羊抗鼠和TRITC标记的羊抗兔二抗购自美国Jackson ImmunoResearch 公司。
3 动物取材
小鼠脱颈处死,取一侧睾丸用于提取RNA和蛋白,另一侧睾丸固定于4%多聚甲醛(多聚甲醛4 g,PBS溶液100 mL,加热搅拌溶解后用10 mmol/L NaOH溶液调pH为7.4),用于免疫组织化学和免疫荧光染色。
4 总RNA提取
采用TRIzol法提取总RNA。收集的睾丸组织加入1 mL TRIzol溶液,充分吹打,冰上裂解5 min。加入0.2 mL氯仿,颠倒混匀,12000 r/min、4 ℃离心15 min;转移上清到新Eppendorf管中,加入等体积的异丙醇,颠倒混匀;-20 ℃冰箱放置30 min,13500 r/min、4 ℃离心10 min;弃上清,加入1 mL 75%乙醇,颠倒混匀,13500 r/min、4 ℃离心10 min;弃上清,离心管开盖室温放置直至液体完全挥发;加入适量DEPC水,溶解RNA沉淀。Nano-Drop-2000分光光度计测定RNA纯度和浓度,取吸光度A260/A280=1.8~2.0的样品进行逆转录。
5 逆转录PCR
琼脂糖凝胶电泳法检测:用PrimeScript™ RT reagent Kit试剂盒进行RT-PCR。10 μL基因组DNA去除反应体系如下:2 μl 5×gDNA Eraser Buffer,1 μL gDNA Eraser,2 μg RNA,RNase Free dH2O 定容;反应条件42 °C,2 min。20 μL反转录反应体系如下:4 μL 5×PrimeScript Buffer 2(for Real Time),1 μL PrimeScript RT Enzyme Mix I,1 μL RT Primer Mix,10 μL上一步反应液,4 μL RNase Free dH2O;反应条件:37 °C 15 min,85 °C 5 s。以 cDNA 为模板进行目的基因的PCR扩增,20 μL反应体系,反应条件为95 ℃5 min,94 ℃30 s,58 ℃ 30 s,72 ℃ 60 s,72 ℃ 延伸 10 min,第二步至第4步35个循环;TRPV1上游引物为:5’-TCTGCTGGAATCCTCGGGTGTAG-3’,下游引物为:5’-CATGCTGGTGTCTGTGGTACTGTAC-3’,预计产物大小为118 bp;β-actin为内参基因,其上游引物为 5’-GGTGGGAATGGGTCAGAAGG-3’,下游引物为 5’-GTACATGGCTGGGGTGTTGA-3’,预计产物大小268 bp。使用含有DNA-red核酸染料(IC-6009,CellProTM)的 2%琼脂糖凝胶电泳检测PCR扩增产物。
实时荧光定量PCR(q-PCR)检测:使用SYBR Premix Ex Taq II试剂盒进行实验。以cDNA为模板进行目的基因的PCR扩增,20 μL反应体系如下:10 μL SYBR Premix Ex Taq II (Tli RNaseH Plus) (2×),0.8 μL PCR Forward Primer (10 µmol/L),0.8 μL PCR Reverse Primer (10 µmol/L),2 μL cDNA,6.4 μL RNase Free dH2O。反应条件为 95 ℃ 3 min(1 cycle);95 ℃5 s,60 ℃ 30s(40 cycle)。通过分析扩增曲线和融解曲线确定PCR扩增的成功性,根据得到的CT值,运用2-△△CT公式计算TRPV1 mRNA在各组中的相对表达量。
6 蛋白免疫印迹
用含苯甲基磺酰氟(终浓度1 mmol/L)的RIPA裂解液将收集的睾丸组织中充分裂解,离心得到蛋白样品;SDS-PAGE电泳分离蛋白质,再电转至硝酸纤维素膜。5%脱脂牛奶封闭1.5 h, TRPV1一抗4 °C孵育过夜,次日山羊抗兔IgG室温孵育2 h,膜上滴加发光液(IC-8001, InCellGenE LLC, 美国)后,Clinx化学发光仪(ChemiScope 6000,上海勤翔科学仪器有限公司)对膜进行扫描成像。
7 免疫组织化学染色
取睾丸用4%的多聚甲醛固定过夜,梯度乙醇脱水、二甲苯透明后石蜡包埋,石蜡切片机切片。将石蜡切片在二甲苯与梯度降乙醇复水后,在10 mmol/L柠檬酸钠缓冲液(pH 6.0)中微波修复抗原15 min,冷却至室温。PBS清洗后,入0.03%甲醇-0.3%过氧化氢中室温孵育30 min;PBS清洗5 min×5次后滴加与二抗来源相同的正常血清室温封闭30 min;抗TRPV1一抗4° C过夜孵育,次日切片取出复温1 h,PBS清洗5 min×5次;滴加生物素标记的二抗室温孵育3 h,PBS清洗5 min×5次;ABC复合物孵育切片1 h,PBS清洗5 min×5次,DAB显色;自来水冲洗切片,苏木精复染1 min。切片脱水、透明、树胶封片,用VS200玻片扫描仪(Olympus)成像、观察结果。
8 免疫荧光双重染色
将石蜡切片在二甲苯与梯度乙醇中复水,在10 mmol/L柠檬酸钠缓冲液(pH 6.0)中微波修复抗原15 min,冷却至室温。PBS清洗5 min×2次,正常血清封闭30 min,TRPV1一抗与SOX9、PLZF和SYCP3分别混合后,滴加到组织切片上,4 °C过夜孵育。次日切片取出复温1 h,PBS清洗5 min×5次,TRITC标记的羊抗兔IgG和FITC标记的羊抗小鼠IgG混合二抗室温避光孵育3 h,PBS清洗5 min×5次。用4,6-二氨基-2-苯基吲哚(DAPI)对细胞核进行染色,用FV1000共聚焦显微镜(Olympu)观察结果。
9 统计学分析
qPCR和Western blot结果使用Image J软件进行光密度值测量,使用GraphPad PRISM9进行统计学分析,所有数据表示为均值±标准误,所有实验至少重复3次。
结 果
1 TRPV1在生后发育小鼠睾丸的表达变化
按照小鼠睾丸发育周期,提取7 d、14 d、21 d、28 d、35 d和56 d的小鼠睾丸RNA和蛋白,应用RTPCR和Western blot技术检测TRPV1 mRNA和蛋白在小鼠睾丸不同发育周期的表达水平。结果显示,TRPV1 mRNA在小鼠睾丸发育初期即表达,在出生后21 d时显著增高,在28 d到达顶峰,之后随着小鼠发育至成年逐渐下降(图1A、B)。TRPV1蛋白在小鼠睾丸发育阶段表达水平变化模式与mRNA一致(图1C、D)。
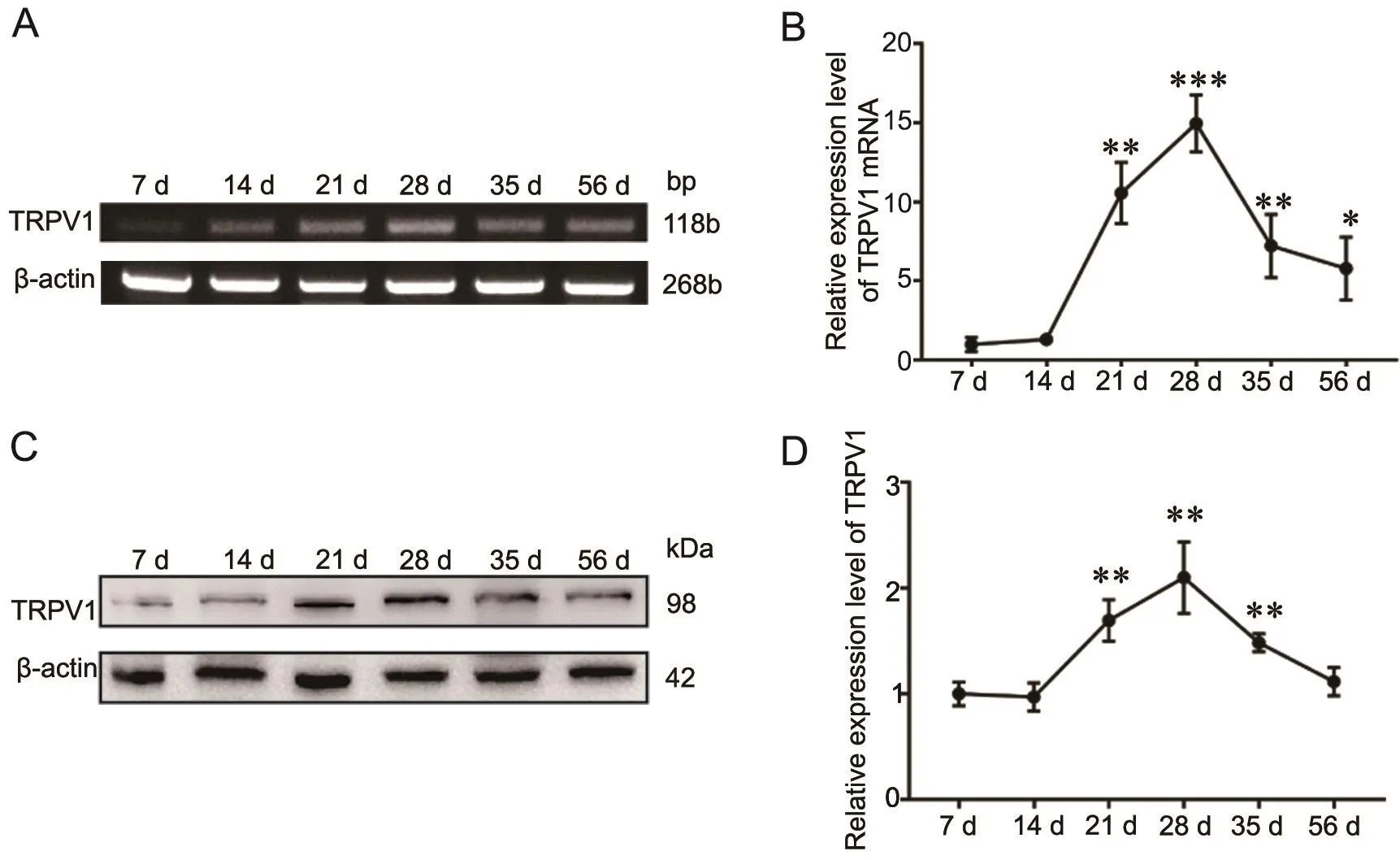
图1 TRPV1在7—56 d小鼠睾丸的表达水平检测。A,TRPV1 mRNA代表性RT-PCR检测结果;B,qPCR法检测的TRPV1 mRNA水平的统计学分析;C,TRPV1蛋白水平的代表性免疫印迹检测结果;D,免疫印迹检测的TRPV1蛋白水平的统计学分析。与7 d组比较: *P<0.05,**P< 0.01,***P< 0.001; n=3Fig.1 Detection of TRPV1 expression in the mouse testes during 7 d-56 d developmental stage.A, presentative RT-PCR detection results of TRPV1 mRNA; B, statistical analysis of TRPV1 mRNA level detected by qPCR; C, representative Western blot detection of TRPV1 protein level; D, statistical analysis of TRPV1 protein level detected by Western blot.Compared with 7 d group: *P< 0.05, **P< 0.01, ***P< 0.001; n=3
2 TRPV1在成年小鼠睾丸不同生精上皮周期的定位
为明确TRPV1在小鼠睾丸不同生精周期中的定位,我们利用免疫组织化学染色法观察了TRPV1在成年小鼠睾丸不同生精周期的表达,使用IgG抗体处理组作为阴性对照。结果显示TRPV1在生精上皮各个周期的生精细胞和支持细胞膜上都有表达,其中I-III期表达相对较弱,从IV期开始表达相对增强,并且在各级生精细胞中,初级精母细胞的表达相对较强(图2)。
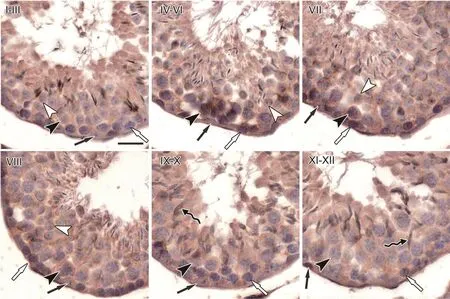
图2 成年小鼠睾丸生精上皮周期中TRPV1表达的免疫组织化学检测。黑箭,支持细胞; 白箭,精原细胞;黑箭头,初级精母细胞;白箭头,圆形精子细胞;曲尾箭,长型精子细胞。比例尺,20 µmFig.2 Immunohistochemical detection of TRPV1 expression in the seminiferous epithelia of the adult mouse testes.Black arrow, Sertoli cells; white arrow, spermatogonia; black arrow head, primary spermatocytes; white arrow head, round spermatid; curved tail arrow, elongated spermatid.Scale bar,20 µm
3 TRPV1在成年小鼠睾丸中的细胞定位
为进一步明确TRPV1在生精小管的细胞定位,我们首先使用睾丸支持细胞特异性的核标志物SOX9与TRPV1进行免疫荧光双标染色,结果显示TRPV1与睾丸支持细胞存在共定位(图3A)。应用精原干细胞特异性的核标志物PLZF与TRPV1进行免疫荧光双标染色显示,TRPV1同样在PLZF阳性细胞上有表达(图3B)。以减数分裂开始的标志物SYCP3[11]作为精母细胞特异性的核标志物与TRPV1进行免疫荧光双标染色发现,TPV1与SYCP3阳性细胞也存在共表达(图3C)。因此,TRPV1在睾丸支持细胞、精原细胞和精母细胞膜上均有表达。

图3 TRPV1在成年小鼠睾丸生精上皮支持细胞(A)、精原细胞(B)和精母细胞(C)定位的免疫荧光双标检测Fig.3 Double immunofluorescence staining for detecting the localization of TRPV1 in the Sertoli cell (A), spermatogonia (B) and spermatocyte (C) of the spermatogenic epithelia of the adult mouse testes
讨 论
精子发生是一个高度复杂的过程,包括精原干细胞的分化、精母细胞的减数分裂以及精子的变形等过程。小鼠的生精发育周期为8.6~8.9 d,从精原细胞发育至成熟精子细胞共需39~40 d[12],精子的形成发生过程产生任何异常都有可能导致生精失败。TRPV1作为热敏蛋白,可以感受渗透压、pH和电压等外界刺激,可能参与调节精子各项功能,其在男性生殖中的作用需要进一步研究探索。我们的研究系统的从TRPV1在小鼠睾丸的表达定位入手,为进一步研究TRPV1在男性生殖系统中的功能打下基础。
本研究首先通过RT-PCR和蛋白免疫印记检测发现,TRPV1在7 d的小鼠睾丸就开始有表达,21~28 d表达量显著增加,之后随着小鼠发育至成年逐渐下降。在小鼠发育到21~28 d这个阶段,睾丸中精母细胞正在进行减数分裂,生精上皮各类细胞中初级精母细胞的数量最多。我们进一步的免疫组织化学染色发现,TRPV1表达于睾丸生精上皮的各个时期,从IV期开始表达相对增加,并且在初级精母细胞的表达相对较多,由此提示TRPV1可能在精母细胞的减数分裂中发挥重要作用。精母细胞对温度较为敏感,在睾丸温度达到37 °C时,只有小部分精母细胞可以分化达到粗线期和双线期;而当睾丸温度升高到38 °C,粗线期和双线期精母细胞均无法存活,精母细胞无法完成染色体的联会配对,最终发生凋亡[13]。Trpv1-/-小鼠在高热环境下生殖细胞凋亡较WT小鼠少,提示TRPV1在热激活条件下对生殖细胞起到保护作用[14]。TRPV1的热保护作用以及其在精母细胞中的高表达提示其可能与精母细胞减数分裂过程中对温度的较高敏感性相关。此外,我们通过对成年小鼠睾丸的免疫荧光染色,发现TRPV1在成年小鼠睾丸支持细胞膜上也有表达。支持细胞作为生精上皮中唯一的体细胞,对生精细胞起支持和营养作用,并为精子的发生提供有利的微环境[15]。有研究表明TRPV1可以调节大鼠睾丸支持细胞中的酸感应Cl-通道(acid sensing Cl-channel, ASCC)[16],这也支持TRPV1参与精子发生过程的调节。
除了对生殖细胞的热保护作用,同时也有研究报道TRPV1参与生殖细胞凋亡过程。Trpv1-/-小鼠平均寿命比WT小鼠长约100 d,并且老年Trpv1-/-小鼠睾丸细胞凋亡较WT小鼠少[17];TRPV1的激动剂辣椒素(capsaicin, CAP)可以通过激活TRPV1从而引起精原干细胞凋亡[18]。TRPV1作为阳离子通道,可以通过调节[Ca2+]i信号,诱导线粒体释放凋亡诱导因子(apoptosis-inducing factor, AIF)和细胞色素c,激活半胱天冬酶,从而调节细胞凋亡[19]。因此在不同的激活因素下,TRPV1对生殖细胞的作用可能截然不同,甚至完全相反。相较于传统的细胞凋亡途径,TRPV1在不同的激活条件下是如何发挥细胞凋亡或保护作用,以及具体的分子机制仍需进一步探索。

