中高温大曲中霉菌的分离及其麸曲制备
郑自强,卫春会,张立伟,邓杰,黄治国,刘美君,任志强*
(1.四川轻化工大学生物工程学院,四川宜宾 644000)(2.酿酒生物技术及应用四川省重点实验室,四川宜宾644000)(3.长春工业大学化学工程学院,吉林长春 130000)
中国白酒在食品饮料行业具有重要地位。酒曲在白酒酿造的糖化、产酒、生香过程均有参与,被称为“酒之骨”,有举足轻重的作用[1]。大曲是酒曲的突出代表,其以小麦为主要原料,在酿造过程中作为微生物制剂和酶制剂参与风味物质的形成[2],霉菌是大曲中主要的菌种之一,可分泌糖化酶、蛋白酶等多种功能酶,可促进原料的分解利用,如糖化酶可将淀粉中的α-1,4键和α-1,6键切断,使淀粉转化为可发酵性糖[3],而霉菌在酿造生产中一般是通过制作麸曲来体现其酶学功能。俞剑燊等[4]从曲块中分离出2株高产糖化酶和淀粉酶的曲霉菌株BR84和BR88,混合制曲后其糖化酶和蛋白酶活力分别达1099.82 U/g和284.44 U/g;HUI X[5]通过优化一株米曲霉的产酶条件使酶产量增加了17.50%;宋克伟[6]制作米根霉菌麸曲,应用于酿造,提高了成品酒的出酒率和优质酒率。麸曲是以麸皮为主要原料,蒸煮冷却后接入微生物,经培养繁殖产酶,然后低温烘干而成的散曲[7],由于麸曲制作简单,原料成本低廉,且能够作为微生物培养的优良载体,在工业上已经广泛应用,包括菌种的改良、工艺的优化和应用的多样化等[8]。应用大曲进行白酒生产存在出酒率低的局限性,而出酒率取决于酒曲的糖化能力,故选育出能在实际酿造生产中起作用的高产糖化酶菌株,具有重要意义[9,10]。
本研究从中高温大曲中分离出2株高产糖化酶菌株,并用于强化麸曲,以糖化酶活力作为考察指标,从制曲原料、培养时间、加水量、干燥温度四个因素考察其对制曲生产性能的影响,并通过固态发酵测试成品麸曲的酿造性能,以期形成一套开发利用大曲微生物的方法体系,为实际生产提供参考。
1 材料与方法
1.1 材料与试剂
中高温大曲,取自川南某浓香型酒厂;麸皮、高粱、麸曲、活性干酵母、小曲,市售;NaOH、H2SO4、HCl(分析纯),成都市科龙化工试剂厂;蛋白酶K,德国Merck公司;DNA琼脂糖凝胶回收试剂盒,北京智杰方远科技有限公司。
1.2 仪器和设备
CP214电子天平,奥豪斯仪器有限公司;GI54DS立式自动压力蒸汽压灭菌器,致微仪器有限公司;LS-I201微生物培养箱,上海博讯生物仪器有限公司;DM3000显微照相机,德国Leica公司;5430R高速冷冻离心机,德国Eppendorf公司;C1000Touch PCR仪,美国Bio-Rad公司;Super alcomat全自动酒精度测试仪,德国Julabo公司。
1.3 培养基
马铃薯葡萄糖琼脂培养基(PDA):马铃薯 200 g/L、葡萄糖20 g/L、琼脂20 g/L,自然pH。
1.4 方法
1.4.1 霉菌的分离纯化
称取10 g大曲溶于加有玻璃珠的90 mL无菌水中,充分振荡20 min,计为10-1,逐级稀释至10-6,使用 PDA培养基进行平板涂布培养,适宜梯度下挑取不同形态菌落进行划线分离纯化,重复操作3次,将纯化的菌株转接斜面培养基,低温保存[11]。
1.4.2 霉菌的形态学鉴定
将纯化菌株点植入PDA培养基,28 ℃恒温培养48 h~72 h,观察菌落形态结构,挑取菌丝,染色后于显微镜下观察菌株形态特征,对菌株进行鉴定[12]。
1.4.3 霉菌的分子生物学鉴定
将恒温 28 ℃,培养 48 h的马铃薯液体培养基5000 r/min离心10 min集菌,提取真菌基因组DNA,以 ITS1:5’-TCCGTAG-GTGAACCTGCGG-3’为正向引物,ITS4:5’-TCCTCCGCTTATT-GATATGC-3’为反向引物扩增菌株rDNA-ITS序列。
PCR反应体系:引物ITS1和ITS4均1 μL;模板(基因组)2 μL;Taq PCR Master Mix 25 μL;超纯水21 μL。
PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s;55 ℃退火30 s;72 ℃延伸90 s;循环30 次;72 ℃终延伸10 min;4 ℃保存。
PCR扩增产物送上海生物工程公司测序。测序结果在 Gen Bank数据库对序列比较分析,利用MEGA7.0软件构建发育树。
1.4.4 测定方法
霉菌麸曲糖化酶活力的测定参照QB/T 4257-2011《酿酒大曲通用分析方法》中的方法,使用全自动酒精度测试仪测定酒精度[13]。
糖化酶活定义:在35 ℃、pH 4.6条件下,1 g大曲1 h转化可溶性淀粉生产葡萄糖的毫克数定义为一个酶活力单位(U),以U/g表示[14]。
1.5 纯种霉菌麸曲生产性能测试
1.5.1 制曲性能测试
以JQ-1、JQ-2为出发菌株,以糖化酶活力为考察指标,通过前期预实验,固定培养温度为 35 ℃,分别考察在不同的制曲原料(麸皮:高粱=4:1、麸皮:米粉=4:1、麸皮:全麦粉=4:1、全麸皮)、培养时间(0、24、36、48、60、72、96、120、144 h)、加水量(40%、45%、50%、55%、60%、65%、70%)和干燥温度(35、40、45、50、55 ℃)等条件下对麸曲糖化酶活力的影响。
制曲工艺流程[15-16]:
原料→加水→拌曲→蒸麸→装瓶→灭菌→接种→恒温培养→干燥储藏→浅盘麸曲
加水、拌曲、蒸麸:称取原料于三角瓶,加去离子水混匀,使麸皮充分吸水,调节水分含量,于121 ℃高压蒸汽灭菌处理30 min,保证其无菌状态[17]。
接种、恒温培养、干燥储藏:将活化后的菌种在马铃薯葡萄糖液体培养基中培养至孢子数为 106CFU/mL的菌悬液接种于无菌麸皮中,控制接种量为5%,恒温培养,待菌种培育完成后控温烘干,储藏[18]。
1.5.2 固态发酵酿造性能测试
固态发酵相较于液态发酵具有更好的稳定性和重现性,为探究麸曲的生产性能,进行固态酿造试验。以高粱为原料,麸曲和活性干酵母为糖化发酵剂进行固态发酵试验,检测麸曲白酒固态发酵条件下的出酒率和酒精度变化,初探其运用生产的酿造性能[19]。
酿酒工艺流程:
高粱→泡粮→蒸粮→打量水→下曲→拌曲→堆积→发酵→蒸酒→储存
泡粮、打量水、蒸粮:称取高粱,加入沸水浸泡高粱过夜,将浸泡后的高粱蒸熟,打量水,使粮食最终含水量为高粱干重的47%。
下曲、拌曲:试验组曲采用的是纯种霉菌麸曲,起糖化作用,缺乏酵母将生成的糖分转化为酒精,结合前期酵母和麸曲配比的预实验结果,确定以接种量为0.4%的纯种霉菌麸曲和0.6%的活性干酵母为试验组,以接种量为0.4%的2种纯种市售麸曲和0.6%的活性干酵母为对照2和对照3。接入曲后,待粮食冷却,将曲拌入粮糟混匀。
堆积、发酵、蒸酒、储存:堆积24 h,充分糖化以及保证酵母充分繁殖。入缸泥封发酵15 d后蒸酒。测定馏出酒的酒度,馏取酒精度高于10% vol的酒于适宜环境条件密封储存。
1.6 数据处理
2 结果与分析
2.1 菌株形态学鉴定
菌株在PDA培养基上28 ℃培养48 h后,对菌落形态进行观察,以菌落的直径与透明圈直径的比值作为是否高产糖化酶的初步评判依据[20],初步分离出两株形态特征不同的可能高产糖化酶的菌株,编号为JQ-1、JQ-2。菌株JQ-1为黑褐色,呈根状分枝,有孢子,孢子为球形黑色,菌丝无隔,分枝状;菌株JQ-2为灰白色,呈根状分枝;有球形孢子囊,无横托,菌丝无隔,分枝状。菌株菌落形态特征观察结果见表1。

表1 菌株JQ-1与菌株JQ-2的形态特征Table 1 Morphological characteristics of strain JQ-1 and strain JQ-2
2.2 系统发育学分析
测序结果表明,菌株JQ-1和JQ-2的rDNA-ITS序列基因片段全长分别约1050 bp和1010 bp(图1),用BLAST软件在Gen Bank数据库中对比分析,发现菌株JQ-1与根霉属(Rhizopus)的菌株高度相关,JQ-2与毛霉属(Mucor)的菌株高度相关。用 MEGA7.0软件构建系统进化树(图2、图3)。由系统发育树结果看出,菌株JQ-1与米根霉菌株(Rhizopusoryzae)(序列号MT259131.1)为同一支,同源性为100%,菌株JQ-2与卷枝毛霉菌株(Mucorcircinelloides)(序列号HQ845293.1)为同一支,同源性100%。
综合形态学鉴定和rDNA-ITS序列分析结果,将JQ-1菌株鉴定为接合菌纲(Zygomycetes)、毛霉目(Mucorales)、毛霉科(Mucoraceae)、根霉属(Rhizopus)、米根霉菌(Rhizopusoryzae);将菌株 JQ-2鉴定为藻状菌纲(Phycomycetes)、毛霉目(Mucorales)、毛霉科(Mucoraceae)、毛霉属(Mucorracemosus)、卷枝毛霉菌(Mucorcircinelloides)。
2.3 纯种霉菌麸曲生产性能测试
2.3.1 制曲条件优化
2.3.1.1 不同原料对麸曲酶活力的影响
糖化酶又为葡糖糖淀粉酶,葡糖糖淀粉酶是通过将淀粉转化为葡萄糖体现其酶活性的,淀粉利用率高,则糖化酶活性高。在原料中添加高淀粉含量的辅料如高粱、米粉、麦粉等可以保证糖化反应的充分进行,但辅料的蓬松度一般较麸皮略低,过量的加入会影响麸曲的疏松度,从而影响微生物代谢作用[21]。为此,固定培养温度为35 ℃,培养时间为48 h,加水量为45%,干燥温度为40 ℃,分别以麸皮和高粱、麸皮和米粉、麸皮和全麦粉按4:1比例与全麸皮为原料对照进行试验。由图4可知,JQ-1接种制作的麸曲糖化酶活力 D>C>B>A,JQ-2接种麸曲糖化酶活力D>C>A>B,JQ-1表现出更好的糖化性能,JQ-1和JQ-2均以全麸皮为原料制作的麸曲糖化酶活力最佳。可能是此条件下麸曲所含有的淀粉量充分,不需要通过添加辅料的方式来满足JQ-1和JQ-2的代谢产酶需求,且全麸皮原料结构疏松透气、吸水性强,更符合霉菌的生存环境要求。故最终确定JQ-1麸曲和JQ-2麸曲的原料为全麸皮。
2.3.1.2 培养时间对麸曲糖化酶活力的影响
由图5可知,随着培养时间的延长,JQ-1和JQ-2菌株接种麸曲的糖化酶活力呈现先增后降趋势。在培养时间在72 h~120 h时,曲内微生物的代谢活动更为活跃,维持着较高的糖化酶活力,显著高于其他培养时间段(p<0.05),其中,JQ-1麸曲在培养时间为96 h时达到峰值,达1620.00 U/g,JQ-2麸曲酶活在培养72 h时达到峰值,为1382.00 U/g,随着培养时间的延长,JQ-1和JQ-2菌株表现为糖化酶活力有所下降,在培养时间达到144 h时,JQ-1麸曲和JQ-2麸曲的糖化酶活力呈显著降低趋势(p<0.05)。由此可见,霉菌麸曲培养时间对菌株的酶活性的保持有较大影响,JQ-1和JQ-2麸曲的最佳培育时间有所差异,说明不同的菌种有着不同的培养时间要求,可能与菌种自身生理活动特征有关,综上所述,确定JQ-1麸曲培养时间为96 h,JQ-2麸曲培养时间为72 h更有利于麸曲糖化酶活的保持。
2.3.1.3 加水量对麸曲糖化酶活力的影响
水分是微生物生长繁殖的基本营养物之一,麸曲加水量的高低直接影响霉菌的代谢[22],有必要在制曲工艺上对加水量进行考察。图6可知,JQ-1麸曲和JQ-2麸曲的糖化酶活力随加水量增加呈先上升后下降至稳定趋势。其中,JQ-1在加水量为55%时品质最好,糖化酶活力达到1621.00 U/g,且呈显著性差异(p<0.05),JQ-2在55%~60%加水量下,酶活较高,糖化酶活力为1440.00 U/g。加水量35%~45%时,霉菌麸曲表面可见明显的一层孢子,菌丝较少,在加水量高于50%时,菌丝茂盛,孢子较少。加水量过高时,不利于霉菌向麸皮内部生长,糖化酶活力较低;加水量过低时,麸皮较为干瘪,此时的环境因子抑制了菌株正常的生理活动。故控制麸曲加水量为55%为宜。
2.3.1.4 干燥温度对麸曲糖化酶活力的影响
麸曲培育完成后,需要干燥,以方便麸曲的保藏,过高或过低的温度会对糖化酶活力的保持造成影响。由图7可知,在35 ℃~45 ℃温度区间范围内,干燥温度变化对JQ-1、JQ-2霉菌麸曲影响较小,不同温度下差异不显著(p>0.05),麸曲培养温度在50 ℃~60 ℃时仍有较高的糖化酶活力,JQ-1和JQ-2菌株来自中高温大曲,具有一定的热耐受性,故在较高干燥温度下,麸曲依旧有良好的糖化酶活力,从节约能源的角度考虑,确定干燥温度为40 ℃。
2.3.1.5 麸曲酶活检测
通过对霉菌麸曲的生产性能测试,确定了以全麸皮为原料,(培养时间JQ-1麸曲为96 h,JQ-2麸曲为72 h),加水量为55%,干燥温度为40 ℃,此条件制作霉菌麸曲更有利于菌株糖化酶活的保持,所得浅盘麸曲JQ-1和麸曲JQ-2的糖化酶活力检测结果见表2。由表2知,麸曲JQ-1糖化酶活力在最佳工艺条件下为1510.33 U/g,麸曲JQ-2为1388.26 U/g,麸曲JQ-1与麸曲JQ-2皆有较好的糖化能力,麸曲JQ-1与麸曲JQ-2糖化酶活力具有显著性差异(p<0.05),其中麸曲JQ-1糖化能力更占优势。
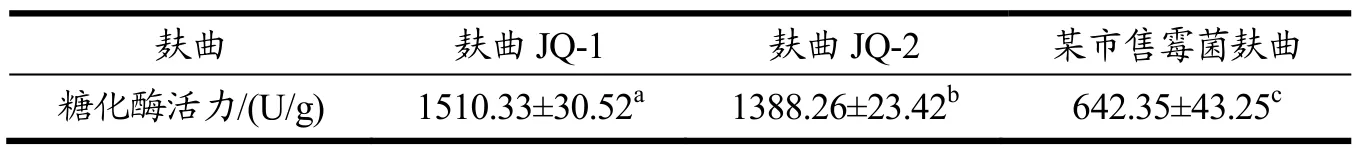
表2 成品曲糖化酶活力检测Table 2 Detection of saccharifying enzyme activity of finished Fuqu

表3 麸曲JQ-1和麸曲JQ-2产酒性能测试Table 3 Liquor production performance test of Fuqu JQ-1 and Fuqu JQ-2
2.3.2 固态发酵酿造性能测试结果
麸曲白酒是以纯种培养的麸曲及酒母为糖化发酵剂,经发酵、蒸馏、贮存、勾兑而成的蒸馏酒[23]。本研究采用固态发酵法,探究麸曲JQ-1和麸曲JQ-2的酿造性能,由表3可知,试验组较对照组具有明显的优势,出酒率和酒度与常规市售麸曲相比,酿造性能突出,显著提高了酒度和出酒率,麸曲 JQ-1较麸曲JQ-2酿造能力更为优越,出酒率达 44.42%,酒精度为41.22%vol,麸曲JQ-2的出酒率为35.84%,酒精度为37.32%vol,显著高于市售麸曲(p<0.05),说明此两株产糖化酶的菌株在固态发酵环境中保持了较高的酶活力,淀粉转化率高,随着麸曲JQ-1和麸曲JQ-2的添加,糖化、产酒过程均表现为促进作用。试验组出酒率和酒度较对照组皆有较大提升,呈显著差异(p<0.05),菌种本身来自于酿酒曲,进行固态发酵过程,环境差异较小,这可能是其能发挥较好的酿造性能的原因之一,麸曲JQ-1白酒与麸曲JQ-2差异显著(p<0.05),与成品曲糖化酶活力测定结果呈正相关。综合上述结果,麸曲JQ-1和麸曲JQ-2能较好的在酿造生产中发挥其糖化作用,其酿造性能JQ-1>JQ-2。
3 讨论
环境中有多种霉菌参与白酒生产过程,包括曲霉属、青霉属、毛霉属、根霉属等,严启梅等[24]从清香型白酒的酒醅中分离出1株米根霉菌株(M2),将其应用于霉菌麸曲,并优化制曲工艺,优化后的菌株(M2)纯种麸曲糖化力达到最大值,为917 U/g;张东平[25]通过制作米根霉和酵母的混合麸曲配合大曲进行酿造试验,提高了基酒出酒率和优质酒率;张翠翠等[26]将黑曲霉(186)与米根霉(774-2)进行共培养,相较于黑曲霉纯培养,其蛋白酶、挥发性香气成分和有机酸产量得到显著提升;张杰等[27]基于提高霉菌麸曲糖化酶活力和产酒性能等目的,优化一株高产糖化酶霉菌(Mxzd-001)的麸曲工艺,优化后的霉菌麸曲糖化力达到1032 U/g,应用于酿造生产中,其出酒率提高了 4.9%左右;孙科等[28]以 1株卷枝毛霉(SN2017)为研究对象,通过优化工艺提高了菌株的产黄酮能力;张映曈[29]通过分子生物学等手段获得了1株卷枝毛霉菌株,并对其发酵条件进行初探进一步提高了番茄红素产量;刘思佳等[30]从豆酱上获得了产脂肪酶的卷枝毛霉,发现其具有生物催化的潜力。本课题从中高温大曲中分离出的米根霉菌株 JQ-1和卷枝毛霉菌株 JQ-2,制得的 JQ-1麸曲糖化酶活力达1510.33 U/g,JQ-2麸曲达1388.26 U/g,相较于现有的研究,表现出较好的糖化能力和酿造能力,特别是目前卷枝毛霉菌有关其产糖化酶的代谢特性的报道极少,此发现可为全面的探究其代谢途径及酶学性质提供一定的参考价值。
4 结论
4.1 本试验采用生理生化特征与分子生物学结合的办法,从中高温大曲中筛选出2株霉菌(JQ-1、JQ-2),提取菌株基因组后,对扩增的rDNA-ITS基因片段测序,对测序结果构建基因序列进化树,鉴定得出菌株JQ-1为米根霉菌(Rhizopusoryzae),JQ-2为卷枝毛霉菌(Mucorcircinelloides)。
4.2 以JQ-1和JQ-2分别制备纯种霉菌麸曲,测试其生产性能。制曲性能测试结果表明,以全麸皮为原料,控制加水量为55%,JQ-1麸曲培养96 h,JQ-2麸曲培养72 h,干燥温度控制在40 ℃,制得的JQ-1麸曲糖化酶活力达1510.33 U/g,JQ-2麸曲达1388.26 U/g,证明JQ-1和JQ-2具有较高的糖化酶生产能力;产酒性能测试结果表明,纯种霉菌麸曲与活性干酵母作为糖化发酵剂在固态发酵中产酒性能麸曲 JQ-1>麸曲JQ-2,JQ-1菌株表现为更好的酿造能力,出酒率达44.42%,酒度为41.22% vol,麸曲JQ-2的出酒率为35.84%,酒精度为37.32% vol,与优化后的成品曲糖化酶活力测定结果呈正相关。综合纯种霉菌麸曲制备和产酒性能的结果,发现菌株JQ-1和JQ-2能在酿造生产中较好的发挥其糖化作用,且制得的纯种霉菌麸曲的酿造性能麸曲JQ-1>麸曲JQ-2。
4.3 大曲微生物种类繁多,能产生大量的生物酶,但其各类微生物分工合作的代谢机制尚不明朗,需进一步开发,并完善大曲中微生物在酿造中相互作用的机制。本课题为大曲功能微生物的开发与生产应用提供了一定的理论指导。

