子宫内膜癌患者POLQ样蛋白解旋酶的表达及临床意义*
覃红, 张瑜
(1.中南大学湘雅医院 妇科, 湖南 长沙 410008; 2.湘西自治州人民医院&吉首大学第一附属医院 妇科, 湖南 吉首 416000)
子宫内膜癌(endometrial carcinoma,EC)是常见的妇科恶性肿瘤之一,其发病率高及死亡率高,严重威胁女性的生命健康,因此,早期识别诊断EC可及时进行治疗,从而有效地改善疾病的预后[1-2]。目前临床上主要依据病理形态学早期诊断EC,但效果不佳。因此,寻找新的分子标记物用于早期识别癌前病变和诊断EC具有重要意义[3]。POLQ样蛋白解旋酶(helicase POLQ-like,HELQ)是一种核蛋白,可催化DNA双链解螺旋,从而参与机体DNA修复过程[4-5]。HELQ在多种恶性肿瘤中常发生缺失或低表达,推测其在肿瘤疾病的发生、发展中可能发挥抑癌基因作用,如肝癌、白血病、卵巢和乳腺癌[6]。目前国内外关于HELQ在EC早期诊断和预后评估中的作用研究鲜有报道,本研究通过比较正常子宫内膜、子宫内膜伴不典型增生及EC中HELQ表达的差异,分析HELQ表达水平与EC临床特征的相关性及其死亡预后的影响,现将结果报告如下。
1 对象与方法
1.1 研究对象
选取2014年12月—2019年5月收治的年龄≥18周岁、临床信息和病理资料齐全患者为研究对象,其中EC患者37例(EC组)、子宫内膜不典型增生患者43例(增生组)及正常子宫内膜患者30例(正常组)。EC组患者系择期行EC全面分期手术、取内膜组织行病理学诊断为EC,增生组患者系行全子宫切除术后或诊断学刮宫手术、取内膜组织行病理学诊断为子宫内膜不典型增生,正常组患者系因子宫内膜息肉、异常子宫出血或子宫肌瘤等行诊断学刮宫术或全子宫切除术、取内膜组织行病理学诊断为正常子宫内膜组织。排除标准:(1)术前曾接受过放、化疗等治疗;(2)合并其他恶性肿瘤和或其他妇科恶性肿瘤;(3)术前1年接受过雌激素、孕激素等相关药物治疗;(4)病理结果为炎性改变,或者同时合并炎症细胞浸润;(5)合并严重心脏、肝脏、肾脏等器质性疾病;(6)妊娠或哺乳期妇女;(7)意识障碍或精神异常,无法配合随访;(8)阅片时发生脱片、病理诊断不明确。所有研究对象均签署知情同意书。
1.2 研究方法
1.2.1子宫内膜标本制作及切片 取3组患者子宫内膜组织,采用10%甲醛固定,常规制作石蜡切片,石蜡切片静置于苏木素染料5 min,流水冲洗,置于1%盐酸乙醇溶液分化3 s,冲洗切片5 min;切片置于1%氨水溶液中反蓝15 s,冲洗后蒸馏水中静置;置于伊红溶液染色2 min,依次放入75%乙醇溶液5 min、85%乙醇溶液5 min、无水乙醇Ⅰ溶液5 min、无水乙醇Ⅱ溶液5 min及二甲苯溶液5 min;风干切片,中性树胶封片,显微镜(日本尼康公司)下观察组织切片,由病理医师核对诊断结果。
1.2.2HELQ的检测及阳性判断 采用免疫组织化学法(immunohistochemistry,IHC)检测3组研究对象子宫内膜组织中HELQ蛋白表达水平,按照试剂盒中说明书操作。福尔马林浸泡30 min、固定24 h,脱水、石蜡包埋后制成蜡块、切片厚3.5 μm;40 ℃温水上切片,65 ℃烤片机烘烤至水干蜡化;切片脱蜡、抗原修复、内源性过氧化物酶阻断、血清封闭、一抗和二抗孵育(抗体浓度均为1 ∶200)、辣根过氧化物酶(3,3N-Diaminobenzidine tertrahydrochloride,DAB;塞维尔武汉生物科技有限公司生产)显色、胞核复染及脱水制片后,全自动玻片扫描系统扫描玻片、阅片;根据免疫反应评分[immunoreactive score,IRS;IRS=染色强度(staining intensity,SI)×阳性细胞百分比(percentage of positive cells,PP)]系统进行评价,每张玻片计数5个高倍镜视野,将强度评分与阳性细胞百分数评分相乘得出IRS,规定IRS评分>2分为HELQ阳性[7]。
1.2.3Envision法检测肿瘤增殖指数(anti-Ki67,Ki67)检测 按SP-9000试剂盒说明书操作步骤检测3组研究对象子宫内膜组织中Ki67表达水平。随机选择10个(400×)视野下计数100个细胞,根据着色情况将细胞按以下规则计分,阳性细胞数染色为未被着色、淡黄色、棕黄色及棕褐色分别计0、1、2 及 3分;计算阳性细胞百分率,<5%记0分、5%≤~<25%记1分、25%≤~<50%记2分、50%≤~<75%记3分、≥75%记4分,最后根据着色和阳性细胞百分率评分结果乘积得分判断阳性和阴性,规定乘积得分0分为阴性(-)、 乘积得分1分及以上为阳性(+)[8]。
1.2.4雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)检测及结果判断 将3组研究对象子宫内膜组织切片常规脱蜡,采用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗;采用3%过氧化氢室温下浸泡10 min,PBS清洗;浸入0.01 mol/L枸橼酸盐缓冲液,92~98 ℃微波炉10 min,室温冷却30 min,PBS清洗;加2%羊血清,室温20 min;去除液体,滴加鼠抗人雌激素、孕激素受体单克隆抗体,4 ℃过夜,PBS清洗;DAB显色,苏木精染色、脱水、透明及封片;ER、PR主要定位于细胞核,细胞核内出现棕黄色颗粒为阳性细胞,计算阳性细胞百分率[阳性细胞百分率(%)=阳性细胞数/显微镜下计数细胞数] ,≤10%为阴性(-),>10%为阳性(+)[9]。
1.2.5基础、临床及术后随访信息 收集3组研究对象的基础信息,包括年龄、身高、体质量、体质量指数(body mass index, BMI)、孕产史、流产史及妇科疾病史;收集EC组患者子宫内膜癌分化程度、国际妇产科协会(the International Federation of Gynecology and Obstetrics, FIGP)分期、肌层浸润深度、淋巴结转移及脉管浸润情况;采用门诊复诊或电话随访EC患者术后情况,随访截止时间为2021年1月1日,随访内容包括随访时间(单位为月)、患者是否发生死亡和原因、是否失访和原因等。
1.3 统计学分析
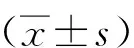
2 结果
2.1 基础信息
3组研究对象年龄、BMI、孕产史、流产史和妇科疾病史比较,差异无统计学意义(P>0.05),具有可比性。见表1。
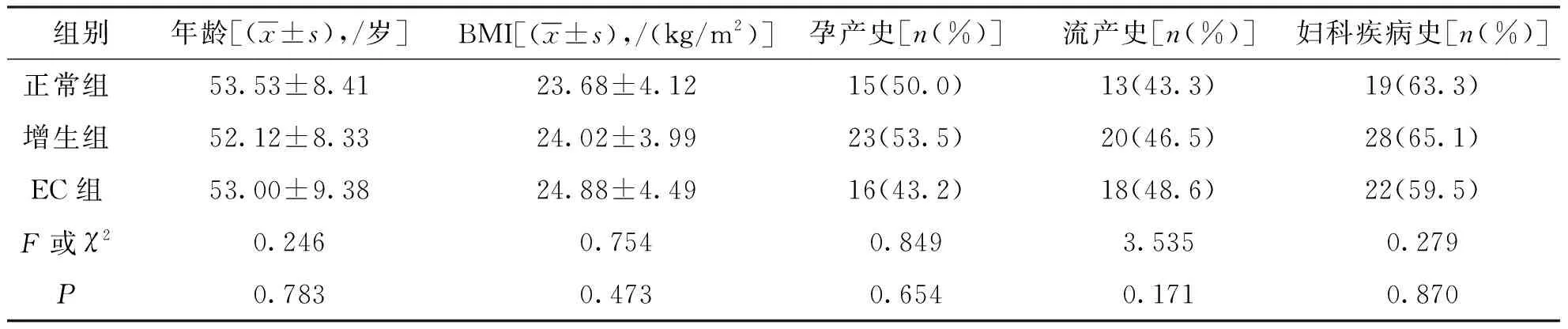
表1 各组研究对象的基础信息比较Tab.1 Comparison of basic information in each group
2.2 HELQ阳性表达
3组研究对象子宫内膜组织中HELQ阳性表达比较,EC组患者子宫内膜组织中HELQ阳性表达人数少于正常组和增生组,差异均有统计学意义(P<0.05)。见表2。
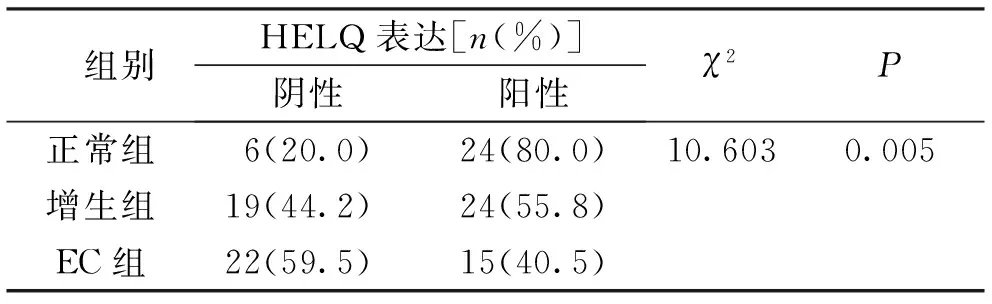
表2 各组研究对象子宫内膜组织中HELQ阳性表达Tab.2 Comparison of positive expression of HELQ in endometrial tissues of each group
2.3 EC组患者HELQ表达与临床病理学特征、免疫组织化学指标的关系
EC组患者中HELQ阴性和阳性者的肿瘤肌层浸润深度、脉管浸润、PR表达及Ki67表达比较,差异均有统计学意义(P<0.05)。见表3。
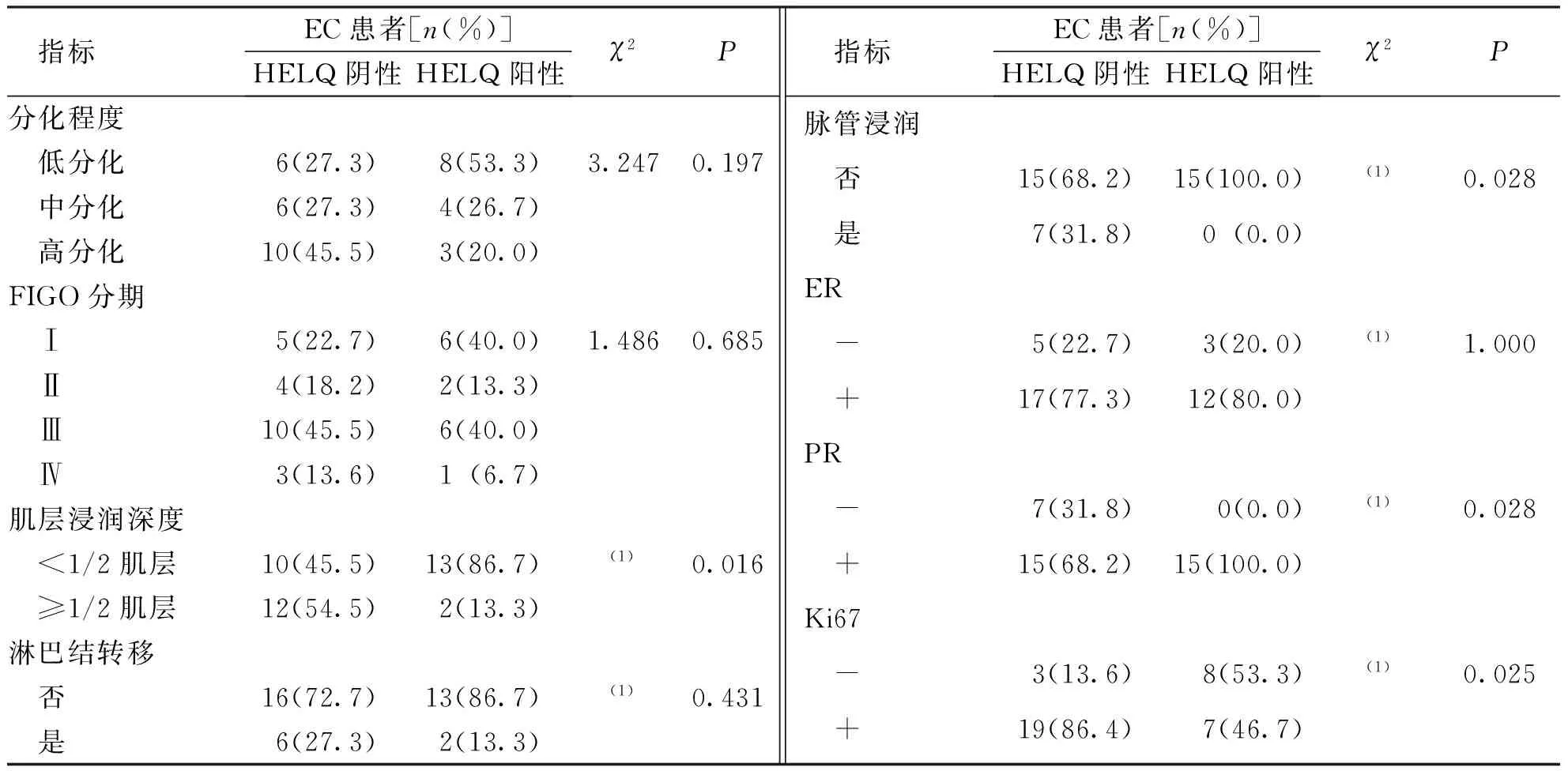
表3 EC组患者中HELQ表达与临床病理学特征、免疫组织化学指标的关系Tab.3 Correlation between clinicopathological/immunohistochemical features and HELQ expression in endometrial cancer group
2.4 HELQ表达与EC患者死亡的相关性
37例EC患者随访时间为0~61个月,中位随访时间为39.5个月,死亡3例,总死亡率为8.11%;寿命表法分析结果显示,1、3、5年生存率分别为97.0%、94.0%及89.0%;Cox回归结果显示,校正协变量肿瘤的肌层浸润深度、脉管浸润、Ki67表达及PR表达后,EC患者HELQ表达对其死亡的发生无影响(P>0.05);Kaplan-Meier分析结果显示,HELQ阳性和HELQ阴性EC患者生存率差异无统计学意义(P>0.05)。见表4和图1。

表4 Cox回归分析HELQ表达与EC患者死亡的相关性Tab.4 Correlation between HELQ expression and death in patients with endometrial cancer patients by Cox regression analysis
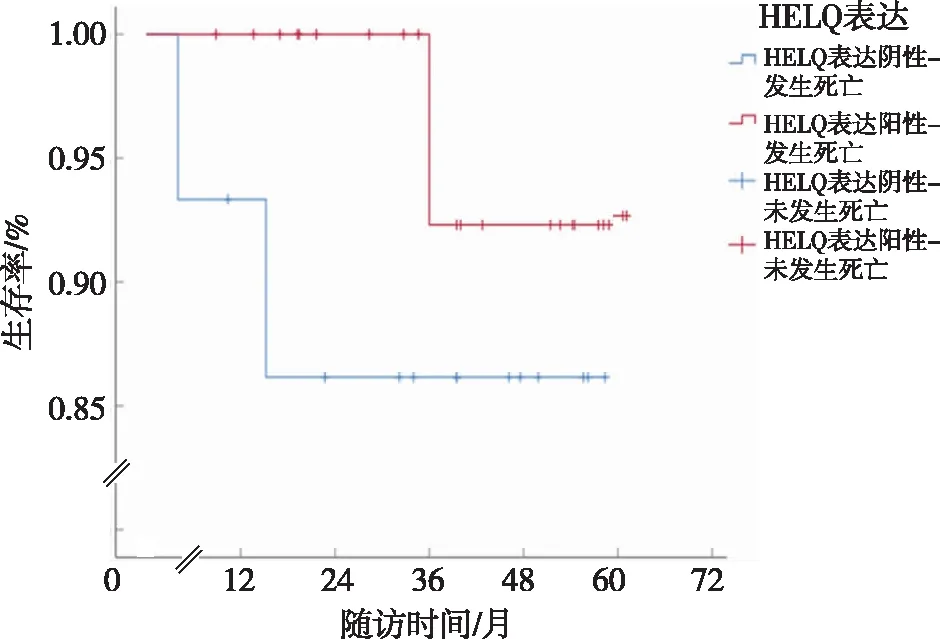
图1 HELQ表达阳性和阴性EC患者的生存曲线比较Fig.1 Comparison of survival curves of patients with HELQ expression-positive and HELQ expression-negative
2.5 HELQ表达对EC患者死亡的预测作用
ROC分析结果显示,HELQ、HELQ×Ki67、HELQ×PR、HELQ×Ki67×PR预测EC死亡发生AUC分别为0.642、0.711、0.676、0.725,均大于0.5,但P>0.05。见表5和图2。差异无统计学意义,提示HELQ表达对EC患者死亡无预测作用。
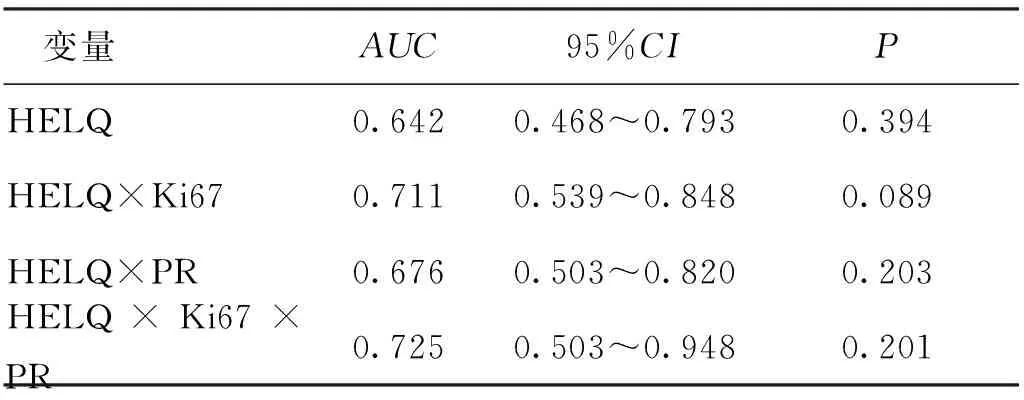
表5 ROC曲线分析HELQ表达在EC患者死亡发生预测中的效能Tab.5 Efficacy of HELQ expression in predicting the death of endometrial cancer patients by ROC curves
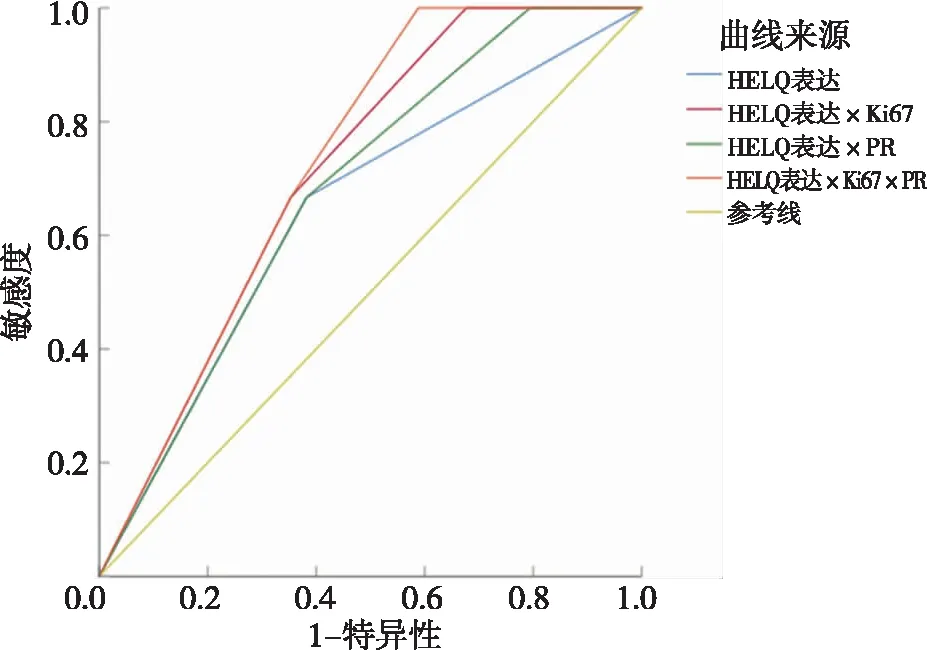
图2 HELQ及HELQ联合其他指标预测EC患者死亡发生的ROC曲线Fig.2 HELQ and HELQ combined with other indexes to predict the ROC curve of death in EC patients
3 讨论
近年来研究发现,HELQ与生殖健康和肿瘤疾病密切相关[10],HELQ缺失或低表达可增加DNA损伤风险,提高肿瘤发生率。动物实验结果也证明[11],HELQ与卵巢肿瘤、垂体瘤中生殖细胞缺失有关,敲除HELQ基因的小鼠生殖能力下降、生殖细胞缺失、DNA股间交联敏感以及致癌倾向。本次研究结果显示,随着子宫内膜从正常到癌变过程中HELQ阳性表达率逐渐下降(P<0.05),在EC患者子宫内膜组织中阳性表达率最低,与刘芳平等[12]、李亚萍等[13]、Liu等[14]研究结果一致,提示HELQ在EC中低表达,可作为恶性肿瘤早期诊断的新分子,在EC早期诊断中具有一定的应用价值。
肌层浸润深度、脉管浸润及Ki67阳性率在既往研究中已被证实是EC预后评估的重要指标,张品等[15]研究认为,深肌层浸润是EC预后独立危险因素,能够增加EC死亡发生风险。赵昌芹等[16]研究显示,EC伴有肿瘤脉管浸润患者术后复发风险相对无脉管浸润增加3倍。Rădulescu等[17]研究发现,Ki67与肿瘤的增殖有关,其阳性表达可影响EC患者生存率和复发。本研究中,HELQ阳性组和HELQ阴性组肌层浸润深度、脉管浸润、Ki67阳性率和PR阳性率存在差异(P<0.05),相关性分析中HELQ阳性率越低,则患者肌层浸润深度、脉管浸润、Ki67阳性率和死亡发生率越高(P<0.05),提示HELQ可能作为抑癌基因参与EC肿瘤细胞增殖、浸润及转移的过程,当HELQ缺失或既表达则可促进肿瘤的发生、发展。有研究显示,EC中80%属于激素依赖型(Ⅰ型),是由于雌激素过度刺激导致子宫内膜增生,从而引发EC[18-20]。而孕激素能够通过与子宫内膜上PR结合,诱导过度增生的子宫内膜向分泌期转化,防止EC的发生[21-22]。本次研究结果显示,HELQ阴性组EC患者肌层浸润深度>1/2、脉管侵袭比率及Ki67阳性率较HELQ阳性组高(P<0.05),提示HELQ在EC发生、发展中发挥抑癌基因作用,当HELQ阴性或低表达时,肿瘤细胞的增殖、侵袭及浸润能力增加,导致肿瘤病情的进展。同时,HELQ阴性组PR阳性率较HELQ阴性组低,孕激素不能有效结合PR拮抗雌激素发挥保护子宫内膜的作用,从而促进了EC的发生、发展。因此,推测HELQ在EC预后中具有重要作用。
有学者关于HELQ在恶性肿瘤预后中作用进行了研究。高峻等[23]研究显示,HELQ与原发性肝细胞癌的发生密切相关,HELQ蛋白低表达导致原发性肝细胞癌患者预后不良;Guo等[24]研究显示在慢性淋巴细胞性白血病患者中HELQ表达水平与IGHV变异相关,而慢性淋巴细胞性白血病与靶细胞信号通路相关的预后与HELQ/EGR3的表达相关,慢性淋巴细胞性白血病患者HELQ缺失导致其预后不良;Long等[25]研究表明,HELQ表达与卵巢癌患者对铂类化疗的反应、总生存期及无病生存期有关,在肿瘤细胞过表达和敲除HELQ蛋白,能分别增加和降低细胞DNA修复活性,从而分别增加和降低肿瘤对顺铂耐药性,能作为预测卵巢癌患者化疗耐药和判断患者预后的指标。本次研究中,HELQ表达与EC患者死亡预后呈负相关(P<0.05),但校正混杂因素后,HELQ表达并不是EC死亡预后的独立影响因素(P>0.05),提示与既往研究结果不同,一方面与样本量小、发生死亡结局人数过少、研究结果可靠性有限有关;另一方面提示HELQ可能通过调控其他基因或分子物质表达,从而影响EC的疾病进展和预后。ROC曲线分析结果显示,HELQ、HELQ联合其他病理学、免疫组织化学指标预测EC患者死亡AUC>0.5(P>0.05),提示HELQ虽然与死亡预后发生有一定相关,但在预后评估中作用还有待进一步探讨。
本次研究分别检测正常子宫内膜、子宫内膜不典型增生和EC子宫内膜组织中检测HELQ表达,初步探讨了EC和EC癌前病变中检测HELQ表达水平的变化趋势;分析EC中HELQ表达与临床病理学特征和免疫组化指标的相关性,为后续HELQ参与EC发生、发展的具体作用机制研究提供线索;探讨HELQ表达对EC死亡预后的影响及在预后评估中的预测作用,有助于早期识别EC术后不良预后发生的高危人群,及时采取干预措施,防止不良疾病转归。但本研究也存在一定不足:首先,样本例数较小,病例仅来源于一家医院,研究对象选取可能存在选择偏倚;其次,未验证HELQ对细胞生物学功能的影响及其在EC发生、发展中的作用机制;最末,随访中仅以死亡为结局,而临床实际中EC患者术后复发率较死亡率高,未探讨HELQ对EC患者复发的影响,预后评价不全面。这些都有待后续扩大样本量、多中心进一步深入研究探讨。
综上所述,EC患者HELQ阳性表达率较子宫内膜不典型增生患者和正常子宫内膜女性低,可能与EC的发生、发展及死亡有关,早期检测HELQ表达有助于临床诊疗工作开展。

