长非编码RNA NEAT1通过miR-141-3p/EGFR参与瘢痕疙瘩形成的调控机制
谢彤阳, 卫艳萍,王廷廷, 张宁宁,李关芳
(1.新乡医学院,河南 新乡 453003;2.焦作市人民医院皮肤科,河南 焦作 454002)
瘢痕疙瘩是由皮肤损伤后异常纤维增生反应产生,其典型病理改变是成纤维细胞的异常增生及细胞外基质的沉积[1-3]。瘢痕疙瘩通常稍高出皮肤的表面,一般伴有瘙痒或疼痛[4]。有研究[5]表明,瘢痕疙瘩的形成和发展与生长因子、基因调控、免疫因素及胶原代谢异常等相关。瘢痕疙瘩发病的分子机制目前尚不清楚[6]。因此,探讨瘢痕疙瘩的发病机制和潜在的治疗靶点具有重要意义。
长非编码RNA是一类含有超过200个核苷酸的非编码RNA, 参与细胞基因表达调控,在生理和病理调控中都发挥重要生物学作用[7]。近来有研究报道,NEAT1可以抑制肾癌细胞生长[8];NEAT1还具有抑制乳腺癌细胞增殖、侵袭和迁移的作用[9]。贾春英等[10]探讨LncRNA DBH-AS1调控miR-138/HIF-1α通路在瘢痕疙瘩成纤维细胞凋亡的作用。但是NEAT1在瘢痕疙瘩形成中的作用和分子机制尚未明确。已有报道表明,miRNAs在瘢痕疙瘩纤维增生过程中起着重要的调控作用[4,11]。EGFR是表皮生长因子受体(HER)家族成员之一。EGFR是存在于哺乳动物上皮细胞、成纤维细胞、胶质细胞和角质细胞等细胞表面的受体,EGFR对细胞生长、增殖和分化的生理过程发挥重要的作用,在瘢痕疙瘩的形成和发展中发挥重要作用[12]。我们通过生物信息学分析预测:NEAT1靶向调控miR-141-3p,EGFR是miR-141-3p的靶基因。
为了探讨NEAT1在瘢痕疙瘩形成中的作用以及NEAT1通过miR-141-3p/EGFR轴参与瘢痕疙瘩形成的调控机制,本研究检测瘢痕疙瘩标本中NEAT1、miR-141-3p的表达水平,观察沉默NEAT1表达对瘢痕疙瘩成纤维细胞增殖的作用,分析 NEAT1与miR-141-3p和miR-141-3p与EGFR的靶向关系。
1 材料与方法
1.1 材料 临床27例样本采集通过焦作市人民医院伦理委员会批准,并签订知情同意书。均为确诊患者的瘢痕疙瘩手术切除标本,其中瘢痕疙瘩组织作为观察组,瘢痕疙瘩旁的正常皮肤组织作为对照组;纳入标准:参照林简等[1]研究瘢痕疙瘩取材的标准。27例临床标本其中男13例,女14例,年龄(27.23±6.45)岁。标本离体后迅速放入液氮保存。
1.2 方法
1.2.1 主要实验材料 瘢痕疙瘩成纤维细胞(HKF)、293T细胞购于杭州仟诺生物科技有限公司。10%胎牛血清、DMEM培养基购于北京索莱宝公司。LipofectamineTM 2000 购于美国 Invitrogen 公司。CCK-8试剂盒购于上海碧云天公司。Trizol试剂、cDNA逆转录试剂盒购于美国Invitrogen公司。miR-141-3p mimic、miR-NC、si-NEAT1、si-NC、OE-EGFR载体、报告基因载体购于上海吉玛公司。引物由上海生工公司合成。荧光定量PCR仪、CO2培养箱购于美国赛默飞世尔科技公司。
1.2.2 细胞培养与转染 HKF(或293T)接种于含10%胎牛血清的DMEM培养液内,放置于恒温CO2培养箱中进行细胞培养。待细胞生长70%~80%融合度时,更换无血清培养基,依据实验将miR-141-3p mimic、miR-NC、si-NEAT1、si-NC、OE-EGFR、报告基因载体按照不同分组分别用Lipofectamine 2000包裹,依照试剂说明书条件进行转染,转染12 h后更换新鲜含有10%胎牛血清的培养基继续培养,进行后续实验。
1.2.3 实时荧光定量(RT-qPCR) 用Trizol 试剂提取组织或细胞的总RNA,使用逆转录酶试剂盒进行逆转录,合成cDNA。分别以GAPDH和U6作为内参照,扩增NEAT1和miR-141-3p。扩增条件:95 ℃预变性3 min;95 ℃变性30 s,60 ℃退火30 s, 72 ℃延伸30 s循环40圈; 使用 2-△△CT法计算产物相对表达量。NEAT1 上游5’-GGGCCATCAGCTTTGAATAA-3’,下游5’-CTTGAAGCAAGGTTCCAAGC-3’;GAPDH 上游 5’-CCATGGAGAAGGCTGGGG-3’,下游 5’-CAAAGTTGTCATGGATGACC-3’;miR-141-3p上游5’-TAACACTGTCTGGTAAAGATGG-3’;下游 5’-CCATCTTTACCAGACAGTGTTA-3’;U6 上游 5’-CTCGC TTCGGCAGCACA-3’,下游 5’-AACGCTTCACGAATTT GCGT-3’。
1.2.4 CCK-8法检测细胞增殖活力 将各组细胞分别接种96孔板细胞培养板,每孔接种1×105个细胞。72 h培养后,在每孔细胞中加入10 μL的CCK-8溶液,继续培养 2 h, 波长450 nm测定各孔细胞的吸光度值(OD)。
1.2.5 双萤光素酶报告基因检测 应用TargetScan数据库通过生物信息分析预测miR-141-3p与NEAT1、EGFR3’-UTR存在结合位点。将含有预测结合位点的NEAT1野生型报告基因载体(pmirGLO-Wt-NEAT1)或突变型报告基因载体(pmirGLO-Mt-NEAT1)分别与miR-141-3p mimics或miR-NC共转染入293T细胞。将含有预测结合位点的EGFR 3’UTR野生型报告基因载体(pmirGLO-Wt-EGFR 3’UTR)或突变型报告基因载体(pmirGLO-Mt-EGFR3’UTR)分别与miR-141-3p mimics或miR-NC共转染入293T细胞。转染48 h后,按照双荧光素酶检测试剂盒说明进行双荧光素酶活性检测。
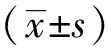
2 结果
2.1 2组NEAT1、miR-141-3p表达比较 RT-qPCR 检测NEAT1、miR-141-3p的表达情况,结果显示:观察组中NEAT1的表达高于对照组(P<0.05),而miR-141-3p表达低于对照组(P<0.05)。见表1。
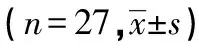
表1 2组NEAT1、miR-141-3p表达比较
2.2 沉默NEAT1表达对HKF细胞增殖和miR-141-3p表达的影响 RT-qPCR 结果显示:转染si-NEAT1细胞组(si-NEAT1组)的NEAT1的表达水平与未转染细胞组(Blank组)和转染siRNA无关序列细胞对照组(si-NC组)相比均显著降低(P<0.01);说明瘢痕疙瘩成纤维细胞中的NEAT1表达沉默有效。CCK8结果显示:在24、48、72 h时,si-NEAT1组细胞OD值与Blank组、si-NC组相比均显著降低(P<0.01);提示沉默NEAT1表达可以抑制瘢痕疙瘩成纤维细胞的增殖。RT-qPCR检测3组miR-141-3p表达水平结果显示:与Blank 组和si-NC组相比,si-NEAT1组细胞的miR-141-3p表达水平显著升高(P<0.01)。见表2。
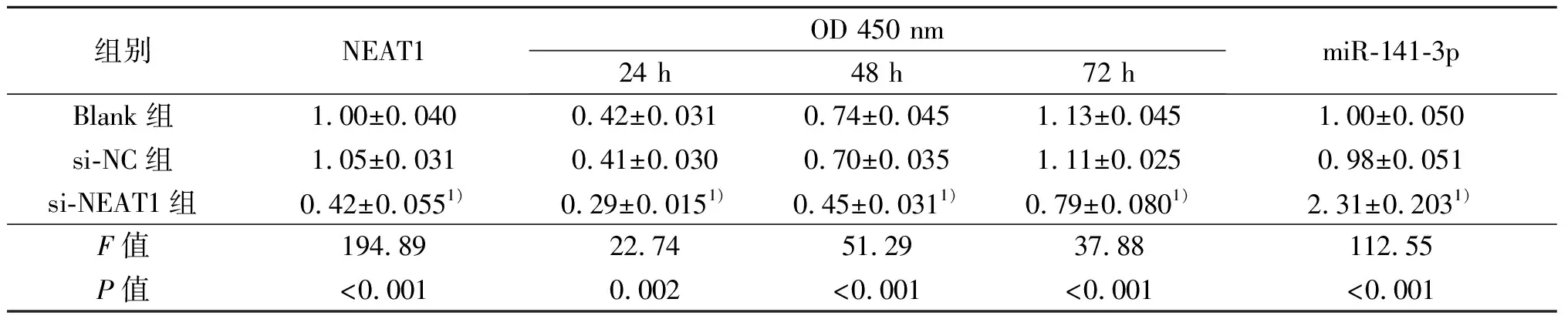
表2 沉默NEAT1表达对HKF细胞增殖和miR-141-3p表达的影响(n=3)
2.3 生物信息学分析及双荧光素酶报告实验 上步实验结果显示,下调NEAT1表达可以显著升高miR-141-3p表达。生物信息学分析结果显示:NEAT1上存在与miR-141-3p结合位点。见图1。双荧光素酶报告实验结果显示,野生型NEAT1报告基因载体(pmirGLO-Wt-NEAT1)和 miR-141-3p mimic共转染细胞的荧光素酶活性与miR-NC组比较均降低(P<0.01)。见表3。
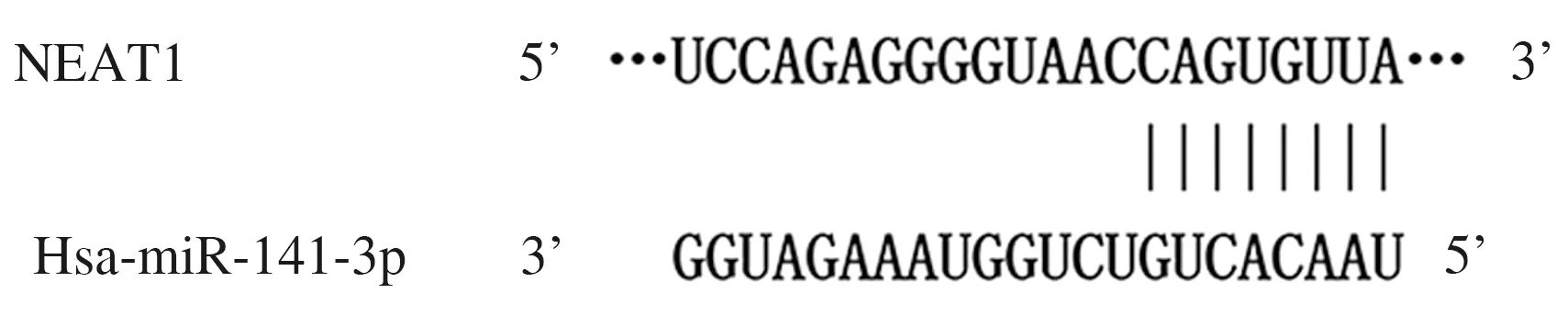
图1 生物信息学分析预测结果
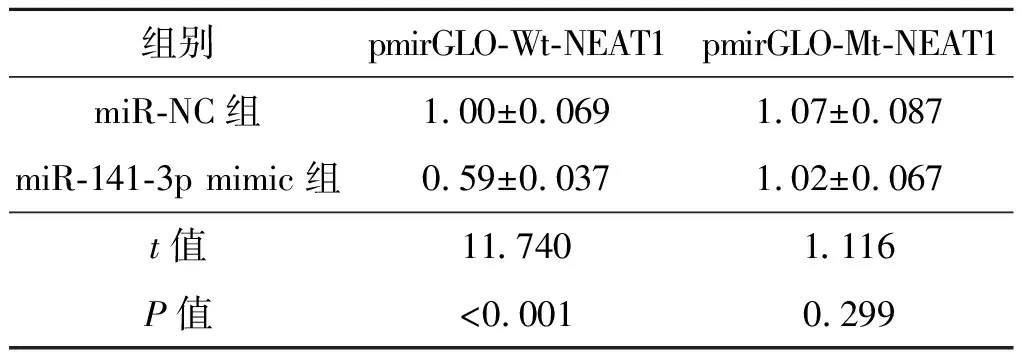
表3 双荧光素酶报告实验结果(n=5)
2.4 TargetScan数据库中预测的结合位点和双荧光素酶报告实验 TargetScan数据库中预测结果显示:EGFR 3’-UTR 存在与miR-141-3p结合位点。见图2。双萤光素酶报告实验结果显示:与miR-NC组比较,野生型报告基因载体(pmirGLO-Wt-EGFR 3’-UTR)与miR-141-3p mimic共转染细胞的荧光素酶活性显著降低(P<0.01)。见表4。
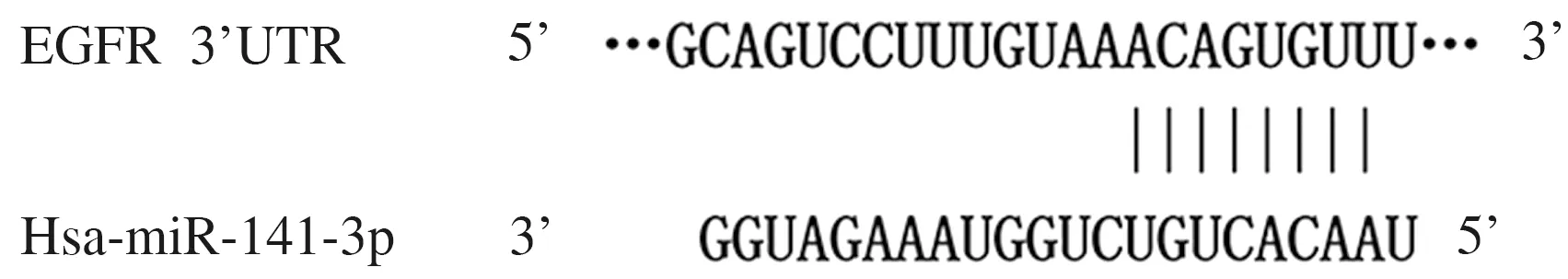
图2 TargetScan数据库中预测的结合位点

表4 双荧光素酶报告实验结果(n=5)
2.5 EGFR对沉默NEAT1和上调miR-141-3p的细胞增殖抑制效应的影响 CCK8结果显示:过表达EGFR与沉默NEAT1共转染组(si-NEAT1+OE-EGFR)在24、48、72 h与单独沉默NEAT1转染组(si-NEAT)相比,OD值显著升高(P<0.05)。过表达EGFR与上调miR-141-3p共转染组(miR-141-3p mimic+OE-EGFR)在24、48、72 h与单独上调miR-141-3p转染组(miR-141-3p mimic)相比,OD值显著升高(P<0.05)。见表5。
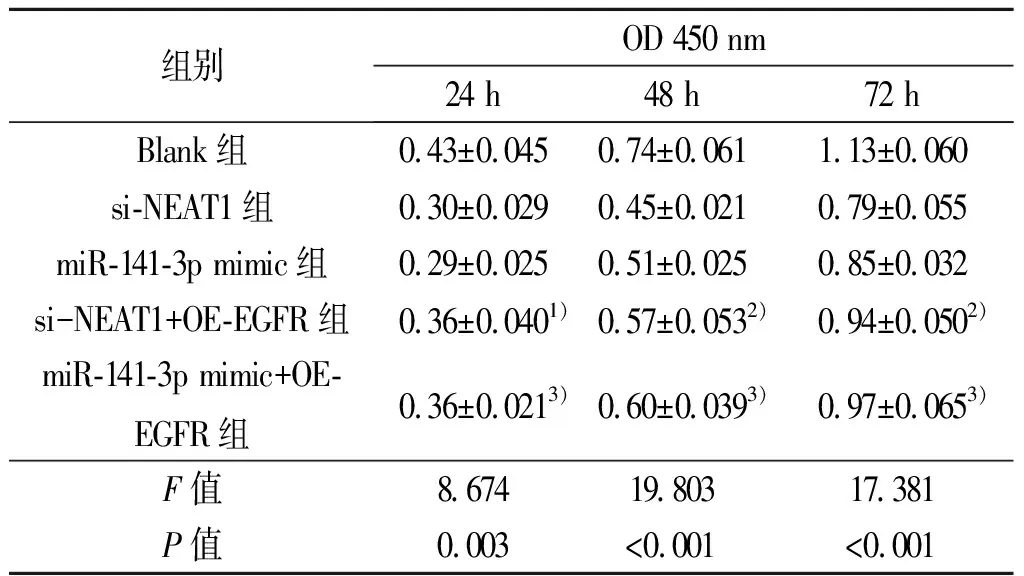
表5 EGFR对沉默NEAT1和上调miR-141-3p的细胞增殖抑制效应的影响(n=3)
3 讨论
本研究证实,瘢痕疙瘩组织中NEAT1的表达升高。YANG等[13]检测了10例瘢痕疙瘩组织和10例正常皮肤组织中的NEAT1表达水平,结果显示在瘢痕疙瘩组织NEAT1的表达显著升高。WU等[14]报道增生性瘢痕组织中的NEAT1表达水平显著高于正常皮肤组织。以上结果表明,NEAT1的表达在瘢痕疙瘩组织中异常升高。本研究结果显示,沉默瘢痕疙瘩成纤维细胞中NEAT1表达,可显著抑制细胞的增殖。YANG等[13]的文献报道,同样是敲低NEAT1表达可抑制瘢痕疙瘩成纤维细胞增殖和侵袭。WU等[14]研究也表明,NEAT1的基因敲除抑制细胞的活性和增殖。上述实验提示NEAT1在瘢痕疙瘩的形成和发展起到重要作用。
FENG等[3]研究结果显示,瘢痕疙瘩组织和瘢痕疙瘩成纤维细胞中miR-141-3p的表达下调,与本文27例瘢痕疙瘩标本中miR-141-3p的表达实验结果一致;且与本研究结果都显示,过表达miR-141-3p可抑制瘢痕疙瘩成纤维细胞增殖;提示miR-141-3p在瘢痕疙瘩形成中可能扮演抑制作用。
WU等[14]研究证明,NEAT1沉默通过调节miR-196b-5p/FGF2轴抑制瘢痕疙瘩成纤维细胞的存活、迁移和细胞外基质的表达;WU等[14]研究提示,敲减NEAT1可通过调节miR-29-3p/FRS2轴抑制增生性瘢痕的形成。本研究通过生物信息学预测和双荧光素酶报告实验,以及沉默NEAT1对瘢痕疙瘩成纤维细胞miR-141-3p表达的影响检测,证实NEAT1靶向负调控miR-141-3p;又通过生物信息学预测和双荧光素酶报告实验,证实miR-141-3p靶向负调控EGFR;最后通过拯救实验,证实了EGFR可拯救沉默NEAT1和上调miR-141-3p的细胞增殖抑制效应,证明了lncRNA NEAT1可通过miR-141-3p/EGFR轴参与瘢痕疙瘩成纤维细胞增殖调控。本研究发现了lncRNA NEAT1在瘢痕疙瘩形成中不同的调控机制。
综上所述,NEAT1的表达在瘢痕疙瘩组织中异常升高,沉默NEAT1可通过miR-141-3p/EGFR轴降低瘢痕疙瘩成纤维细胞的增殖,抑制瘢痕疙瘩的形成和发展,该通路有望成为瘢痕疙瘩疾病的潜在治疗靶点。

