数字病理技术在骨髓细胞形态学检验中的应用进展
【作 者】付鑫焱,王巍,高海燕
1 杭州智微信息科技有限公司,杭州市,311203
2 哈尔滨医科大学附属第二医院,哈尔滨市,150086
0 引言
骨髓细胞形态学检验以骨髓涂片为标本,借助光学显微镜进行细胞形态学检查,该方法是日常血液学检查的基本方法,也是血液病诊断和疗效评估的基础。数字病理技术可以方便地将医学图像显示在电子屏幕上,使用专用的图像分析软件可以便捷地进行图像处理和分析操作,为细胞学检验带来了优异的成像质量、实时显示和处理图像能力、方便快捷的图像存贮以及随时随地检索信息记录,使得检验医师能够利用数字图像进行便捷的检验和诊断,不再完全依赖于传统光学显微镜。
在骨髓细胞形态学检验中,从光学显微镜检查逐渐转向利用电子屏幕查看骨髓涂片的细胞数字图像,从人工判读细胞形态转向智能识别细胞形态和自动报告,临床检验实践正朝向数字化的工作流程转变。数字病理技术在当今骨髓细胞形态学检验中发挥着越来越重要的作用。
下面概述数字病理技术的基本原理、细胞学数字病理设备的现状、数字病理技术在临床骨髓细胞形态学检验中的应用以及存在的问题和展望。
1 数字病理技术的基本原理
1.1 数字成像
数字成像技术分为数字图像获取和输出两大类[1],主要采用数字图像传感器(CCD或CMOS数码相机)将图像信息以数字化形式记录下来进行图像获取,成像原理主要有光学显微成像、共聚焦显微成像、超分辨显微成像三种[2]。自动对焦决定着显微成像的精确性和实时性,是数字成像中的关键技术。对焦原理主要有基于数字图像处理的对焦深度法和基于光学离焦误差检测的离焦深度法[3]。对焦深度法通过改变镜头位置获取一系列模糊程度不同的图像,并计算每幅图像的清晰度评价函数值形成对焦评价曲线,最终移动镜头到对焦评价曲线的最值处,即最佳对焦位置。离焦深度法通过使用拍摄图像的参数建立离焦模型,然后对图像的局部区域进行处理和分析,从而确定图像的模糊程度和深度信息[4]。此外对焦窗口(图像分析区域)的选择决定着数字成像的效率。图像分析耗费的时间与参与计算的图像像素数量成正比,为了减少像素运算数量从而达到最佳成像和实时成像的双重要求,通常直接选取图像中央或图像四周四个具有代表性的像素区域,即对焦窗口中央选择法和多区域选择法[4]。针对临床上存在图像分析区域面积过大的问题,近年来发展出全玻片成像技术,该技术利用图像拼接(面阵相机)和全景扫描(线阵相机)以及无透镜显微系统等技术来扩大图像分析区域,例如徕卡、蔡司光学和飞利浦的玻片成像系统。医学数字成像原理,如图1所示。其中玻片通过镜头在图像传感器上成像,自动对焦系统通过数据处理得到最佳对焦图像,经过图像拼接或全景扫描从而组成全玻片的数字图像。
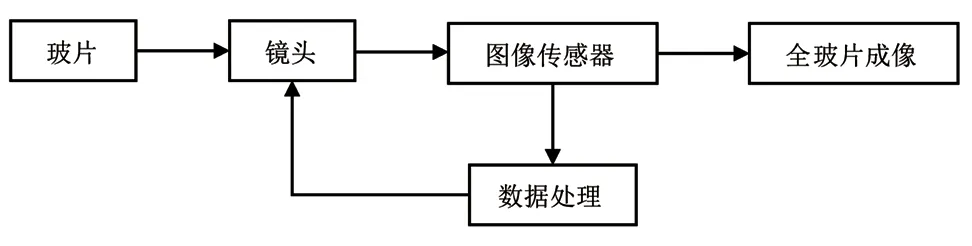
图1 医学数字成像原理Fig.1 Principle of medical digital imaging
1.2 数字图像分析
数字图像分析主要利用图像分析工具对图像进行亮度、反差、颜色等级调整,校正偏色和饱和度等,去除杂色、斑点等,并从数字化的病理图像中提取基于图像分析区域、细胞以及其他组织相关的测量参数[5]。典型的医学细胞数字图像分析主要包含细胞图像切割、颜色标准化、细胞分类识别、计算机软件辅助分析、结果输出,如图2所示。其中数字图像经过软件智能化细胞分割以后,由算法根据细胞特征进行自动分类和识别,然后将细胞图像分析结果以报告形式输出。
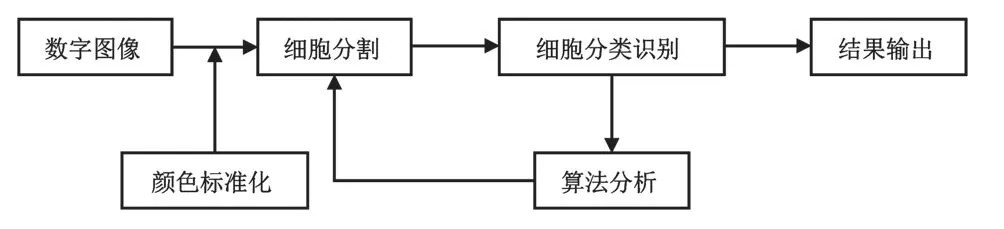
图2 医学数字图像分析原理Fig.2 Principle of medical digital image analysis
2 细胞数字病理检验设备的现状
随着数字病理技术的进步,细胞数字病理设备已经可以将血涂片和骨髓涂片高效地转化成数字图像,并包含细胞形态学检查所需的信息。
2.1 血细胞数字病理检验设备
在血涂片图像分析设备方面,自1982年白细胞分类分析仪(Automatic blood cell differential analyzer 8200,HITACHI,Tokyo,Japan)进行临床应用以来[5],全自动血细胞图像分析仪逐渐发展成熟(CellaVision DiffMaster Octavia,1994;CellaVison DM96,2005;Sysmex DI 60,2019;Roche cobas m 511,2018)[6]。基于细胞图像分析技术的DM96系统整合了自动显微镜(×10、×50、×100 Oil)、步进马达和光控单元、CCD彩色照相机以及细胞定位和特征分析软件,该系统采用自动定位细胞图像分析技术模拟传统光学显微镜镜检过程对血涂片数字图像中的白细胞、红细胞和血小板进行预分类和计数。随后升级为DM9600系统,以及与血液分析流水线(Sysmex XN系列)整合在一起的全自动数字细胞形态分析系统DI-60[7],使血细胞形态学检验在自动化、标准化、智能化方面达到先进水平。新款血球分析仪Cobas m 511(罗氏诊断)同样利用数字化、细胞形态学和人工智能原理进行外周血细胞分析,该系统使用30 μL全血喷涂制备血涂片,通过图像分析技术完成白细胞、红细胞和血小板的计数和识别,提供相应的血细胞数字图像,整合白细胞分类、红细胞形态学分析、红细胞参数计算等结果并出具外周血检测报告[8]。在国内,Celldiff BCM-2自动血细胞形态分析系统(北京赛尔蒂扶,2015)和LD BC-Ⅰ型全自动血细胞图像分析仪(武汉兰丁,2018)实现了白细胞预分类的自动化与标准化[9-10]。
2.2 骨髓细胞数字病理设备
在骨髓涂片图像分析设备方面,尽管近年来研究人员在骨髓细胞分割和识别算法方面取得很大进步[11-13],使用大量临床骨髓细胞样本和基于稀疏表示和数学形态学操作的新型细胞分割和识别算法对常见14种骨髓细胞的平均识别率达到82.46%[14],该研究对骨髓细胞图像分析的发展进程具有重要意义,然而这些研究使用的骨髓细胞图像主要通过组织病理玻片成像系统(例如蔡司光学Axio Imager Z2、徕卡Aperio AT2 scanner高通量快速扫描仪)或显微镜系统获取,通常无法满足临床骨髓涂片检查中使用×100 Oil物镜进行细胞形态学分析的需求。临床上使用的图文系统仅用于辅助医务人员出具骨髓涂片检查报告单,例如BEION V4.90骨髓细胞形态学图文系统(北昂医疗),而不能用于骨髓细胞图像分析[15]。
骨髓涂片数字病理设备研发方面进展缓慢,主要是由于骨髓涂片厚度不均,自动对焦比较困难,尤其使用×100 Oil物镜对焦具有挑战性。Morphogo骨髓细胞形态学分析仪(杭州智微)使用Z-stack对焦技术和自动拼图功能,首次实现了对骨髓涂片的×40物镜全玻片扫描(20 mm×40 mm,(0.17 ± 0.02)μm/pixel)和×100 Oil物镜细胞图像扫描(0.018 ± 0.005)μm/pixel,可以管理、展示、修改和自动识别细胞图像,并出具检验报告,形成数字图像分析流程[16]。Slide Scan System SQS1000玻片扫描影像分析系统(深圳市生强科技)使用压电纳米位移控制对焦技术、区域扫描模式与单点扫描模式相结合,实现了血片和骨髓片×10和×100 Oil图像扫描(0.7 μm/pixel,0.057 μm/pixel)[17]。Full Field PBS/BMA系统(Scopio公司)使用计算成像中的超分辨率(SR)图像重建技术将低分辨率图像合成为高分辨率图像,以获得×100等效放大率的血片或骨髓片图像[18]。MP800 Fully Automatic Microscope 数字病理系统利用快速对焦(163~300 fps)和全玻片平扫(20 mm ×50 mm,全片8个对焦点,区域内无需重新对焦)技术,实现了血片和骨髓片的图像数字化并生成全玻片图像(×40,0.25 μm/pixel,≤1 min;×60 Oil,0.17 μm/pixel,≤2 min;×100 Oil,0.1 μm/pixel,≤3 min)[19]。其次是骨髓细胞种类繁多,识别困难,以及骨髓涂片分析区域的不确定性。Morphogo细胞形态学分析仪(杭州智微)可自动分类识别40类常见骨髓细胞,对常见骨髓细胞的识别率高达86%,可以辅助医生提高检验效率和准确度[20-21]。AetherAI Hema(台湾云象科技)实现了11类骨髓细胞的识别[22]。Vision Bone Marrow(奥地利West Medica)实现了骨髓涂片自动分析和自动批量上片(4张/8张/200张)并可接入医院LIS信息系统[23]。以上这些细胞数字病理设备正在研发或进行临床试验过程中,尚未获得注册证进入临床应用。
3 数字病理技术在骨髓细胞形态学检验中的应用
在临床检验工作中,细胞形态学检验一般由检验医师在显微镜下进行操作。先用肉眼观察涂片整体涂片和染色情况,接着使用低倍镜观察全片情况、有无异常细胞、选定代表性镜检区域等,然后使用高倍镜或油镜在涂片合适区域内观察细胞形态,进行细胞分类和计数,并确认异常细胞,最后形成细胞形态学检验报告。
在血涂片细胞形态学检验方面,血细胞形态学分析仪主要配合血球仪的全血细胞计数和复检规则使用,对血细胞计数异常、触发复检规则或疑似为血液疾病的样本进行自动涂片,并对血涂片数字图像中的白细胞、红细胞和血小板进行预分类和计数[24],具有代表性的分析仪有CellaVison DM9600和Sysmex DI 60[6],以及Celldiff BCM-2自动血细胞形态分析系统[9]。
在骨髓涂片细胞形态学检验方面,首先使用骨髓细胞形态学分析仪的高倍物镜(×40)或油镜(×100)将骨髓涂片数字化生成全玻片数字图像,接着在具有代表性的合适区域内选取有核细胞进行细胞图像分析(×100 Oil)和自动分类计数,然后由检验医师对分析结果进行审核并出具骨髓细胞形态学检验报告,骨髓细胞数字病理分析流程见图3[16]。目前骨髓涂片图像分析仪正在研发或临床试验过程中,基本实现了骨髓涂片的全玻片数字化,并具有初步的细胞识别能力。具有代表性的Morphogo骨髓细胞形态学分析仪(杭州智微)使用高倍镜(×40)的扫描速度为50 mm2/min,使用油镜(×100)的细胞图像拍摄速度为20 张/min(4 000 × 3 000 Pixels)[16]。在使用30 867张细胞图像(145张骨髓涂片)进行的细胞识别验证试验中,该设备对常见骨髓有核细胞的识别率达到90.1%(95%CI,89.8%~90.5%);在使用124张骨髓涂片进行的与人工镜检比较的测试中,使用该设备对骨髓涂片进行图像分析与人工镜检两种分析方法之间可靠性系数(ICC)较高(ICC≥0.883),且两种分析方法对骨髓涂片中粒系和红系的细胞比例分析结果一致[16]。
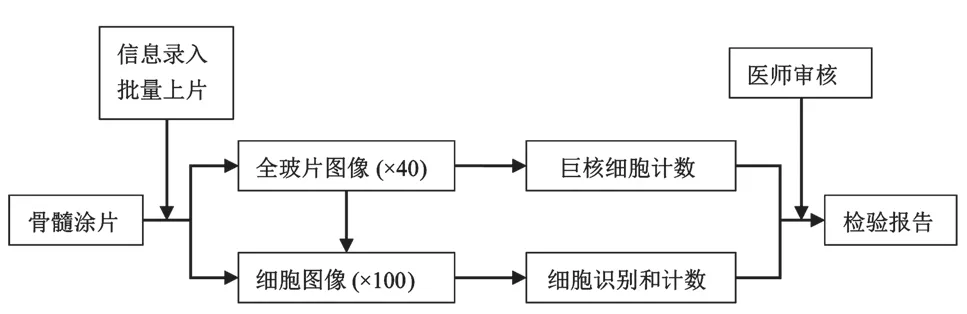
图3 骨髓细胞数字病理分析流程(修改自JIN,et al[16])Fig.3 Digital pathology analysis process of bone marrow smears(modified from JIN,et al [16])
将骨髓涂片扫描转化成数字全玻片图像,从数字图像的合适区域内采集骨髓细胞形态学检验所需的骨髓细胞信息,进行自动细胞分类和计数,从而减轻了骨髓涂片显微镜检过程中的机械劳动,提高了检验医师的工作效率和价值。骨髓细胞形态学检验的数字病理分析流程将会改变临床检验实验室中骨髓涂片的传统显微镜检流程。
4 细胞学数字病理技术的存在的问题
在临床检验实践中,细胞形态学检验一直存在细胞涂片效果有差异、染色偏酸或偏碱、细胞形态学分类和评价标准主观性强、检验医师的阅片经验水平不统一等问题。细胞学数字病理技术有望解决细胞形态学检验中的主观性问题,细胞自动分类有望提高细胞识别的客观性和准确性,细胞自动计数有望提高细胞形态学检验的工作效率;同时数字全玻片图像可以观察到更多细胞,辅助检验医师进行细胞分类,缓解用眼疲劳;生成的数字图像易于保存、传输和复查,还可用于远程会诊、辅助教学等。
进行细胞学数字病理图像分析时,自动选区一直是图像分析的难点之一。细胞图像分析仪通常只能提供选定分析区域内的细胞形态信息,不能提供全片范围内的细胞形态细节信息,这通常会增加检验医师进行细胞分类和临床检验的难度。在现实临床检验过程中,检验医师不仅可以使用整个细胞涂片信息,还可以使用其他临床信息,包括病史、化学染色、流式检测、分子细胞遗传学分析等检测结果。一种解决方式是对感兴趣的涂片区域和细胞进行重新补充拍摄,另一种解决方式是对涂片全片进行油镜(×100)拍摄。其次是细胞数字病理设备生成的数字图像过大,不仅耗费存储资源,而且存在图像传输缓慢和数据安全风险问题,5G技术的普及将会缓解这一问题。此外,尽管细胞数字病理设备对常见骨髓细胞的识别率已经达到较高水平,然而对血液病诊断具有重要意义的原始细胞识别率仍需继续提高[16,21]。最后,细胞数字病理设备尚未整合形成血液病诊断的数字化工作流程。骨髓细胞形态学检验为临床血液病诊断提供依据,然而当前血液病诊断不能仅凭细胞形态学做出诊断,必须以临床资料和细胞形态学为基础,整合免疫表型分析、细胞遗传学分析和分子遗传学分析等结果,从而形成血液病的综合诊断。随着医疗信息数字化程度不断加深,以及深度神经网络可以接受多种数据类型的输入[25],形成血液病综合诊断的数字化工作流程将成为可能。
5 总结与展望
近年来,数字病理技术在医学检验领域取得了长足的进步,在血涂片和骨髓涂片自动化分析方面出现了众多优秀的细胞学数字病理设备。这些设备借助先进的数字成像和图像分析技术将骨髓涂片和血涂片样本扫描并生成数字全玻片图像,自动进行细胞图像的分割和识别,自动生成检验报告,从而形成骨髓细胞形态学检验的全新数字病理工作流程。检验医学已进入数字化时代,数字化、标准化、自动化和智能化是细胞形态学检验发展的必然趋势;在未来检验医学的发展和构建中,数字病理技术也必将发挥更加重要的作用。

