重组人促红素联合硼替佐米和地塞米松治疗老年多发性骨髓瘤疗效评价
黄昭萍 杨灿华 梁入方 吕丽娜 谢兴文 梁韶文 黄玉娜 陈柳先
广西医科大学附属武鸣医院血液内科,广西南宁 530199
多发性骨髓瘤好发于60 岁以上的老年人,首发症状为骨痛、肾功能损害等[1]。多发性骨髓瘤前期症状大致分为四种,分别是高钙血症、肾功能损害、贫血、骨痛。其中,首发症状为骨痛的患者占发病总人数的80%~90%,患者往往表现为腰腿痛,误当做腰椎病,久治不愈才到血液科就诊[2]。目前临床上针对多发性骨髓瘤,尚未发现有效预防的方法。有研究表明,多发性骨髓瘤的发生可能与病毒等抗原反复慢性刺激使人体基因突变导致的染色体异常有关[3]。而随着化疗药物的不断问世,多发性骨髓瘤的治疗效果有了明显的提高。患者的生存期已经由原来的2~3年延长到8~9年,有的甚至可以超过10年[4]。本研究选取了80 例老年多发性骨髓瘤患者,旨在分析重组人促红素、硼替佐米联合地塞米松治疗老年多发性骨髓瘤临床效果。
1 资料与方法
1.1 一般资料
选取2016年1月至2021年4月广西医科大学附属武鸣医院收治的80 例老年多发性骨髓瘤患者作为研究对象,按照随机数字表法分为研究组(40 例)与对照组(40 例)。对照组中,男29 例,女11 例;年龄60~87 岁,平均(78.56±6.54)岁;体重44~67 kg,平均(59.64±2.32)kg;病程2~14 个月,平均(6.32±0.55)个月;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~4 分,平均(2.03±0.08)分。研究组中,男32 例,女8 例;年龄60~89 岁,平均(79.02±6.92)岁;体重45~69 kg,平均(60.03±2.28)kg;病程1~16 个月,平均(6.41±0.64)个月;ECOG 评分0~4 分,平均(2.01±0.11)分。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准。
纳入标准:①性别不限;②年龄≥60 岁;③参照中国多发性骨髓瘤诊治指南[5],结合骨髓浆细胞数量、组织活检、血清IgG 等明确诊断为有症状的多发性骨髓瘤(活动性骨髓瘤)的患者,包括适合移植患者及不适合移植患者;④签署知情同意书;⑤无其他系统严重疾病;⑥居住在本市及近郊;⑦神志清,意识清楚,具有良好的理解沟通能力;⑧心肺功能稳定;⑨所有患者均持续存在症状性贫血。
排除标准:①依从性极差者;②中途转院者;③临床资料不完整的患者;④对方案涉及到的任一研究药物过敏;⑤对应用的研究药物化疗存在禁忌;⑥合并其他严重威胁生命的疾病;⑦有自杀倾向或精神异常史者;⑧语言或文字沟通障碍;⑨伴有严重心、脑、肺等脏器疾患;⑩伴有严重认知障碍(简易认知状态检查表<27 分),无法配合治疗。
1.2 方法
对照组采用硼替佐米联合地塞米松治疗。硼替佐米(西安杨森制药有限公司,国药准字:J20050042,产品批号:20180195,规格:3.5 mg)1.3 mg/m2第1、8、15、22 天静脉给药;地塞米松(浙江仙琚制药股份有限公司,国药准字:H33020822,产品批号:S14202004087,规格:0.75 mg,)20 mg/m2,第1~4、9~12、17~20 天口服,30 d 为1 个治疗疗程,治疗2 个疗程。
研究组采用重组人促红素、硼替佐米联合地塞米松治疗。重组人促红素[麒麟鲲鹏(中国)生物药业有限公司,国药准字:S20010075,产品批号:20181120,规格:0.5 ml:1500 IU]3000 U/次,皮下注射,每周2~3次; 硼替佐米1.3 mg/m2第1、8、15、22 天静脉给药;地塞米松15 mg,第1~2、8~9、15~16、22~23 天口服。30 d 为1 个治疗疗程,治疗2 个疗程。
1.3 观察指标
比较两组的治疗效果、血液指标及不良反应的发生情况。
①治疗效果[5]。a.完全缓解:血清和尿免疫固定阴性,不存在任何软组织浆细胞瘤,以及骨髓中浆细胞<5%; 在唯一可测量是通过血清游离免疫球蛋白轻链(free immunoglobulin light chain,FLC) 水平确定的患者中,除了需要上述标准外,还需要正常的大型血小板比率(platelet-large cell rate,P-LCR)为0.26~1.65;需要连续进行两次评估。b.接近完全缓解:免疫固定可检测到血清、尿M 成分但电泳无法将其检出,或血清M 成分降低≥90%且尿M 成分<100 mg/24 h;在唯一可测量疾病是通过血清FLC 水平确定的患者中,除符合上述标准外,还需受累区和非受累区FLC 水平落差>90%;需要进行连续两次评估。c.部分缓解:血清M 蛋白降低≥50%及24 h 尿M 蛋白降低≥90%或达到<200 mg/24 h 如果无法检测血清、尿M 蛋白,受累区和非受累区FLC 水平落差需≥50%,以代替M 蛋白标准如果无法进行血清、尿M 蛋白检测及血清自由轻链检测,浆细胞减少需≥50%,以代替M 蛋白标准,前提是基线骨髓浆细胞百分比≥30%。d.轻微治疗反应:不符合完全缓解、接近完全缓解、部分缓解的标准。e.无变化为以下任何一项由最低缓解值增加25%:血清M 成分绝对增加≥0.5 g/dL; 如果开始时血清M 成分≥5 g/dL,血清M 成分增加≥1 g/dL 足以确定病情复发;尿M 成分(绝对增加必须≥200 mg/24 h);对于无法测得血清和尿M 蛋白水平的患者,受累区和非受累区FLC 水平差距(绝对增加必须>10 mg/dL)。总有效率=(完全缓解+接近完全缓解+部分缓解)例数/总例数×100%。②比较两组的血液指标,包括血红蛋白、肌酐、血钙、血清β2微球蛋白(β2microglobulin,β2-MG)、白蛋白。③不良反应参美国国家癌症研究所指定的毒性标准[6],包括嗜睡、便秘、头晕、乏力、下肢水肿、皮疹、心悸、口腔黏膜溃疡等。
1.4 统计学方法
采用SPSS 20.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t 检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2.结果
2.1 两组患者临床疗效的比较
研究组的总有效率高于对照组,差异有统计学意义(P<0.05)(表1)。
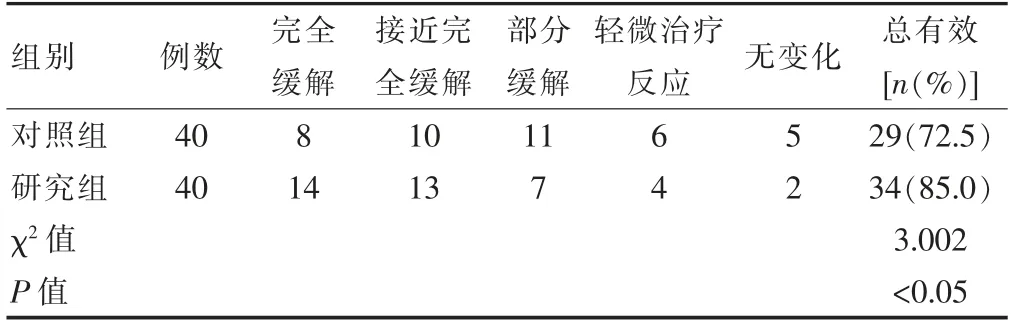
表1 两组患者临床疗效的比较(例)
2.2 两组患者治疗前后血液指标的比较
两组患者治疗前各血液指标比较,差异无统计学意义(P>0.05)。治疗后,两组患者的肌酐、白蛋白、β2-MG、血钙低于治疗前,研究组治疗后的血红蛋白高于治疗前,差异有统计学意义(P<0.05)。治疗后研究组的血红蛋白、白蛋白高于对照组,肌酐、β2-MG、血钙低于对照组,差异有统计学意义(P<0.05)(表2)。
表2 两组患者治疗前后血液指标的比较(±s)
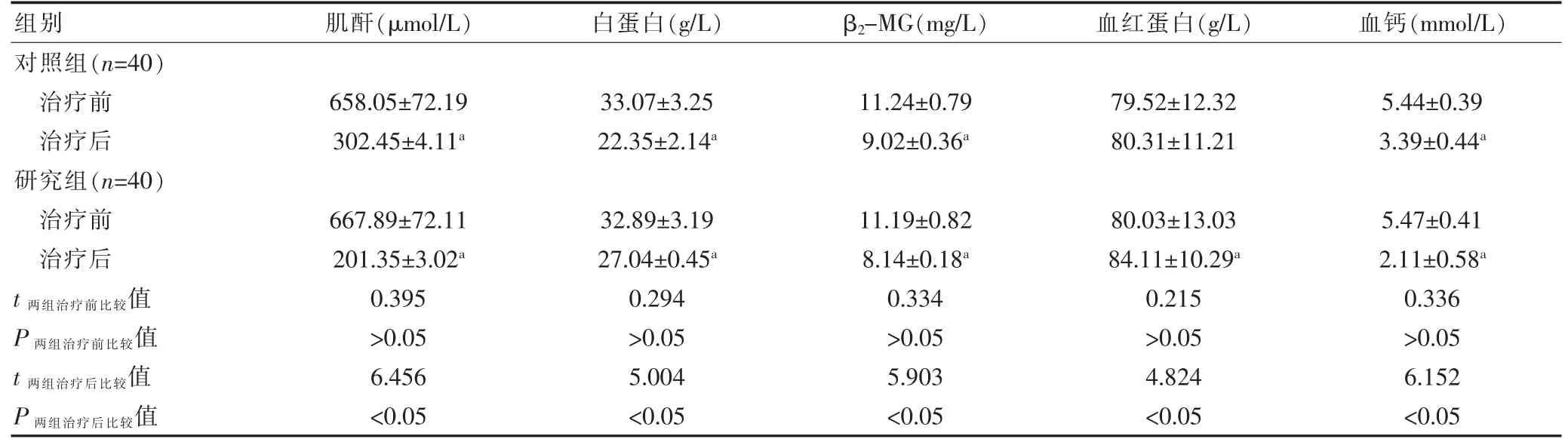
表2 两组患者治疗前后血液指标的比较(±s)
注 与本组治疗前比较,aP<0.05
组别 肌酐(μmol/L) 白蛋白(g/L) β2-MG(mg/L) 血红蛋白(g/L) 血钙(mmol/L)对照组(n=40)治疗前治疗后研究组(n=40)治疗前治疗后658.05±72.19 302.45±4.11a 33.07±3.25 22.35±2.14a 11.24±0.79 9.02±0.36a 79.52±12.32 80.31±11.21 5.44±0.39 3.39±0.44a t 两组治疗前比较值P 两组治疗前比较值t 两组治疗后比较值P 两组治疗后比较值667.89±72.11 201.35±3.02a 0.395>0.05 6.456<0.05 32.89±3.19 27.04±0.45a 0.294>0.05 5.004<0.05 11.19±0.82 8.14±0.18a 0.334>0.05 5.903<0.05 80.03±13.03 84.11±10.29a 0.215>0.05 4.824<0.05 5.47±0.41 2.11±0.58a 0.336>0.05 6.152<0.05
2.3 两组患者不良反应发生情况的比较
两组患者不良反应总发生率比较,差异无统计学意义(P>0.05)(表3)。

表3 两组患者不良反应发生率的比较(例)
3 讨论
有报道指出,多发性骨髓瘤是一种恶性浆细胞疾病,全球发病率约为每年1/10 万~5/10 万,我国多发性骨髓瘤的发病率约为1/10 万~2/10 万,已超过急性白血病,位居血液系统恶性肿瘤第二位,每天约有18人死于多发性骨髓瘤[7]。多发性骨髓瘤的确切发病原因并不明确,研究显示某些遗传和环境因素、化学物质与电辐射等因素可能与多发性骨髓瘤的形成有关[8-9]。骨髓瘤细胞在骨髓中的比例高达10%~90%,甚至更高[10]。骨髓瘤细胞不仅抑制正常红细胞、白细胞和血小板的产生,使患者发生贫血、白细胞减少及血小板减少,还会抑制其它类型免疫球蛋白的分泌。因此,一旦发现尿液中的免疫球蛋白发生异常,就要引起重视。最新一期中国恶性肿瘤发病和死亡分析报告显示,恶性肿瘤发病率在0~39 岁组处于较低水平,40岁以后开始快速升高,80 岁年龄组达到高峰[11]。积极开展对多发骨髓瘤的治疗对提高患者生活质量,改善预后有重要意义。
近年来,基于蛋白酶体抑制剂、免疫调节剂等新药的使用,多发性骨髓瘤患者的生存预后得到显著改善。和正常细胞相比,癌细胞更容易制造出大量无效、有害的蛋白质。利用蛋白酶抑制剂通过阻止蛋白酶体的正常降解蛋白质的功能,达到最终杀死癌细胞的作用。尽管蛋白酶抑制剂目前在多个癌症领域进行积极的探索,但其在多发性骨髓瘤领域的进展最为显著[12]。目前美国食品药品监督管理局已经批准三款蛋白酶抑制物,分别是硼替佐米、卡非佐米和伊沙佐米。其中硼替佐米能阻断多发性骨髓瘤细胞的酶,阻碍多发性骨髓瘤细胞增长与生存而发挥作用[13]。硼替佐米作为第一个应用于临床的蛋白酶提抑制剂,其属于可逆性蛋白酶体抑制剂,通过选择性地与蛋白酶体活性位点的苏氨酸结合,可逆性抑制哺乳动物细胞中蛋白酶体26S 亚单位的糜蛋白酶/胰蛋白酶活性。26S 蛋白酶体主要降解与泛素结合的蛋白质,而蛋白质降解会影响细胞内多级信号串联[14]。
本研究结果显示,研究组的总有效率为85.0%,高于对照组的72.5%(P<0.05)。研究证明,硼替佐米可特异性地抑制蛋白酶体26S 亚基的活性,减少核因子JB 抑制因子的降解,从而抑制与细胞增殖相关基因的表达,减少IL-6 等骨髓瘤细胞生长因子的分泌和黏附因子的表达,最终导致肿瘤细胞凋亡[15]。此外,硼替佐米还可延迟多发性骨髓瘤内肿瘤细胞的生长、诱导细胞凋亡和抑制血管新生; 增加化疗药物敏感性,克服骨髓瘤细胞对地塞米松、阿霉素和美法仑的耐药;对复发难治性多发性骨髓瘤疗法确切,不良反应较轻,多可耐受。多发骨髓瘤患者因M 蛋白过量生成,进而引起肾脏的继发性损害,β2-MG 作为一种小分子球蛋白,与免疫球蛋白稳定区有相似结构,其可反应肾小球滤过功能受损情况[9]。本研究结果显示,两组的肌酐、白蛋白、β2-MG、血钙低于治疗前,研究组治疗后的血红蛋白高于治疗前,治疗后研究组的血红蛋白、白蛋白高于对照组,肌酐、β2-MG、血钙低于对照组(P<0.05)。提示采用重组人促红素、硼替佐米、地塞米松可有效改善患者的血液指标情况。这与上述用药方案联用减少骨髓瘤细胞比例,减轻因多种细胞因子激活引起的破骨细胞损害有显著相关性。
多发性骨髓瘤的发生是因骨髓里恶性的单克隆的浆细胞发病导致。这种发生于骨髓的浆细胞瘤,虽可治疗,但无法彻底治愈。数据显示,该病的5年相对生存率仅有大约35%[16]。当恶性单克隆浆细胞在骨髓里面大量的积聚,导致患者造血功能受到抑制[17]。既往临床上治疗多发性骨髓瘤的方案包括MP(马兰法、强的松)方案、M2 方案(马兰法、强的松、长春新碱、阿霉素和地塞米松)、VAD(长春新碱、阿霉素和地塞米松)方案等[18]。但有研究显示,传统的标准方案并不能延长患者的总体生存率,仅在大剂量化疗联合干细胞移植才能改善患者的完全缓解率、无疾病进展生存时间及总体生存时间,而老年患者及不能耐受移植术的患者则迫切需要更多更有效的治疗方案[19]。研究已证实,约2/3 MM 患者出现贫血症状,影响其化疗疗效和生活质量[20]。过去,输血是纠正贫血的主要治疗方法,但存在血源紧缺、输血费用大、输血反应等多种问题。而重组人促红素的出现,提供了一种新治疗思路。本次研究中,在硼替佐米的基础上联合重组人促红素,重组人促红素由165 个氨基酸组成的糖蛋白,与红系祖细胞的表面受体结合,刺激红系祖细胞的分化,促使红细胞自骨髓向血液中释放,进而转化为成熟红细胞,可稳定红细胞膜,提高红细胞膜抗氧化酶能力。地塞米松在整个治疗方案中起到辅助化疗的目的,可发挥良好的止痛效果。两组不良反应总发生率比较,差异无统计学意义(P>0.05),提示两种治疗方法安全性相当。
综上所述,针对多发性骨髓瘤患者采用重组人促红素、 硼替佐米联合地塞米松治疗方案可获得良好疗效,改善其血液指标,安全性良好,值得临床应用与推广。

