丹参多酚酸酯调控SMAD2/FKBP1A/NF-κB 轴对骨质疏松症大鼠破骨细胞分化和骨吸收的影响
马运锋, 韩小飞
(1.河南中医药大学第二附属医院 河南省中医院骨病一科,河南 郑州 450002;2.河南中医药大学第二附属医院 河南省中医院风湿病科,河南 郑州 450002)
骨质疏松症是一种以骨量低、骨组织结构恶化和骨强度受损为特征的代谢性疾病,骨折风险极高,其中老年人最为常见[1]。在绝经后的骨质疏松症中,由于缺乏雌激素的控制,破骨细胞变得过度活 跃,导致骨吸收加强[2]。丹参多酚酸酯(salvianolate,Sal) 是中药丹参的活性成分,具有活血化瘀的功效,常用于治疗冠心病引起的心绞痛[3-4]。研究[5]表明:Sal 可通过降低骨吸收和增加骨形成缓解糖皮质激素诱导的狼疮易发性小鼠骨质丢失。SMAD家族蛋白2(SMAD family member 2,SMAD2) 是转化生长因子β (transforming growth factor-β,TGF-β) 信号的细胞内特异性传感器,参与骨代谢,在破骨细胞和成骨细胞的发育过程中起关键作用[6]。研究[7]显示:SMAD2 磷酸化水平升高可促进破骨细胞生成。研究[8]显示:Sal 可通过抑制SMAD2 介导的胶原沉积,预防心肌梗死大鼠的心房颤动。因此,在骨质疏松症中Sal 可能对SMAD2 有调控作用。FK506 结合蛋白1A (FK506-binding protein 1A,FKBP1A) 是机体普遍表达的肽基- 脯氨酰异构酶,在骨化性纤维增生症中FKBP1A 可抑制TGF-β 或骨形态发生蛋白(bone morphogenetic protein,BMP) 信号激活[9]。而FKBP1A 蛋白在骨质疏松症中的作用尚未见报道。核因子κB (nuclear factor-κB,NF-κB) 作为破骨细胞活性的关键调节因子在骨质疏松症中可被SMAD 家族蛋白(SMAD family member,SMAD) 激活[10-11]。本研究从体内和体外水平评价Sal 调控SMAD2/FKBP1A/NF-κB 轴对骨质疏松症大鼠破骨细胞分化和骨吸收的影响,为阐明其作用机制提供理论依据。
1 材料与方法
1.1 实验动物30 只SPF 级雌性Sprague Dawley(SD) 大鼠,10 周龄,体质量260~280 g; 5 只SPF 级雌性SD 大鼠,1~3 日龄,体质量10~12 g;以上SD 大鼠均购于河南省实验动物中心,动物使用许可证号:SYXK (豫) 2017-0001。
1.2 主要试剂和仪器Sal (批号:16100521) 购自上海绿谷制药有限公司,α-MEM 细胞培养液和胎牛血清(fetal calf serum,FBS) 购自美国Gibco公司,抗酒石酸酸性磷酸酶5b (tartrate-resistant acid phosphatase 5b,TRAP5b) 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA) 试剂盒购自美国Invitrogen公司,苏木精(Hematoxylin)和伊红(Eosin) 染色液购自美国Sigma 公司,兔抗Flag 和Myc 标签单克隆抗体及兔抗SMAD2和β - 肌动蛋白(β -actin) 多克隆抗体购自美国Abcam 公司,兔抗FKBP1A 和磷酸化核因子κB P65 (phosphorylated nuclear factor κB P65,p-P65)单克隆抗体购自美国Santa Cruz Biotechnology 公司,HRP 标记的山羊抗兔酶标二抗购自美国Cell Signaling Technology 公司,NF-κB 抑制剂QNZ 购自美国Med Chem Express 公司,慢病毒空载体(vector) 和慢病毒介导的FKBP1A 过表达载体(LV-FKBP1A) 由生工生物工程(上海) 股份有限公司构建,噻唑蓝(MTT) 染色液购自上海炎熙生物科技有限公司,ECL 发光液购自美国Thermo 公司。酶标仪购自美国ELX800 公司,ZLM-0.3 实验室卧式研磨机购自上海众时机械有限公司,凝胶成像分析仪购自广州瑞丰实验设备有限公司,MEDIX-90 双能X 射线骨密度仪购自法国MEDILINK 公司。
1.3 动物模型制备和给药30 只大鼠随机分为假手术组、模型组和Sal 组,每组10 只。采用10%水合氯醛(3 mL·kg-1) 腹腔注射大鼠进行麻醉,手术摘除卵巢后快速缝合伤口,观察4 周,假手术组大鼠仅暴露卵巢不摘除。Sal 组大鼠手术后4 周隔天腹腔注射40 mg·kg-1Sal,持续4 周。假手术组和模型组大鼠隔天皮下注射等体积0.9% 生理盐水,持续4 周。给药结束后采用断头法处死大鼠,取右侧股骨和骨腔组织进行下一步检测。
1.4 双能X 线骨密度仪检测各组大鼠股骨骨密度(bone mineral density,BMD)给药结束后处死大鼠,取右侧股骨组织长为1 cm 左右,采用双能X 射线骨密度仪测BMD,划定中心区域,用小物体扫描模式(分辨率为1.0 mm×1.2 mm,扫描速度50 mm·s-1,扫描宽度2.0 cm) 进行扫描。
1.5 三点弯曲试验检测各组大鼠股骨最大载荷BMD 值测定结束后,取各组骨质疏松大鼠右侧股骨,放于生物力学测试机上,找股骨中点为施压点,加压速度为2 mm·min-1,采用计算机记录并计算股骨最大载荷。
1.6 HE 染色观察各组大鼠骨组织病理形态表现大鼠处死后取股骨组织,用4% 多聚甲醛固定48 h,在10% 乙二胺四乙酸(EDTA) 中脱钙3 周,石蜡包埋,使用切片机将其切成5 μm 左右薄片,放入45 ℃恒温箱烘干,二甲苯脱蜡,酒精脱水,使用苏木精溶液染色切片5 min,用流水冲洗10 s,滴加1% 盐酸酒精和1% 氨水酒精在切片上各停留15 s,蒸馏水冲洗后加入1% 伊红染液染色3 min,梯度酒精脱水,二甲苯使切片透明,中性树胶封片。光镜下选取各组大鼠右侧股骨组织8 个高倍视野(×100) 拍照,使用IPP 软件(Image Pro -Plus Software 6.0) 观察骨小梁形态和大小。
1.7 细胞分离、培养和处理从初生SD 雌性大鼠股骨和胫骨骨髓中分离出骨髓巨噬细胞(bone marrow macrophages,BMMs),在含有10% 胎牛血清和1% 青霉素/链霉素的α-MEM 培养基中,置于37 ℃、5% CO2的恒温培养箱中培养。在细胞培养基中加入30 μg·L-1巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF) 和100 μg·L-1核因子κB 配体(nuclear factor κB ligand,RANKL) 培养细胞7 d 诱导BMMs 分化,每3 d 更换1 次细胞培养液。对照组细胞加入等体积0.9% 生理盐水; Sal 组细胞诱导分化后以10 mg·L-1Sal 孵育细胞72 h; RANKL+Sal+vector 组细胞诱导分化后加入10 mg·L-1Sal 和2 mg·L-1vector 转染48 h ; RANKL+Sal+LV-FKBP1A 组细胞诱导分化后加入10 mg·L-1Sal和2 mg·L-1LV-FKBP1A 转染48 h; RANKL+Sal+LV-FKBP1A+QNZ 组细胞诱导分化后加入10 mg·L-1Sal 和2 mg·L-1LV- FKBP1A 转染48 h,再加入10 nmol·L-1NF- κB 抑制剂QNZ (溶于10%DMSO) 孵育细胞1 h。各组细胞处理结束后转入含10% FBS 的α-MEM 培养液中培养24 h 后进行各项指标检测。
1.8 MTT 法检测各组细胞增殖活性在细胞培养的第0、2、4、6 和8 天时分别加入5 g·L-1MTT 20 μL,37 ℃孵育4 h,吸出培养液并加入150 μL DMSO,待结晶全部溶解后,使用酶标仪检测波长490 nm 处吸光度(A) 值,以A 值表示各组细胞增殖活性。
1.9 流式细胞术检测各组细胞凋亡率BMMs 以3×105mL-1的密度接种于培养基孵育24 h。收集细胞并用预冷PBS 缓冲液洗涤3 次。将细胞重悬在含有PI 的缓冲液中,室温培养15 min 后,采用BD LSRFortessa 细胞分析仪检测细胞凋亡情况,计算细胞凋亡率。细胞凋亡率=凋亡细胞数/总细胞数×100%,实验重复3 次,取平均值。
1.10 ELISA 法检测各组大鼠血清和各组细胞中TRAP5b 水平在药物干预的最后一天,以仰卧位将大鼠绑定在解剖固定板上,采用10 mL 注射器针头刺入大鼠心脏,采集血液5 mL ,放置4 h 后,以3 000 r·min-1离心5 min,分离血清。收集各组BMMs 培养液上清。采用ELISA 法按照TRAP5b检测试剂盒说明书检测各组大鼠血清和各组BMMs培养液上清中TRAP5b 水平。
1.11 免疫共沉淀(Co-Immunoprecipitation,Co-IP)分析使用在线数据库STRING 预测SMAD2 和FKBP1A 的相互作用。HEK293T 细胞培养在含10%FBS 的DMEM 培养基中,待细胞长至80%,分别加入浓度为1 g·L-1质粒在饥饿条件下进行转染,24 h 后吸取培养液,加入1 mL PBS缓冲液并刮取细胞转移至1.5 mL EP 管中,从中吸取100 μL 作为input。将剩余的细胞悬液在室温下6 000 r·min-1离心2 min,去上清,加入1 mL细胞裂解缓冲液[20 mmol·L-1Tris-HCl (pH 7.5),150 mmol·L-1NaCl,1% Triton X-100 ,0.5 mmol·L-1EDTA,0.5 mmol·L-1DTT]充分混匀,4 ℃、3 000 r·min-1离心1 min 去上清,加入预冷PBS 缓冲液重悬,重复3 次后加入等体积PBS 缓冲液充分混匀,取适量预混液加入兔抗Myc标签一抗(5 mg·L-1)、 兔抗Flag 标签一抗(1 ∶30) 和山羊抗兔二抗(1∶1 000)] 进行Western blotting 法检测。
1.12 Western blotting 法检测各组大鼠骨组织和各组细胞中SMAD2、FKBP1A 和p-P65 蛋白表达水平采用RIPA 裂解液裂解细胞并提取总蛋白,BCA 试剂盒测定样品蛋白浓度。电泳结束后用蛋白转膜仪将蛋白转印至PVDF 膜上,采用5% 脱脂牛奶将膜封闭1 h,TBST 洗膜完成后,用一抗SMAD2 (1∶1 000 稀释)、FKBP1A (1∶2 000 稀释)、p-P65 (1∶500 稀释) 和β-actin (1∶1 000 稀释) 4 ℃孵育过夜,TBST 洗膜,加入HRP 标记的山羊抗兔酶标二抗(1∶2 000 稀释) 室温孵育2 h,洗膜完成后在ECL 中显色,采用Image J 软件进行灰度值分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参β-actin 条带灰度值。
1.13 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测各组大鼠骨组织和各组细胞中组织蛋白酶K(cathepsin K,CTSK)和降钙素受体(calcitonin receptor,CTR)mRNA 表达水平将收集的小鼠右侧股骨组织放入ZLM-0.3 实验室卧式研磨机中,填充少量液氮,研磨5 min。使用TRIzol 试剂按照说明书提取大鼠骨组织和各组细胞中总RNA,使用TaqMan 试剂盒将提取的总RNA 逆转录成cDNA。引物由生工生物工程(上海) 有限公司合成,引物序列:CTSK,上游引物序列5′-ATGTGGGGGCTCAAGGTT-3′,下游引物序列5′-CCACAAGATTCTGGGGACTC-3′ ; CTR ,上游引物序列5′-TTTCAAGAACCTTAGCTGCCAGAG-3′,下游引物序列5′-CAAGGCACGGACAATGTTGAGAAG-3′;GAPDH,上游引物序列5′-GTCGGAGTCAACGGATTTGGT-3′ ,下游引物序列5′-GCCATGGGTGGAATCATATTGG-3′。PCR反应体系20 μL:2 μL 模板,2 μL 10×TaqMan 酶,1 μL 上游引物,1 μL 下游引物,14 μL ddH2O 。PCR 反应条件:95 ℃、1 min,95 ℃、30 s,56 ℃、l min,72 ℃、l min,30 个循环;72 ℃延伸10 min。用SYBR Green Mater Mix 试剂检测待检基因的mRNA 水平,重复检测3 次,以GAPDH 为内参,采用2-△△Ct法计算目的基因mRNA 表达水平。
1.14 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组大鼠股骨BMD 和股骨最大负载,各组细胞增殖活性和凋亡率,各组大鼠血清和各组细胞中TRAP5b 水平,各组大鼠骨组织和各组细胞中SMAD2、FKBP1A 及p-P65 蛋白表达水平和CTSK 及CTR mRNA 表达水平均呈正态分布,以x±s表示,多组间样本均数比较采用方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠骨组织病理形态表现和股骨BMD 及最大负载HE 染色结果显示:与假手术组比较,模型组大鼠股骨骨小梁数量明显减少,且排列较不规则;与模型组比较,Sal 组大鼠股骨骨小梁数量明显增加,骨小梁排列趋于整齐,分离程度降低。见图1。
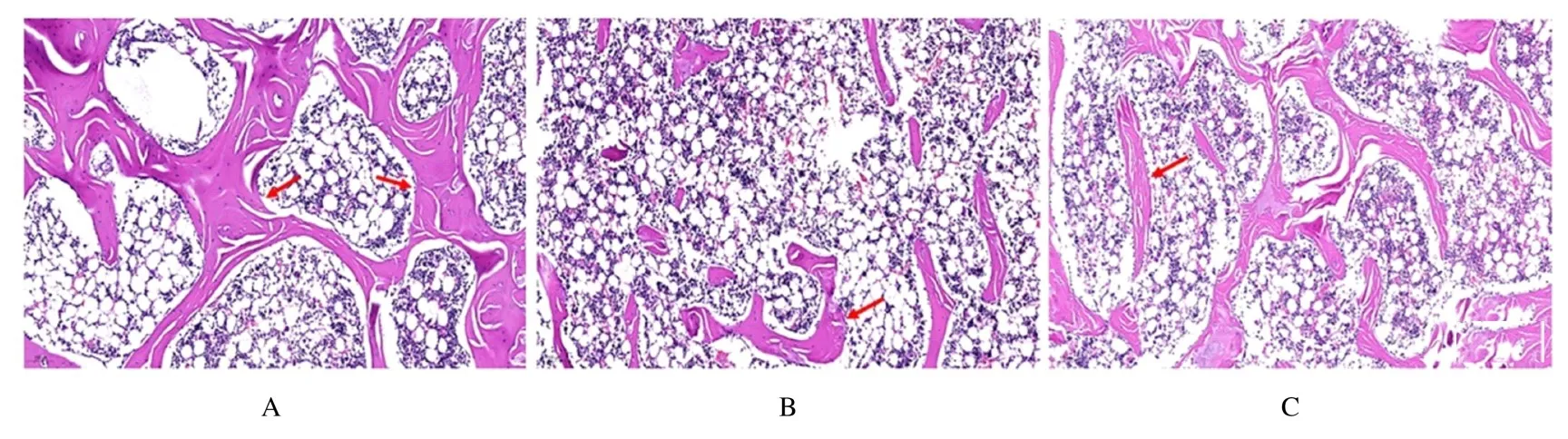
图1 各组大鼠股骨组织病理形态表现(HE,×100)Fig.1 Pathomorphology of femur tissue of rats in various groups (HE,×100)
与假手术组比较,模型组大鼠股骨BMD 和最大负载明显降低(P<0.01);与模型组比较,Sal组大鼠股骨BMD 和最大负载明显升高(P<0.01)。见表1。
表1 各组大鼠股骨BMD 和最大负载Tab.1 BMD and maximum loads of femur of rats in various groups (n=10,±s)

表1 各组大鼠股骨BMD 和最大负载Tab.1 BMD and maximum loads of femur of rats in various groups (n=10,±s)
*P<0.01 vs sham operation group;△P<0.01 vs model group.
Group Sham operation Model Sal BMD(mg·cm-3)225.32±15.37 167.25±12.16*207.28±13.25△Maximum load(F/N)65.42±4.63 41.36±2.38*56.24±4.95*△
2.2 各组大鼠血清中TRAP5b 水平、骨组织中SMAD2 及FKBP1A 蛋白表达水平和CTSK 及CTR mRNA 表达水平与假手术组比较,模型组大鼠血清中TRAP5b 水平、 骨组织中SMAD2 及FKBP1A 蛋白表达水平和CTSK 及CTR mRNA 表达水平明显升高(P<0.01); 与模型组比较,Sal 组大鼠血清中TRAP5b 水平、 骨组织中SMAD2 及FKBP1A 蛋白表达水平和CTSK 及CTR mRNA 表达水平明显降低(P<0.01)。见表2、图2 和表3。
表2 各组大鼠血清中TRAP5b 水平Tab.2 Levels of TRAP5b in serum of rats in various groups [n=10,±s,ρB/(ng·L-1)]

表2 各组大鼠血清中TRAP5b 水平Tab.2 Levels of TRAP5b in serum of rats in various groups [n=10,±s,ρB/(ng·L-1)]
*P<0.01 vs sham operation group;△P<0.01 vs model group.
Group Sham operation Model Sal TRAP5b 523.48±52.36 962.34±67.41*642.16±42.28*△

图2 各组大鼠骨组织中SMAD2 和FKBP1A 蛋白表达电泳图(A)和直条图(B)Fig.2 Electrophoregram(A) and histogram (B) of expressions of SMAD2 and FKBP1A proteins in femur tissue of rats in various groups
表3 各组大鼠骨组织中CTSK 和CTR mRNA 表达水平Tab.3 Expression levels of CTSK and CTR mRNA in bone tissue of rats in various groups (n=10,±s)

表3 各组大鼠骨组织中CTSK 和CTR mRNA 表达水平Tab.3 Expression levels of CTSK and CTR mRNA in bone tissue of rats in various groups (n=10,±s)
*P<0.01 vs sham operation group;△P<0.01 vs model group.
Group Sham operation Model Sal CTSK 1.00±0.12 6.03±0.35*2.24±0.27*△CTR 1.00±0.09 8.32±0.46*3.43±0.39*△
2.3 各组细胞增殖活性、细胞中TRAP5b 水平、CTSK 和CTR mRNA 表达水平及细胞凋亡率与对照组比较,培养4 d后,RANKL组细胞增殖活性明显升高(P<0.01),细胞中TRAP5b 水平和CTSK 及CTR mRNA 表达水平明显升高(P<0.01),细胞凋亡率明显降低(P<0.01); 与RANKL 组比较,培养4 d 后,RANKL+ Sal 组细胞增殖活性明显降 低(P<0.01),细胞中TRAP5b 水平和CTSK 及CTR mRNA 表达水平明显降低(P<0.01),细胞凋亡率明显升高(P<0.01)。见图3、 表4 、表5 和图4。

图4 流式细胞术检测各组细胞凋亡率Fig.4 Apoptotic rates of cells in various groups detected by flow cytometry
表4 各组细胞中TRAP5b 水平Tab.4 Levels of TRAP5b in cells in various groups[n=6,±s,ρB/(ng·L-1)]

表4 各组细胞中TRAP5b 水平Tab.4 Levels of TRAP5b in cells in various groups[n=6,±s,ρB/(ng·L-1)]
*P<0.01 vs control group;△P<0.01 vs RANKL group.
Group Control RANKL RANKL+ Sal TRAP5b 29.53±2.46 53.47±4.18*35.63±2.76*△
表5 各组细胞中CTSK 和CTR mRNA 表达水平Tab.5 Expression levels of CTSK and CTR mRNA in cells in various groups (n=6,±s)

表5 各组细胞中CTSK 和CTR mRNA 表达水平Tab.5 Expression levels of CTSK and CTR mRNA in cells in various groups (n=6,±s)
*P<0.01 vs control group;△P<0.01 vs RANKL group.
Group Control RANKL RANKL+ Sal CTSK mRNA 1.00±0.07 4.71±0.28*2.11±0.23*△CTR mRNA 1.00±0.09 6.53±0.41*2.89±0.32*△
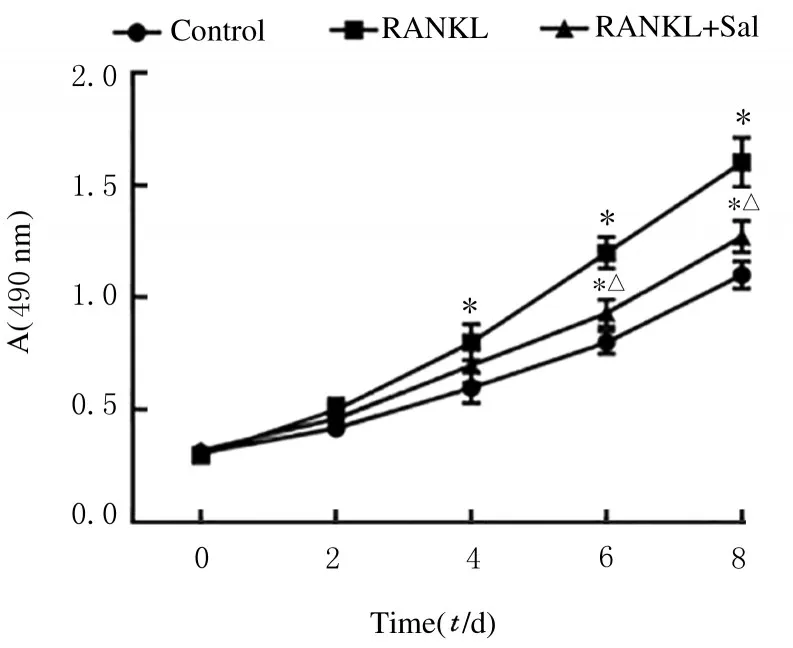
图3 各组细胞增殖活性Fig.3 Proliferation activities of cells in various groups
2.4 Co-IP 分析及各组细胞中SMAD2 和FKBP1A蛋白表达水平在线数据库STRING 预测结果显示: SMAD2 和FKBP1A 蛋白之间存在直接相互作用。Co-IP 实验结果显示:Myc 抗体和Flag 抗体均检测到SMAD2 和FKBP1A 蛋白的表达,进一步证实SMAD2 蛋白与FKBP1A 蛋白存在相互作用。见图5。Western blotting 法检测: 与对照组比较,RANKL 组细胞中SMAD2 和FKBP1A 蛋白表达水平明显升高(P<0.01); 与RANKL 组比较,RANKL+ Sal 组细胞中SMAD2 和FKBP1A 蛋白表达水平明显降低(P<0.01)。见图6。

图5 SMAD2 与FKBP1A 蛋白相互作用分析Fig.5 Analysis on interaction between SMAD2 and FKBP1A proteins

图6 各组细胞中SMAD2 和FKBP1A 蛋白表达电泳图(A)和直条图(B)Fig.6 Electrophoregram (A) and histogram (B) of expressions of SMAD2 and FKBP1A proteins in cells in various groups
2.5 Sal 调控SMAD2/FKBP1A/NF-κB 轴实验中各组细胞中SMAD2、FKBP1A 和p-P65 蛋白表达水平与对照组比较,RANKL 组细胞中SMAD2、FKBP1A 和p-P65 蛋白表达水平明显升高(P<0.01)。与RANKL 组比较,RANKL+ Sal 组细胞中SMAD2、FKBP1A 和p-P65 蛋白表达水平明显降低(P<0.01);与RANKL+Sal+vector 组比较,RANKL+Sal+LV-FKBP1A 组细 胞 中SMAD2、FKBP1A 和p-P65 蛋白表达水平明显升高(P<0.01); 与RANKL+Sal+LV-FKBP1A 组比较,RANKL+Sal+LV-FKBP1A+QNZ 组细胞中SMAD2、 FKBP1A 和p-P65 蛋白表达水平明显降低(P<0.01)。见图7。

图7 各组细胞中SMAD2、FKBP1A 和p-P65 蛋白表达电泳图(A)和直条图(B)Fig.7 Electrophoregram (A) and histogram (B) of expressions of SMAD2, FKBP1A and p-P65 proteins in cells in various groups
2.6 Sal 调控SMAD2/FKBP1A/NF-κB 轴实验中各组细胞凋亡率、细胞中TRAP5b 水平和CTSK 及CTR mRNA 表达水平与RANKL+Sal+vector组比较,RANKL+Sal+LV-FKBP1A 组细胞凋亡率明显降低(P<0.01),细胞中TRAP5b 水平和CTSK及CTR mRNA表达水平明显升高(P<0.01);与RANKL+Sal+LV-FKBP1A组比较,RANKL+Sal+LV-FKBP1A+QNZ 组细胞凋亡率明显升高(P<0.01),TRAP5b 水平和CTSK 及CTR mRNA表达水平明显降低(P<0.01)。见图8、表6 和表7。
表6 各组细胞中TRAP5b 水平Tab.6 Levels of TRAP5b in cells in various groups[n=6,±s,ρB/(ng·L-1)]

表6 各组细胞中TRAP5b 水平Tab.6 Levels of TRAP5b in cells in various groups[n=6,±s,ρB/(ng·L-1)]
*P<0.01 vs RANKL+Sal+vector group ;△P<0.01 vs RANKL+Sal+LV-FKBP1A group.
Group RANKL+ Sal+ vector RANKL+ Sal+LV-FKBP1A RANKL+ Sal+LV-FKBP1A+QNZ TRAP5b 35.41±2.39 62.27±4.16*32.28±3.25△
表7 各组细胞中CTSK 和CTR mRNA 表达水平Tab.7 Expression levels of CTSK and CTR mRNA in cells in various groups (n=6,±s)

表7 各组细胞中CTSK 和CTR mRNA 表达水平Tab.7 Expression levels of CTSK and CTR mRNA in cells in various groups (n=6,±s)
*P<0.01 vs RANKL+Sal+vector group ;△P<0.01 vs RANKL+Sal+LV-FKBP1A group.
Group RANKL+ Sal+ vector RANKL+ Sal+LV-FKBP1A RANKL+ Sal+LV-FKBP1A+QNZ CTSK mRNA 1.00±0.08 2.21±0.18*0.89±0.09△CTR mRNA 1.00±0.07 2.48±0.15*0.75±0.06*△

图8 流式细胞术检测各组细胞凋亡率Fig.8 Apoptotic rates of cells in various groups detected by flow cytometry
3 讨 论
随着全球人口的老龄化,骨质疏松症已成为严重的社会和公共卫生问题,其发病率在世界常见疾病中位居第7 位[12]。骨稳态取决于破骨细胞对骨骼的吸收和成骨细胞对骨骼的形成,该耦合关系的不平衡则会导致骨骼疾病[13]。研究[14-15]显示:骨质疏松症患者体内破骨细胞更活跃,加剧了骨吸收,而诱导破骨细胞凋亡被认为在骨吸收加速的条件下降低破骨细胞活性的有效策略。有研究[16]表明:与西药比较,补中益气汤、补肾益经汤和补骨壮骨汤等中药汤剂对于治疗骨质疏松有更好的效果。Sal 是中药丹参的有效成分,常用于治疗心脏疾病[3]。Sal 可通过上调成骨分化相关基因和蛋白的表达,促进成骨细胞分化,防止糖皮质激素治疗引起的骨丢失[17]。此外,Sal 可提高血清钙浓度,降低血清TRAP5b 水平,缓解糖皮质激素诱导引起的大鼠骨质疏松症[18]。破骨细胞标记物TRAP5b和CTR 反映了破骨细胞数量的变化,而CTSK 反映了破骨细胞的骨吸收活性[19]。本研究采用去势法建立骨质疏松症大鼠模型,结果表明:与模型组比较,Sal 组大鼠血清中TRAP5b 水平和骨组织中CTSK 及CTR mRNA 表达水平明显降低,表明Sal对雌激素缺乏引起的大鼠骨质疏松症有保护作用。
研究者[20]通过使用细胞角蛋白14(cytokeratin 14,K14) 启动子在转基因小鼠(K14-SMAD2) 上皮细胞中过表达SMAD2,结果显示:K14-SMAD2 小鼠BMD 明显降低,TRAP5b 水平、破骨细胞分化因子RANKL mRNA 表达水平和破骨细胞数量明显增加,引起小鼠牙槽骨丢失。Sal可通过抑制TGF-β1/SMAD2/3 介导的胶原沉积,改善心肌梗死大鼠心脏功能[8]。在骨质疏松症中,Sal 对SMAD2 的调控作用尚未见报道。本研究结果显示:Sal 组大鼠骨组织中SMAD2 和FKBP1A蛋白表达水平明显降低; 此外,Sal 可明显抑制RANKL 诱导后的破骨细胞增殖,促进细胞凋亡,抑制细胞中SMAD2、FKBP1A 和p-P65 蛋白表达水平。研究[21]表 明: 在心脏内皮细胞 中,FKBP1A 过表达可明显降低Notch 1 胞内结构域(Notch 1 intracellular domain,N1ICD) 的稳定性,抑制Notch 受体1 (Notch receptor 1,NOTCH1)通路的激活,促进心室壁的形成。NOTCH1 过表达可抑制NF-κB 通路激活剂RANKL 诱导的破骨细胞增殖和分化[22]。FKBP1A 在破骨细胞中的作用尚未见报道。本研究中,Co-IP实验验证了SMAD2和FKBP1A 的结合,且FKBP1A 过 表 达 可 促进SMAD2 和p-P65 蛋白的表达,抑制破骨细胞凋亡,促进TRAP5b 分泌和CTSK 和CTR mRNA 的表达,而NF-κB 通路抑制剂QNZ 可逆转FKBP1A 过表达的作用。
综上所述,Sal 通过调控SMAD2 和FKBP1A蛋白的相互作用,抑制NF-κB 信号通路,进而抑制RANKL 诱导的破骨细胞增殖和分化,促进细胞凋亡,对雌激素缺乏引起的大鼠骨质疏松症有保护作用。本研究为骨质疏松症的治疗提供了新的靶点和方向。

