丹皮酚对大鼠糖尿病视网膜病变的改善作用及其调节miR-802-5p 表达的作用机制
孙俊波, 高 达, 赵逸菲, 许 华, 邱 帆, 赵 璐
(1.河南中医药大学第二附属医院 河南省中医院内科,河南 郑州 450002;2.河南中医药大学第三附属医院内分泌科,河南 郑州 450008)
糖尿病视网膜病变(diabetic retinopathy,DR)是2 型糖尿病严重的微血管并发症,可导致视力永久性丧失[1]。有研究[2]显示:在2 型糖尿病患者中微小RNA (microRNAs,miR) -802-5p 表达水平明显升高,但其是否参与DR 进展有待进一步研究。丹皮酚具有抗炎,抗氧化和抗动脉粥样硬化等的生物学和药理学活性[3]。ZHANG 等[4]发现:丹皮酚可激活沉默信息调节因子相关蛋白1/核因子E2 相关因子2 (silent information regulator 1/nuclear ractor E2-related factor 2,Sirt1/Nrf2),通过其抗氧化作用改善糖尿病肾病发展。此外,研究[5]显示:丹皮酚可通过上调miR-339-5p 的表达减轻高迁移率族蛋白B1 (high mobility group protein B1,HMGB1) 和I-κB 激酶β (inhibitor of nuclear factor kappa-B kinase-β,IKK-β) 介导的炎症反应,缓解小鼠脓毒症,提示丹皮酚可能通过调控miRNAs 表达参与疾病进展。但丹皮酚在DR 中的作用尚未见报道。因此,本研究构建了DR 大鼠模型和高糖(high glucose,HG) 诱导的人视网膜微血管内皮细胞(human retinal microvascular endothelial cells,HRMECs),探讨丹皮酚是否通过调节miR-802-5p 表达参与DR 进展及其可能的作用机制,为临床治疗DR 提供新的思路。
1 材料与方法
1.1 实验动物无特定病原体(specefic pathogen free,SPF) 级6 周龄SD 雄性大鼠40 只,体质量(200 ± 20) g,由河南中医药大学动物实验中心提供,动物使用许可证号:SYXK (豫) 2020-0004。本研究获河南中医药大学动物伦理委员会批准。
1.2 细胞、主要试剂和仪器HRMECs 购自美国ATCC 细胞库。丹皮酚磺酸钠注射液购自金陵药业股份有限公司南京金陵制药厂,主要成分为丹皮酚磺酸钠,辅料为依地酸二钠、亚硫酸氢钠和甘油,规格2 mL (0.1 g),批号180202。链脲佐菌素(streptozotocin,STZ)、1% 青-链霉素、0.25% 胰蛋白酶/EDTA 消化液和转染试剂Lipofectamine®300 购自美国Sigma 公司,MEM 培养液和胎牛血清购自美国Hyclone 公司,蛋白裂解液购自北京Solarbio科技有限公司(货号:R0010),色素上皮细胞衍生因子(pigment epithelium-derived factor,PEDF)、 血管内皮生长因子(vascular endothelial growth factor,VEGF)、沉默调节蛋白6(silencing regulatory protein 6,SIRT6) 和β -actin一抗及相应二抗购自购自英国Abcam 公司,实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR) 试剂盒购自南京Vazyme 生物科技有限公司(货号:Q511-02),miRNA 分离纯化试剂盒购自上海伯易生物科技有限公司,miRNA反转录试剂盒购自美国Thermo Fisher 公司,活性氧(reactive oxygen species,ROS) 酶联免疫吸附测定(ELISA) 检测试剂盒购自上海联硕生物科技有限公司,过氧化氢酶(catalase,CAT) ELISA 检测试剂盒购自上海梵态生物科技有限公司,超氧化物歧化酶(superoxide dismutase,SOD) ELISA检测试剂盒购自上海谷研实业有限公司,CCK-8 试剂盒购自美国MCE 公司(货号: HY-K0301),Annexin Ⅴ-FITC 检测试剂盒购自北京全式金生物技术有限公司(货号:FA101-01)。引物由生工生物工程(上海) 股份有限公司合成。高通量RT-qPCR 仪(瑞士Roche 公司),Western blotting系统(北京六一仪器厂DYY-7C),台式低温高速离心机(日本KUBOTA 公司),细胞培养箱(上海力申科学仪器公司),流式细胞仪(美国Beckman 公司),凝胶成像分析仪(广州瑞丰实验设备有限公司)。
1.3 大鼠DR 模型构建和分组40 只大鼠随机分为对照组、DR 模型组、 15 mg·kg-1丹皮酚组和30 mg·kg-1丹皮酚组,每组10 只,适应性喂养1周。造模前禁食8 h。除对照组外其余3组大鼠一次性腹腔注射1% STZ 溶液(STZ 溶于0.1 mol·L-1、pH 4.2 的柠檬酸-柠檬酸钠缓冲液) 60 mg·kg-1构建糖尿病大鼠模型,对照组大鼠注射等量生理盐水。1 周后采用尾部静脉针取血检测大鼠空腹血糖水平。饲养期间每天更换小鼠垫料、饮水和饲料。以空腹血糖≥16.7 mmol·L-1且尿糖阳性者判定为造模成功,对于建模不成功的,补充大鼠,保证每组10 只。成功建立糖尿病模型后,采用微量进样器于大鼠颞侧角膜缘后2 mm 处,经睫状体平坦部进入玻璃体腔,缓慢注0.05 μg 乙烯基鳞片胶泥留针10 s。4 周后,眼底荧光造影检查,出现血管迂曲扩张、背景荧光增强和新生血管荧光渗漏等视为DR 大鼠造模成功。对照组和DR 模型组大鼠皮下注射8 mL·kg-1体质量生理盐水,15和30 mg·kg-1丹皮酚组大鼠皮下注射15 和30 mg·kg-1丹皮酚磺酸钠注射液,每日1 次,共2 周。治疗期间大鼠自由饮水和进食。在末次给药第2 天,腹腔注射水合氯醛麻醉大鼠,处死后取出双侧眼球保存备用。
1.4 观察各组大鼠视网膜组织病理形态表现将大鼠眼球浸入4 %多聚甲醛中固定,取视网膜组织进行石蜡包埋,制备厚度约为3 μm 的石蜡切片,脱蜡水化后进行HE 染色,光学显微镜下观察大鼠视网膜组织病理形态表现。
1.5 细胞培养和分组将HRMECs 复苏后,置于含10% 胎牛血清和1% 青-链霉素(100 U·mL-1青霉素和100 U·mL-1链霉素) 的DMEM 培养基于37 ℃、5% CO2恒温箱中培养,每2~3 d 更换1 次培养基。当细胞汇合至80% 时,采用胰蛋白酶消化重悬后按照3∶1 的比例进行传代培养,每24 h更换1 次培养基。当细胞汇合至70% 时,采用不同剂量(0、5、25、50、70 和100 mg·L-1) 丹皮酚分别处理细胞24 h 后检测各组细胞活性。随后,采用不同剂量(0、 5、 25、 50、 70 和100 mg·L-1)丹皮酚分别处理HG (33 mmol·L-1葡萄糖) 干预24 h 的细胞,并检测细胞活性。确定后续实验中丹皮酚最适作用剂量。
1.6 CCK-8 法检测各组细胞活性将各组细胞按照每孔1×105的密度接种于96 孔细胞培养板中,采用含10% 胎牛血清的DMEM 培养基制成单细胞悬液,置于37 ℃、 5% CO2条件下培养。每组设5 个复孔,待细胞长至80% 融合时,于转染后48 h加入20 μL CCK-8 溶液。培养24 h,用酶标仪在波长450 nm 处检测各组细胞的吸光度(A) 值,取平均数,计算细胞活性。细胞活性=处理组A 值/对照组A 值×100%。
1.7 流式细胞术检测各组细胞凋亡率HRMECs分为对照组、HG 组和HG+ 25 mg·L-1丹皮酚组,将各组细胞按照每孔1×105个的密度接种至6 孔细胞培养板12 h 后换液,进行24 h 无血清培养基培养。预冷PBS 缓冲液洗涤,加入预冷75% 乙醇,4 ℃固定4 h 以上。离心弃上清,PBS 缓冲液洗涤后,加入500 μL Binding Buffer悬浮细胞。加入5 μL Annexin Ⅴ-EGFP 孵育15 min,再加入5 μL PI 混匀。室温下避光反应5~15 min。于1 h 内,在FC-500 流式细胞仪上使用Beckman CXP 软件检测各组细胞凋亡率。
1.8 细胞转染和分组利用Lipofectamine®3000 分别将miR-802-5p mimic 和miR-802-5p inhibitor 转染进HRMECs 中,以NC mimic 和NC inhibitor 阴性对照序列作为对照,具体步骤参照转染试剂Lipofectamine®3000 制造商说明书进行。
HRMECs 分为以下各组:①对照组,细胞不做任何处理;②HG 组,细胞用33 mmol·L-1葡萄糖刺激24 h; ③HG+NC inhibitor 组,细 胞 用33 mmol·L-1葡萄糖刺激24 h 后转染miR-802-5p inhibitor 阴性对照; ④HG+miR-802-5p inhibitor组,细胞用33 mmol·L-1葡萄糖刺激24 h 后转染miR-802-5p inhibitor; ⑤HG+ 丹皮酚组,细胞用33 mmol·L-1葡萄糖刺激24 h 后添加25 mg·L-1丹皮酚继续培养。⑥HG+丹皮酚+NC mimic 组,细胞用33 mmol·L-1葡萄糖刺激24 h后转染miR-802-5p mimic 阴性对照,24 h 后添加25 mg·L-1丹皮酚;⑦HG+ 丹皮酚+miR-802-5p mimic 组,细胞用33 mmol·L-1葡萄糖刺激24 h 后转染miR-802-5p mimic,24 h 后添加25 mg·L-1丹皮酚。继续培养48 h,裂解细胞收集蛋白,用于以下实验。
1.9 RT-qPCR 法检测各组大鼠视网膜组织和HRMECs 中miR-802-5p 表达水平收集大鼠视网膜组织和各组HRMECs,采用miRNA 纯化试剂盒分离纯化miRNA,采用miRNA 反转录试剂盒将miRNA 逆转录为cDNA,采用miRNA qPCR 分析试剂盒进行PCR 扩增。miR-802-5p: 上游引物5′-GAATGTTGCTCGGTGA-3′,下游引物5′-GTGCAGGGTCCGAGGT-3′; 内参基因U6:上游引物5′-GCGCGTCGTGAAGCGTTC-3′,下游引物5′-GTGCAGGGTCCGAGGT-3′。采用Applied Biosystems 7900HT qPCR 系统按照以下参数进行qPCR:95 ℃预变性2 min,94 ℃变性15 s,55 ℃退火25 s,72 ℃延伸15 s,进行35 个循环。PCR 产物经1% 琼脂糖凝胶电泳检测,采用2-ΔΔCt法计算大鼠视网膜组织和HRMECs 中miR-802-5p 表达水平。
1.10 荧光素酶报告基因检测miR-802-5p 与SIRT6 的结合将HRMECs 按照1×105cm-2密度接种于6 孔细胞培养板中,待细胞汇合至80% 时,采用Lipofectamine®3000 将扩增的SIRT6 3′ UTRWT (野生型) 和SIRT6 3′UTR-MUT (突变型)分别转染入重组质粒psicheck-2 中,成功构建重组质粒psicheck-2-SIRT6 3′ UTR-WT 和psicheck-2-SIRT6 3′ UTR-MUT,分别与miR-802-5p mimic 和NC mimic共转染入HRMECs中,分为miR-802-5p+SIRT6 3′ UTR-WT、miR-802-5p+SIRT6 3′ UTRMUT 、 NC mimic+SIRT6 3′ UTR-WT 和NC mimic+SIRT6 3′ UTR-MUT 组。采用多功能酶标仪检测各组细胞中萤火虫与海肾荧光比值,代表荧光素酶活性。
1.11 RNA 免疫沉淀法检测miR-802-5p 与SIRT6的结合使用RIPA 裂解缓冲液裂解细胞,并将100 μL 裂解物与含有磁珠的RIPA 裂解缓冲液一起温育,上述磁珠与SIRT6 抗体(SIRT6 抗体组) 或正常小鼠IgG (IgG 组) 结合(阴性对照)。然后将蛋白酶K 缓冲液添加到样品中以消化蛋白质。使用TRIzol 试剂从磁珠中分离结合的RNA ,采用RT-qPCR 法检测纯化的RNA。
1.12 Western blotting 法检测各组大鼠视网膜组织和HRMECs 中SIRT6、PEDF 和VEGF 蛋白表达水平大鼠视网膜组织蛋白上样工作液制备:将0.01 g 视网膜组织与100 μL 蛋白裂解液置于玻璃匀浆器内,研磨后离心,吸出上清液,采用RIPA 裂解液提取组织中总蛋白,然后采用BCA 蛋白浓度测定试剂盒测定上清液的蛋白浓度,将一定量蛋白原液和5×蛋白上样缓冲液按比例制备(1×蛋白上样工作液)。HRMECs 蛋白上样工作液制备:将各组细胞按照每孔1×105的密度接种于6 孔板,24 h 后换液,采用无血清培养基培养。RIPA 裂解液提取总蛋白,24 h 后采用BCA 法进行蛋白定量。随后各取30 μL 样品进行SDS-PAGE,再将蛋白转移至膜上,5% 脱脂奶粉室温封闭1 h,加入兔抗VEGF (1∶10 000,ab150375)、 兔 抗PEDF(1∶10 000,ab157207)、兔抗SIRT6 (1∶2 000,ab191385) 和兔抗GAPDH (1∶2 500,ab9485)一抗,4 ℃孵育过夜。加入辣根过氧化物酶标记的山羊抗兔二抗(1∶1 000) 37 ℃孵育45 min,用ECL 液显影,使用化学发光试剂盒在化学发光系统检测,结果采用Image-Pro Plus 6 软件(Media Cybernetics) 进行分析,以目的蛋白灰度值与内参照GAPDH蛋白灰度值比值作为目的蛋白表达水平。
1.13 ELISA 法检测各组大鼠视网膜组织和HRMECs 中ROS 水平和CAT 及SOD 活性将视网膜组织研磨成组织匀浆,3 500 r·min-1离心15 min,取离心后上清液,-20 ℃冰箱中保存。将HRMECs 消化重悬,3 500 r·min-1离心5 min,取上清,-20 ℃冰箱中保存。采用ELISA 法检测待检样本中ROS 水平(mmol·g-1) 和CAT 及SOD活性(U·mg-1),实验步骤严格按照试剂盒说明书进行。
1.14 统计学分析采用SPSS 20.0 统计软件进行统计学分析。各组大鼠视网膜组织和细胞中miR-802-5p 表达水平,SIRT6、VEGF 和PEDF 蛋白表达水平,ROS 水平,CAT 和SOD 活性,各组细胞活性、凋亡率和荧光素酶活性符合正态分布,均以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用Dunnett-t法。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠视网膜组织中miR-802-5p 表达水平与对照组比较,DR 模型组大鼠视网膜组织中miR-802-5p 表达水平明显升高(P<0.01);与DR模型组比较,15 和30 mg·kg-1丹皮酚组大鼠视网膜组织中miR-802-5p 表达水平呈剂量依赖性降低(P<0.05 或P<0.01)。见图1。
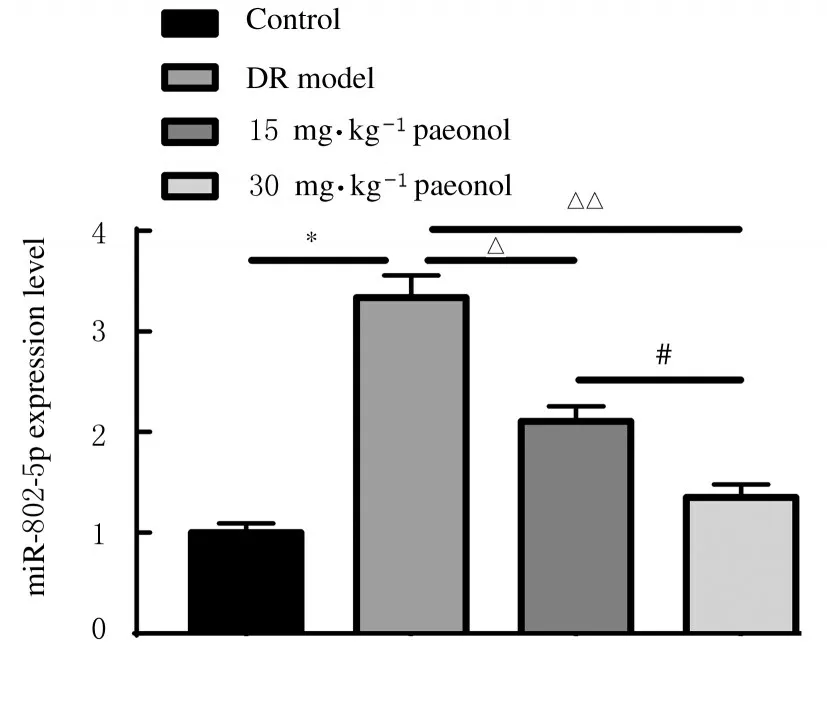
图1 各组大鼠视网膜组织中miR-802-5p 表达水平Fig.1 Expression levels of miR-802-5p in retina tissue of rats in various groups
2.2 各组大鼠视网膜组织中SIRT6、PEDF 和VEGF 蛋白表达水平与对照组比较,DR 模型组大鼠视网膜组织中SIRT6 和PEDF 蛋白表达水平明显降低(P<0.01),VEGF 蛋白表达水平明显升高(P<0.01);与DR 模型组比较,15和30 mg·kg-1丹皮酚组大鼠视网膜组织中SIRT6 和PEDF 蛋白表达水平呈剂量依赖性升高(P<0.01),VEGF蛋白表达水平呈剂量依赖性降低(P<0.01)。见图2。

图2 各组大鼠视网膜组织中SIRT6、PEDF 和VEGF 蛋白表达电泳图(A)和直条图(B-D)Fig.2 Electrophoregram (A) and histogram(B-D) of expressions of SIRT6, PEDF and VEGF proteins in retina tissue of rats in various groups
2.3 各组大鼠视网膜组织中ROS 水平及CAT 和SOD 活性与对照组比较,DR 模型组大鼠视网膜组织中ROS 水平明显升高(P<0.01),CAT 和SOD 活性明显降低(P<0.01); 与DR 模型组比较,不同剂量丹皮酚组ROS 水平明显降低(P<0.05 或P<0.01),CAT 和SOD 活性明显升高(P<0.05 或P<0.01),且30 mg·kg-1丹皮酚组治疗效果优于15 mg·kg-1丹皮酚组。见表1。

表1 各组大鼠视网膜组织中ROS 水平和CAT 及SOD 活性Tab.1 Levels of ROS and activities of CAT and SOD in retina tissue of rats in various groups (n=4,x±s)
2.4 各组大鼠视网膜组织病理形态表现对照组大鼠视网膜组织结构清晰,内外核层细胞排列规则,未见新生血管生成;DR 模型组大鼠视网膜组织结构不清晰,神经纤维层伴水肿,内外核层细胞排列疏松,有新生血管生成;不同剂量丹皮酚组大鼠视网膜组织结构较清晰,内外核层细胞排列较整齐,新生血管生成均较模型组有明显改善,且30 mg·kg-1丹皮酚组改善效果优于15 mg·kg-1丹皮酚组。见图3。
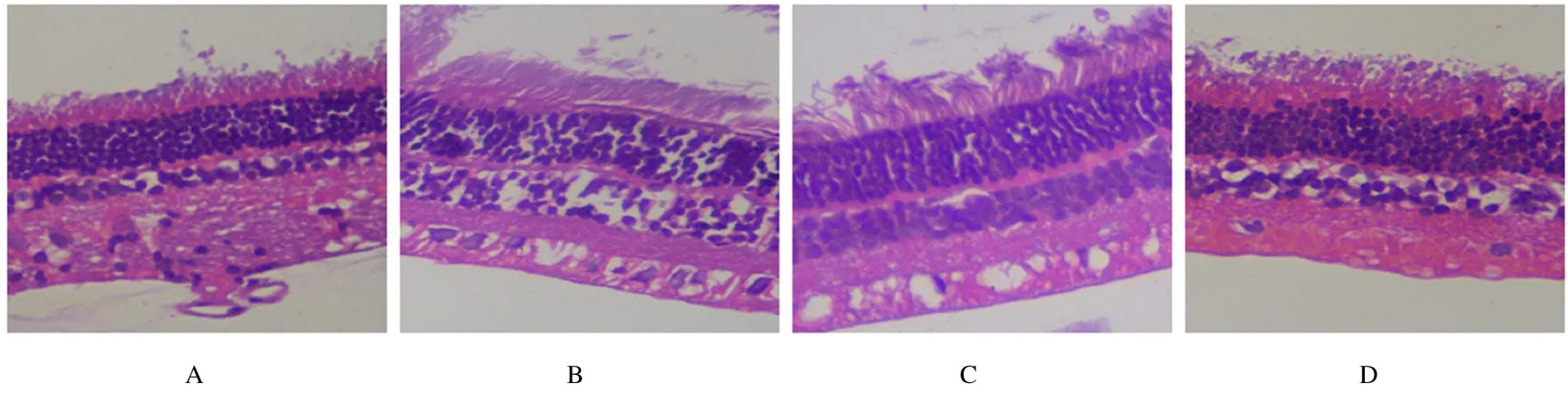
图3 各组大鼠视网膜组织病理形态表现(HE,×400)Fig.3 Pathomorphology of retina tissue of rats in various groups(HE,×400)
2.5 各组细胞活性和凋亡率与0 mg·L-1丹皮酚组比较,50、70 和100 mg·L-1丹皮酚组细胞活性呈剂量依赖性降低(P<0.05 或P<0.01)(图4A)。与0 mg·L-1丹皮酚组比较,HG 组细胞活性明显降低(P<0.01);与HG 组比较,HG+5、25、50、70 和100 mg·L-1丹皮酚组细胞活性明显升高(P<0.05)(图4B)。因此,选取对细胞无明显毒性且高效的25 mg·L-1丹皮酚进行后续实验。与对照组比较,HG 组细胞凋亡率明显升高(P<0.01);与HG 组比较,HG+丹皮酚组细胞凋亡率明显降低(P<0.01)。见图5。

图4 CCK-8 法检测各组细胞活性Fig.4 Viabilities of cells in various groups detected by CCK-8 assay
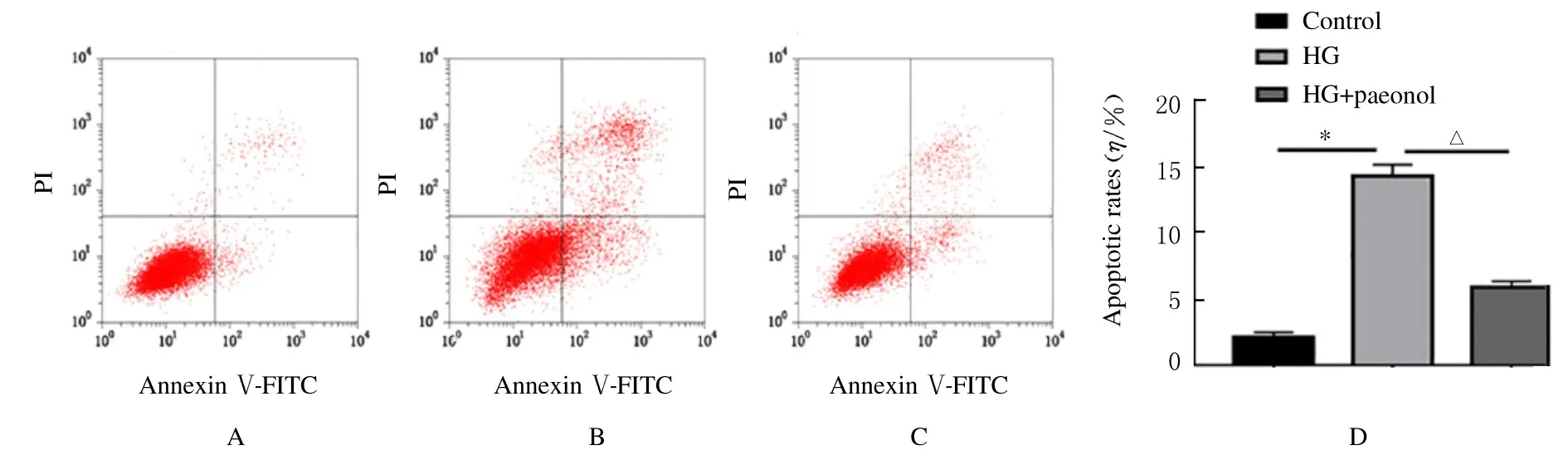
图5 流式细胞术检测各组细胞凋亡率Fig.5 Apoptotic rates of cells in various groups detected by flow cytometry
2.6 HG 处理后各组细胞中miR-802-5p 表达水平与对照组比较,HG 组细胞中miR-802-5p 表达水平明显升高(P<0.01);与HG+NC inhibitor组比较,HG+miR-802-5p inhibitor组细胞中miR-802-5p表达水平明显降低(P<0.01)。见图6。

图6 各组细胞中miR-802-5p 表达水平Fig.6 Expression levels of miR-802-5p in cells in various groups
2.7 miR-802-5p 靶向结合SIRT6miR-802-5p 与SIRT6 的结合序列见图7A。荧光素酶报告基因分析结果显示:与NC mimic+SIRT6 3′ UTR-WT 组比较,miR-802-5p+SIRT6 3′ UTR-WT 组荧光素酶活性明显降低(P<0.01); 与NC mimic+SIRT6 3′ UTR-MUT 组比较,miR-802-5p+SIRT6 3′ UTR-MUT 组荧光素酶活性差异无统计学意义(P>0.05)。见图7B。RNA 免疫共沉淀结果显示: SIRT6 抗体组miR-802-5p 的富集明显高于IgG 组(P<0.01)。见图7C。

图7 miR-802-5p 靶向结合SIRT6Fig.7 Target binding of miR-802-5p and SIRT6
2.8 各组细胞中SIRT6、PEDF 和VEGF 蛋白表达水平 与对照组比较,HG 组细胞中SIRT6 和PEDF 蛋白表达水平明显降低(P<0.01),VEGF蛋白表达水平明显升高(P<0.01);与HG+ NC inhibitor 组比较,HG+ miR-802-5p inhibitor 组细胞中SIRT6 和PEDF 蛋白表达水平明显升高(P<0.01),VEGF 蛋白水平明显降低(P<0.01)。见图8。

图8 各组细胞中SIRT6、PEDF 和VEGF 蛋白表达电泳图(A)和直条图(B—D)Fig.8 Electrophoregram (A) and histogram(B- D) of expressions of SIRT6, PEDF and VEGF proteins in cells in various groups
2.9 各组细胞中ROS 水平和CAT 及SOD 活性与对照组比较,HG 组细胞中ROS 水平明显升高(P<0.01),CAT 和SOD 活性明显降低(P<0.01); 与HG+NC inhibitor 组 比 较,HG+miR-802-5p inhibitor 组细胞中ROS 水平明显降低(P<0.01),CAT 和SOD 活性明显升高(P<0.01);与HG 组比较,HG+丹皮酚组细胞中ROS水平明显降低(P<0.01),CAT 和SOD 活性明显升高(P<0.01); 与HG+ 丹皮酚+NC mimic 组比较,HG+丹皮酚+ miR-802-5p mimic 组细胞中ROS 水平明显升高(P<0.01),CAT 和SOD 活性明显降低(P<0.01)。见表2。

表2 各组细胞中ROS 水平和CAT 及SOD 活性Tab.2 Levels of ROS and activities of CAT and SOD in cells in various groups (n=4,x±s)
3 讨 论
糖尿病是一种复杂的代谢性疾病,在世界范围内具有高发病率,并伴有各种并发症,DR 是其主要并发症之一[1]。越来越多的证据[6-7] 表明:miRNA 可通过调节细胞生物学过程(细胞增殖、迁移和凋亡) 来调节DR 进展。ZHAO 等[8] 研究表明: miR-219-5p 通过调节肝受体类似物1 (liver receptor homolog-1,LRH-1) /Wnt/β-连环蛋白信号传导途径调节人视网膜色素上皮(retinal pigment epithelial,RPE) 细胞凋亡进而影响DR 发展。GU 等[9]研究发现:抑制miR-590-3p 表达通过靶向核苷酸结合寡聚化结构域样受体蛋白1 (NLR family pyrin domain containing 1,NLRP1),并通过白细胞介素1β (interleukin-1β,IL-1β) 介导的正反馈环激活NADPH 氧化酶4 (NADPH oxidase 4,NOX4) /ROS/硫氧还蛋白互作蛋白(thioredoxininteracting protein,TXNIP) /NLRP3 通路促进人视网膜微血管内皮细胞发生焦亡。一项研究[2]已经从人类Ⅱ型糖尿病中鉴定出高表达的miR-802-5p,然而miR-802-5p 是否参与DR 的发病机制尚未明确。本研究结果表明: miR-802-5p 在HG 刺激的HRMECs 中表达上调。此外,PEDF 是丝氨酸蛋白酶抑制剂超基因家族的成员,具有新生血管抑制作用[10],而VEGF 能够介导血管内皮细胞增殖,导致新生血管形成[11]。杨洁等[12]研究表明:VEGF 在DR 中表达上调,而miR-429 可通过下调VEGF 的表达来抑制DR 的进展。ZHENG 等[13]研究显示: 过表达miR-429 后,HG 诱导的HRMEs中PEDF 蛋白表达水平升高,VEGF 蛋白表达水平降低,HRMECs 细胞损伤得到改善,与本研究结果有类似之处。本研究结果显示:miR-802-5p 表达抑制后,HG 刺激的HRMECs 中PEDF 表达上调,VEGF 表达下调。
SIRT6 是一种烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD) 依赖性组蛋白脱酰酶,可调节衰老、应激反应、癌症、能量代谢、神经变性和DNA 修复[14-15]。SILBERMAN 等[16]研究发现:SIRT6 缺陷引起视网膜传播受阻,伴随有糖酵解基因和谷氨酸受体表达的变化以及视网膜内皮细胞凋亡水平升高,加速DR 进展。ZORRILLA-ZUBILETE 等[17]研究发现: 过表达SIRT6 通过抑制VEGF 表达改善小鼠DR 引起的炎症反应和氧化应激水平。本研究采用靶基因预测网站Starbase 预测结果显示:miR-802-5p 与SIRT6 有可以互补结合的序列,可能是miR-802-5p 促进SIRT6 表达下调的分子基础。因此,推测miR-802-5p可能通过靶定抑制SIRT6 表达加速HRMECs 损伤和DR 大鼠进程。
丹皮酚是一种简单的酚类化合物,可从牡丹皮中提取,具有广泛的抗炎、抗肿瘤、抗高血压和抗氧化等生物和药理活性[18-19]。研究[20]显示:丹皮酚能够阻滞小肠黏膜刷状缘上皮细胞对于葡萄糖的吸收,同时促进脂肪细胞和皮肤成纤维细胞对于葡萄糖的摄取和利用,从而降低血糖水平。CHEN 等[21]研究显示:丹皮酚可降低STZ 诱导的糖尿病大鼠血糖水平,并降低高糖培养的系膜细胞中转化生长因子β1 (transforming growth factor-β1,TGF-β1) 和VEGF 的表达。此外,最近研究[22]显示:丹皮酚有较强的抗氧化能力。ROS 是脂质过氧化的终产物,ROS 水平可反映细胞脂过氧化的程度[23]; SOD 同样能够反映细胞的氧化应激水平[24]。CAT 是存在于机体内的一种重要的过氧化物分解酶,可使有毒的过氧化物还原成无毒的羟基化合物,发挥保护细胞膜的结构和功能[25]。杨倩等[26]研究发现:虾青素可有效改善HG 及低氧诱导的氧化应激损伤,提高组织内抗氧化应激酶CAT 和SOD 活性,发挥保护视网膜组织细胞免受氧化应激损伤。本研究结果显示:丹皮酚干预HG刺激的HRMECs 能够增强细胞活力,抑制细胞凋亡;与HG 组或DR 模型组大鼠比较,丹皮酚组细胞或组织中ROS 水平和VEGF 蛋白表达水平明显降低,CAT 和SOD 活性及PEDF 蛋白表达水平明显升高。此外,SUN 等[27]研究显示:丹皮酚可通过 下调miR-155 表达 抑制Janus 激酶1 (Janus kinase 1,JAK1) /信号传导与转录激活蛋白1(signal transducer and activator of transcription 1,STAT1) 通路激活,进而抑制细胞表面标志物因子和细胞分泌的炎症因子分泌,而转染miR-155 mimic 能够拮抗丹皮酚对细胞因子分泌的影响。本研究结果显示: 丹皮酚干预HG 刺激的HRMECs 能够下调其miR-802-5p 的表达,而转染miR-802-5p mimic 能够拮抗丹皮酚对VEGF 表达的抑制作用以及对PEDF 表达的促进作用,加速细胞损伤。
综上所述,丹皮酚可有效改善大鼠DR,其机制可能与调控miR-802-5p/SIRT6 表达有关。本研究结果为丹皮酚和miR-802-5p 参与DR 进展提供了新的证据,并为DR 的治疗提供了理论依据。

