苦瓜素Ⅰ对斜纹夜蛾几丁质酶基因(SlCht)和几丁质合成酶基因(SlCHS-A)表达及其生长发育的影响
张展滔,林晓菊,辜晓婷,叶凯翔,张伟钊,金丰良,许小霞
(华南农业大学植物保护学院,广东省生物农药创制与应用重点实验室,广州 510642)
斜纹夜蛾Spodopteralitura是世界性害虫,危害棉花Gossypiumspp.、烟草Nicotianatabacum、大豆Glycinemax以及十字花科(Brassicaceae)蔬菜等近百种经济作物,给农业生产带来巨大的损失(Yanetal.,2020)。目前,化学农药仍是防治斜纹夜蛾的主要手段,近年来的研究表明,斜纹夜蛾对有机磷酸盐、氨基甲酸酯等杀虫剂产生了抗性(Wangetal.,2018)。因此,开发绿色无公害且不易导致害虫产生抗性的植物源杀虫剂以防治斜纹夜蛾的研究愈发受到关注。
在昆虫中,几丁质(chitin)是构成体壁、中肠围食膜、唾液腺、气管生殖管等的重要组成成分,在维持昆虫机体和组织形态、免疫防御和变态发育等方面起着重要的作用。因此,几丁质的降解和合成对昆虫生长发育十分关键。昆虫几丁质酶(chitinase,Cht)属于糖苷水解酶18家族(GH18),主要作用于几丁质的降解过程。昆虫几丁质合成酶(chitin synthase,CHS)则主要作用于几丁质的合成过程(Merzendorfer and Zimoch,2003)。
苦瓜素(momordicin)是从苦瓜Momordicacharantia茎叶提取获得的葫芦烷型四环三萜类化合物,而苦瓜素Ⅰ(momordicin Ⅰ)是主要的苦瓜素类化合物,对多种害虫表现杀虫活性,具有极大的杀虫剂开发价值(曹溪等,2015)。苦瓜素Ⅰ与葫芦素的结构相似,对昆虫的作用机制可能是干预了昆虫蜕皮激素的生物合成(凌冰等,2010),但是目前尚未有基于几丁质的生物合成降解通路研究苦瓜素Ⅰ对斜纹夜蛾作用机制的报道。为此,本研究通过RT-qPCR检测斜纹夜蛾几丁质酶基因SlCht(GenBank登录号:AY326456)和几丁质合成酶基因SlCHS-A(GenBank登录号:LOC111352231)的时空表达模式,检测了苦瓜素Ⅰ对斜纹夜蛾SlCht和SlCHS-A表达的影响,并利用显微注射技术研究苦瓜素Ⅰ对斜纹夜蛾生长发育的影响,以期明确苦瓜素Ⅰ对斜纹夜蛾的杀虫活性是否与干扰几丁质的合成和降解相关,为阐明苦瓜素对斜纹夜蛾生长发育的抑制机制提供新的理论基础。
1 材料与方法
1.1 供试昆虫
斜纹夜蛾是从华南农业大学农场获取卵块,并在华南农业大学植物保护学院广东省生物农药创制与应用重点实验室连续饲养10代以上的种群,饲养条件为温度27±1℃、相对湿度70%~80%、光周期14L∶10D,饲养方法与人工饲料参照骆颖等(2012)。
1.2 主要试剂
Trizol试剂盒购自Invitrogen公司;定量反转录试剂盒PrimeScriptTMRT Master Mix购自TaKaRa公司;实时荧光定量PCR试剂盒TB Green Premix Ex Taq Ⅱ购自TaKaRa公司;其他试剂均为国产分析纯。
1.3 苦瓜素Ⅰ的制备
收集成熟苦瓜叶片,洗净晾干,研磨成粉。用分析纯甲醇浸提苦瓜茎叶干粉24 h后,渗出滤液,可反复浸提后再合并滤液。滤液用0.22 μm滤膜过滤初步提纯后,再经旋转蒸发仪蒸发浓缩,得到苦瓜素甲醇粗提物。对粗提物进行三级高效液相色谱分离(流动相为80%甲醇和20% ddH2O)。经过最终的三级高效液相色谱分离,可收集到目标时间段的流出液,流出液经干燥浓缩后得到苦瓜素Ⅰ晶体。经过液质鉴定发现,经由该方法提取到的苦瓜素Ⅰ晶体纯度大于99%。此苦瓜素Ⅰ分离方法已经获得授权专利(许小霞等,2021)。用100%DMSO溶液配制苦瓜素Ⅰ浓度为4 mg/mL的储藏液,将配制好的不同浓度苦瓜素Ⅰ放至4℃冰箱保存。
1.4 SlCht和SlCHS-A系统发育分析
通过CDD数据库(https:∥www.ncbi.nlm.nih.gov/cdd)对斜纹夜蛾几丁质生物合成降解通路中的SlCht(GenBank登录号:AY326456)和SlCHS-A(GenBank登录号:111352231)进行结构域预测;通过ClustalX和MEGA 11软件分别进行序列比对,采用邻接法(neighbor-joining method)构建基于氨基酸序列的斜纹夜蛾SlCht和SlCHS-A及其他鳞翅目、鞘翅目、膜翅目和双翅目物种的Cht和CHS-A蛋白的系统发育树。
1.5 斜纹夜蛾SlCht和SlCHS-A的时空表达模式检测
选取健康发育一致的斜纹夜蛾,分别收集卵、幼虫(幼虫期第1-18天)、预蛹、蛹和成虫样品;分别收集4-6龄第1天幼虫样品后,于磷酸缓冲液溶液(PBS)中清洗干净,用解剖刀剪去腹足,在装有200 μL PBS的离心管收集血淋巴,4℃下5 000 r/min离心10 min,收集的沉淀为血细胞。进一步在PBS中解剖获得5种组织(体壁、中肠、脂肪体、头部和马氏管),用研磨器研磨后用Trizol法提取总RNA,按照反转录试剂盒PrimeScriptTMRT Master Mix说明书操作,取2.0 μg总RNA作为模板,合成cDNA第1链。
基于斜纹夜蛾SlCht和SlCHS-A序列,用Primer Premier 3软件设计引物:SlCht-F:5′-TAGTTTC GCAAAGATACTCCC-3′;SlCht-R:5′-TAATACTTTC AGACGGTTTGCT-3′;SlCHS-A-F:5′-GAATATTCG CATTCGACCAC-3′;SlCHS-A-R:5′-TGTGACGAATC TTTGCCTTA-3′。以斜纹夜蛾GADPH(GenBank登录号:HQ012003)为内参基因(Luetal.,2013),引物序列为GADPH-F:5′-GGGTATTCTTGACTACAC-3′;GADPH-R:5′-CTGGATGTACTTGATGAG-3′。RT-qPCR反应体系(25 μL):5×cDNA模板2 μL,上下游引物(10 mmol/L)各1 μL,TB Green Premix Ex Taq Ⅱ 12.5 μL,ddH2O 8.5 μL。反应程序:94℃ 30 s;94℃ 15 s,60℃ 20 s,72℃ 30 s,40次循环。设置3次生物学重复和3次技术重复,每个生物学重复取自30头虫。
1.6 苦瓜素Ⅰ对斜纹夜蛾SlCht和SlCHS-A的表达影响测定
选取同一批次龄期一致、发育良好的6龄第1天斜纹夜蛾幼虫,用显微注射器(Eppendorf FemtoJet 4x)向斜纹夜蛾6龄幼虫注射1 μL苦瓜素Ⅰ(4 mg/mL),显微注射方法参照赵海珍等(2006)的方法进行,注射后的幼虫放在果冻杯内(直径6.7 cm,高3.6 cm)单头饲养和观察。每组30头试虫,设3组生物学重复。在注射后24,48和72 h内收集样品,先收集血细胞后解剖虫体,获得体壁、中肠、脂肪体、头部和马氏管,样品于-80℃保存。总RNA的提取、cDNA的合成和RT-qPCR检测参照1.5节进行。
1.7 苦瓜素Ⅰ对斜纹夜蛾的生长发育影响测定
在长方形饭盒(长×宽×高=17 cm×11.5 cm×5.6 cm)盒盖中央剪出一个长约为11 cm,宽约为4 cm的长方形口,盖盒盖时用长度适宜的纸巾封住方形口;每天定时更换饲料和清洁饲养环境。参照骆颖等(2012)的方法,并稍作改进,在饲养盒饲养斜纹夜蛾,在饲养盒(长×宽×高=17 cm×11.5 cm×5.6 cm)内接入200头左右在24 h内孵出的健康斜纹夜蛾幼虫,重复3盒。每天定时观察幼虫生存状况,清洁环境并更换饲料。用二甲基亚砜(DMSO)将苦瓜素Ⅰ(4 mg/mL)依次稀释为31.25,62.5,125,250和500 μg/mL,并保持DMSO在不同浓度苦瓜素Ⅰ中的终浓度为5%,选择发育正常、个体大小一致的4龄幼虫,先按顺序对其称重并记录,以只注射5% DMSO为对照。显微注射方法参照赵海珍等(2006)的方法进行,用显微注射器在斜纹夜蛾4龄幼虫的第2和第3对腹足之间注射,针头朝向虫头部,在腹部侧面注入1 μL的苦瓜素Ⅰ药液,以5% DMSO溶液作对照,每个处理4龄幼虫30头,处理重复3次。在注射过程中因注射失误造成重伤或死亡的幼虫全部舍去。注射后的幼虫在果冻杯内(直径6.7 cm,高3.6 cm)单头饲养。每天定时观察和记录试虫的存活、蜕皮和表型变化等情况,并且在处理后的2,4和6 d计算各处理组活虫的体重,以及幼虫和蛹历期、幼虫增重、蛹重、蛹长度、化蛹率、羽化率和存活率(骆颖等,2012;曹溪等,2015)。幼虫增重=每时段幼虫体重-幼虫初始体重;体重增重抑制率(%)=对照组幼虫增重-处理组幼虫增重)/(处理组幼虫增重)。
1.8 数据分析
采用软件SPSS(IBM SPSS Statistic 25)进行统计学分析,并用Duncan氏检验及单因素方差分析(one-way ANOVA)和独立样本T检验对数据进行差异显著性分析。使用OriginPro 2022对数据进行可视化处理。基因相对表达量用2-ΔΔCt方法进行计算。
2 结果
2.1 SlCht和SlCHS-A的系统发育
系统发育树(图1)表明,斜纹夜蛾SlCht和SlCHS-A及鳞翅目其他物种的Cht和CHS-A蛋白高度保守,推测它们的功能在鳞翅目中也具有高度相似性。
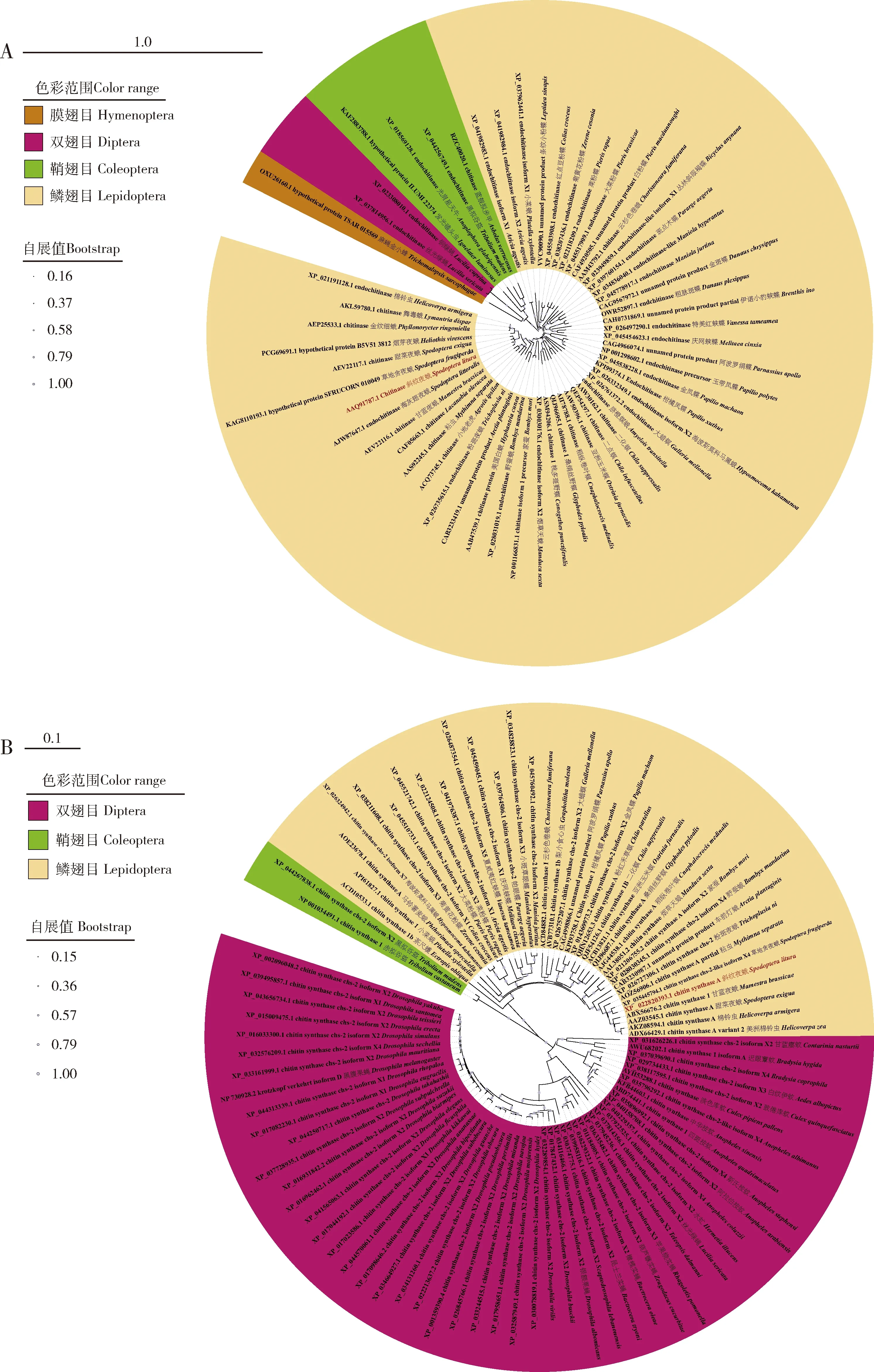
图1 基于氨基酸序列构建的斜纹夜蛾及其他昆虫物种Cht (A)和CHS-A(B)蛋白的系统发育树(邻接法)Fig.1 Phylogenetic tree of Cht (A) and CHS-A (B) proteins from Spodoptera litura and other insect species based on the amino acid sequence (neighbor-joining method)标尺示遗传距离。Scale bars indicate the genetic distance.
2.2 SlCht和SlCHS-A的发育表达模式
如图2所示,SlCht和SlCHS-A的发育表达模式较为接近,在卵期的表达量最高,是幼虫期、预蛹期表达量的4倍左右。SlCht和SlCHS-A在幼虫期的表达量随着生长时间和龄期的变化而变化,在6龄幼虫期的表达量最高,在其他幼虫龄期表达量低;此外,在1-5龄幼虫期的表达呈现龄初低,龄末升高的模式。图2结果也表明斜纹夜蛾SlCht和SlCHS-A在蛹期和成虫期的表达还与性别相关,这两个基因在雄蛹中的表达量高于雌蛹中的表达量,而雄成虫中的表达量比雌成虫中的低。
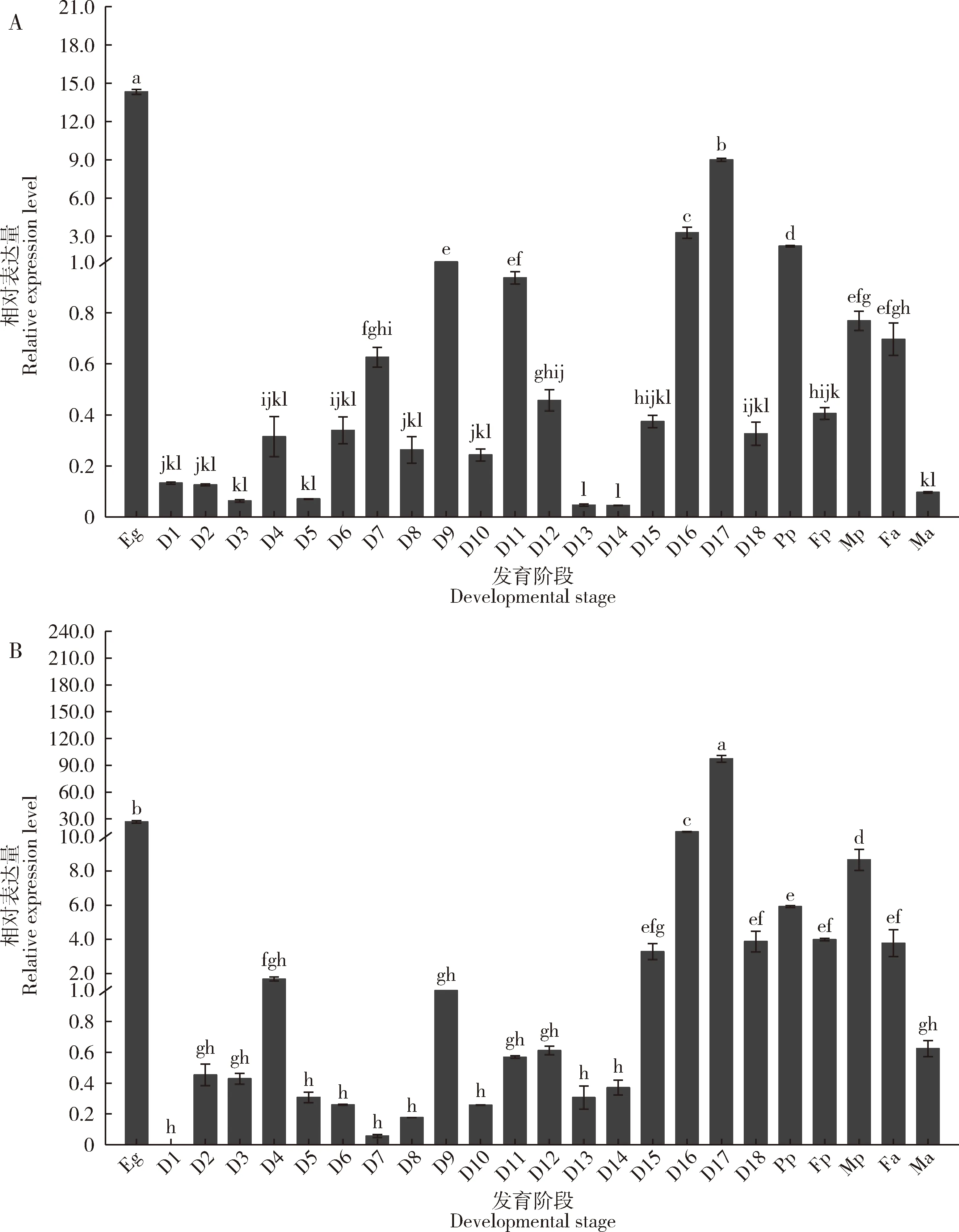
图2 斜纹夜蛾不同发育阶段SlCht(A)和SlCHS-A(B)的表达量Fig.2 Expression levels of SlCht (A) and SlCHS-A (B) at different developmental stages of Spodoptera lituraEg:卵Egg;D1-4:分别为1龄第1-4天幼虫Day 1-4 1st instar larva,respectively;D5-7:分别为2龄第1-3天幼虫Day 1-3 2nd instar larva,respectively;D8-9:分别为3龄第1和2天幼虫Day 1 and 2 3rd instar larva,respectively;D10-12:分别为4龄第1-3天幼虫Day 1-3 4th instar larva,respectively;D13-15:分别为5龄第1-3天幼虫Day 1-3 5th instar larva,respectively;D16-18:6龄第1-3天幼虫Day 1-3 6th instar larva,respectively;Pp:预蛹Prepupa;Fp:雌蛹Female pupa;Mp:雄蛹Male pupa;Fa:雌成虫Female adult;Ma:雄成虫Male adult.图中数值为平均值±标准误(n=3);柱上不同小写字母表示差异显著(P≤0.05,单因素方差分析,Duncan氏新复极差检验法)。Data in the figure are mean±SE(n=3).Different small letters above bars indicate significant difference (P≤0.05,one-way ANOVA,Duncan’s new multiple range test).图3同。The same for Fig.3.
2.3 SlCht和SlCHS-A的组织表达模式
结果如图3,斜纹夜蛾SlCht和SlCHS-A在4-6龄幼虫期都有表达,且在同一龄期不同组织中的表达不一致。SlCht和SlCHS-A在血细胞中表达量最高,在体壁中的表达量次之,在马氏管中的表达量最低。SlCht和SlCHS-A在血细胞中表达量是在体壁中的2倍,分别是在马氏管中的278.5和130.2倍,这2个基因在两组织间的表达量均差异显著(P≤0.05)。
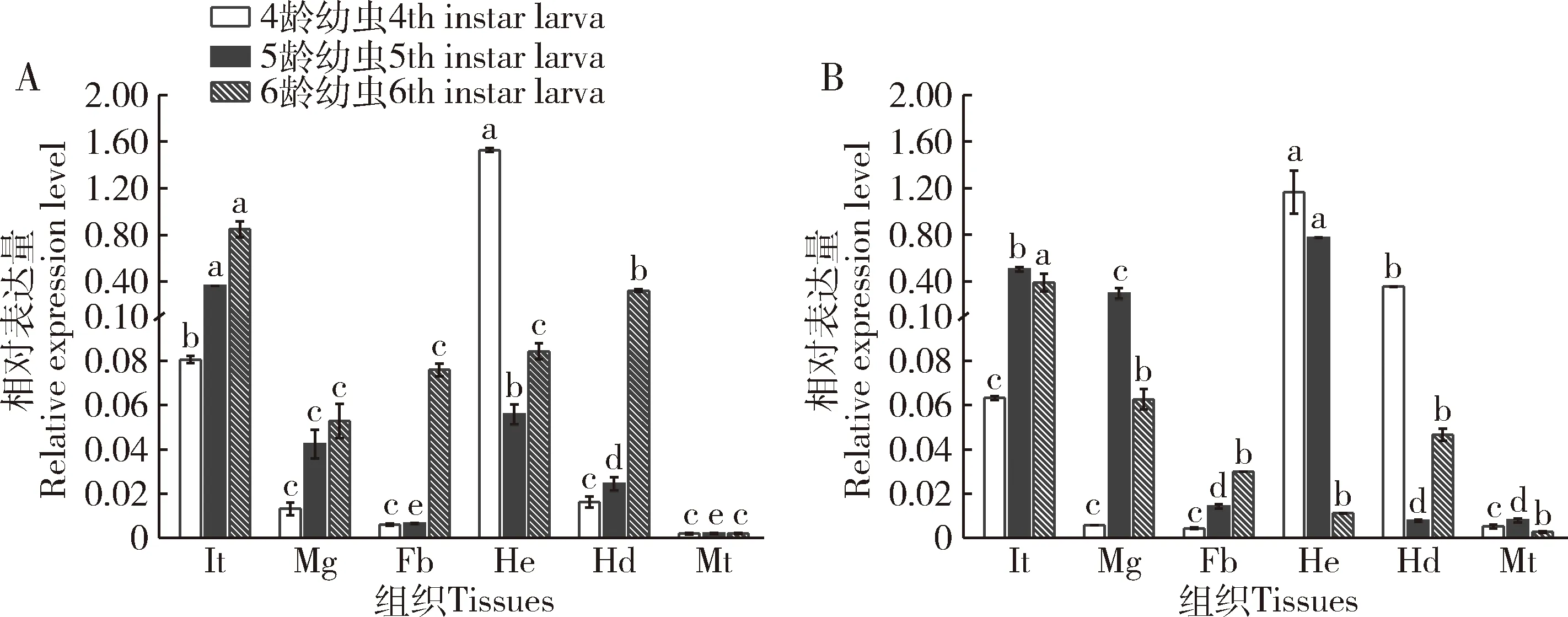
图3 斜纹夜蛾4-6龄幼虫不同组织中SlCht(A)和SlCHS-A(B)的表达量Fig.3 Expression levels of SlCht (A) and SlCHS-A (B) in different tissues of the 4th-6th instar larvae of Spodoptera lituraIt:体壁Integument;Mg:中肠Midgut;Fb:脂肪体Fat body;He:血细胞Hemocyte;Hd:头部Head;Mt:马氏管Malpighian tubules.图4同The same for Fig.4.
2.4 苦瓜素Ⅰ对SlCht和SlCHS-A表达的影响
选择健康的斜纹夜蛾6龄第1天幼虫注射4 μg/头苦瓜素Ⅰ后,与对照组(注射5% DMSO)比较,幼虫体壁、中肠、脂肪体、血细胞、头部和马氏管中SlCht和SlCHS-A的表达呈现下调,但程度存在差异。苦瓜素Ⅰ处理斜纹夜蛾后24 h时,体壁(P≤0.001)、中肠(P≤0.01)、脂肪体(P≤0.001)、头部(P≤0.001)和马氏管(P≤0.05)内SlCht基因表达量极显著低于对照组(图4:A),体壁(P≤0.01)、中肠(P≤0.05)、脂肪体(P≤0.01)和马氏管(P≤0.05)中SlCHS-A基因表达量显著低于对照组(图4:B);处理后48 h时,SlCht在体壁(P<0.05)、血细胞(P≤0.01)、头部(P≤0.05)和马氏管(P≤0.001)内表达量显著低于对照组(图4:C),脂肪体(P≤0.001)、血细胞(P≤0.001)、头部(P≤0.01)和马氏管(P≤0.01)中SlCHS-A表达量显著低于对照组(图4:D);处理后72 h时,SlCht基因在头部(P≤0.001)、中肠(P≤0.001)和马氏管(P≤0.01)中表达量显著低于对照组(图4:E),脂肪体(P≤0.05)和血细胞(P≤0.01)中SlCHS-A表达量显著低于对照组(图4:F)。
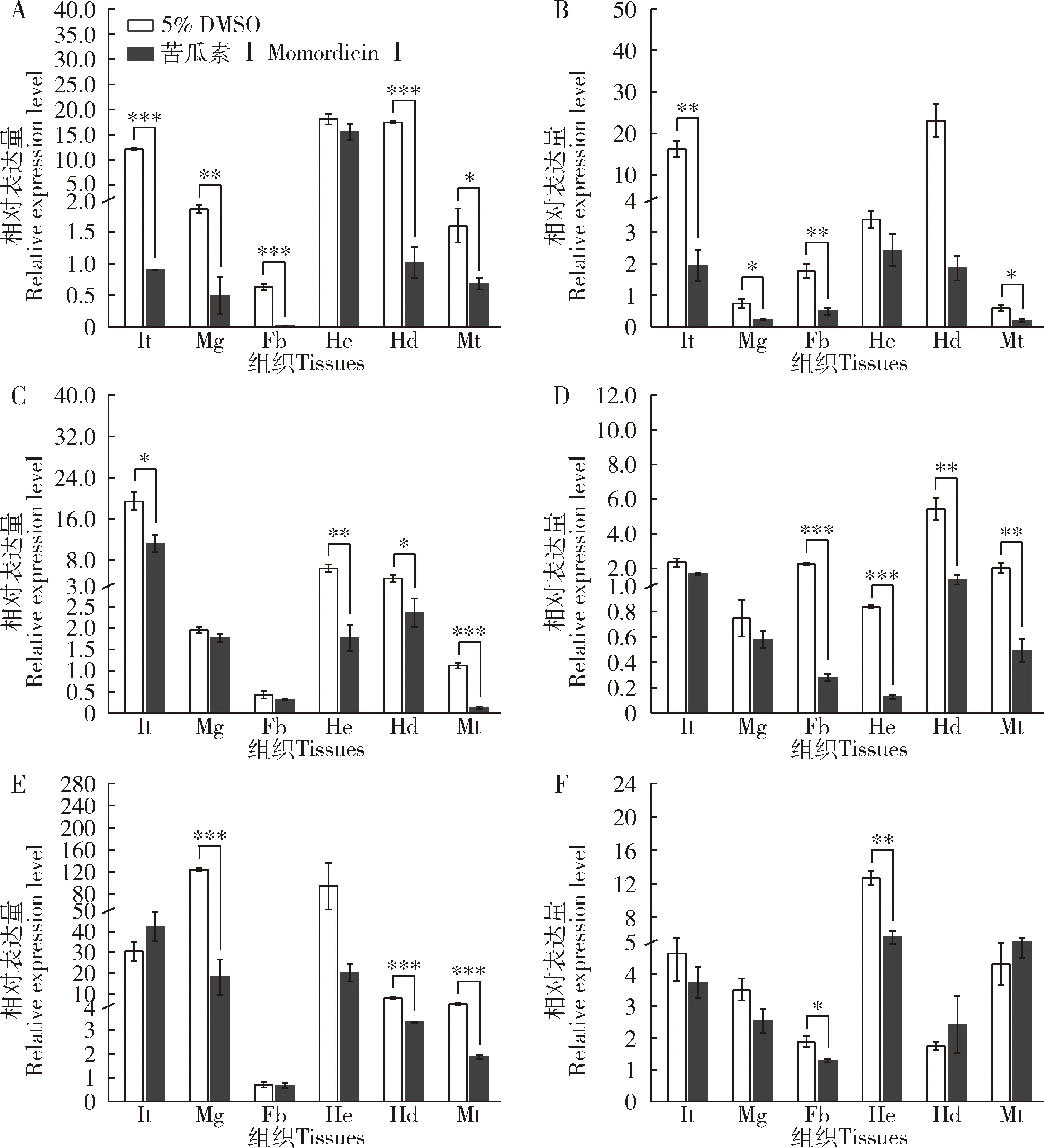
图4 注射苦瓜素Ⅰ(4 μg/头) 24(A,B),48 (C,D)和72 h (E,F)后斜纹夜蛾6龄幼虫SlCht(A,C,E)和SlCHS-A(B,D,F)的组织表达谱Fig.4 Tissue expression profiles of SlCht (A,C,E) and SlCHS-A (B,D,F) in the 6th instar larvae of Spodoptera litura at 24 (A,B),48 (C,D) and 72 h (E,F) after injection with momordicin I (4 μg/individual)处理组中每幼虫中注射苦瓜素Ⅰ溶液(4 μg/头),对照组中每幼虫注射同体积(1 μL) 5% DMSO溶液。图中数据为平均值±标准误(n=3);柱上星号表示两组间差异显著(*P≤0.05,**P≤0.01,***P≤0.001)(独立样本T检验)。Each larva in the treatment group was injected with momordicin I solution (4 μg/individual) and that in the control group was injected with 5% DMSO solution of the same volume (1 μL).Data in the figure are mean±SE (n=3).Asterisks above bars indicate significant difference between two groups (*P≤0.05,**P≤0.01,***P≤0.001)(independent samples T-test).
2.5 苦瓜素Ⅰ对斜纹夜蛾生长发育的抑制作用
以浓度为31.25,62.5,125,250和500 ng/头的苦瓜素Ⅰ注射斜纹夜蛾4龄第1天幼虫,对幼虫增重有明显的抑制作用,处理后2和6 d时,各浓度处理的幼虫增重均显著低于对照组(5% DMSO)(P<0.05);苦瓜素Ⅰ处理后4 d时,只有125和500 ng/头浓度处理的试虫的体重增重均显著低于对照组(P<0.05)。在5个浓度处理组中,苦瓜素Ⅰ处理后2 d时的体重增重抑制率依次为24.81%,20.75%,24.61%,18.30%和28.08%,6 d时分别为9.99%,22.12%,19.31%,22.92%和16.94%,可以看出,500 ng/头处理组处理后2 d时的抑制效果最佳(图5)。通过计算,在所用的苦瓜素Ⅰ浓度内,斜纹夜蛾幼虫的体重增重抑制率均没有浓度依赖性。
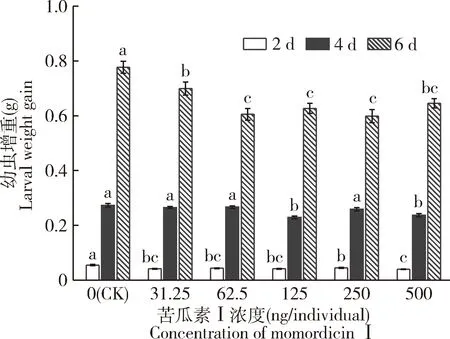
图5 注射不同浓度苦瓜素Ⅰ不同天数后斜纹夜蛾4龄幼虫的体重增重Fig.5 Body weight gain of the 4th instar larvae of Spodoptera litura at different days after injection with different concentrations of momordicin ⅠCK:5% DMSO.图中数值为平均值±标准误(n=30);相同颜色柱上不同字母表示同一天不同浓度处理间幼虫增重的差异显著(P≤0.05,单因素方差分析,Duncan氏新复极差检验法)。Data in the figure are mean±SE (n=30).Different letters on the same color bar indicate significant differences in the larval weight gain between treatments of different concentrations on the same day (P≤0.05,one-way ANOVA,Duncan’s new multiple range test).
浓度为250和500 ng/头苦瓜素Ⅰ处理2,4和6 d,4,5和6龄幼虫历期均比对照组(5% DMSO)显著延长(P≤0.05)。这两组处理组4-6龄幼虫历期分别比对照组幼虫历期延长了0.90和1.09 d。只有500 ng/头苦瓜素Ⅰ注射斜纹夜蛾蛹后,对蛹历期有显著的影响,其蛹历期比对照组延长了0.85 d(F=5.217,P<0.001)(表1)。结果表明500 ng/头苦瓜素Ⅰ注射处理斜纹夜蛾对斜纹夜蛾4龄到成虫前的整个历期的影响最显著。

表1 注射不同浓度苦瓜素Ⅰ对斜纹夜蛾4-6龄幼虫及蛹发育历期的影响Table 1 Effects of injection of different concentrations of momordicin Ⅰ on the developmental duration of the 4th-6th instar larvae and pupae of Spodoptera litura
浓度为 500 ng/头苦瓜素Ⅰ处理斜纹夜蛾4龄幼虫后,蛹重、蛹长度和化蛹率显著低于对照组(表2),这表明苦瓜素Ⅰ不仅抑制斜纹夜蛾幼虫的体重增重和发育进度,而且对斜纹夜蛾蛹重、蛹长度和化蛹率具有一定的抑制作用。不过各浓度处理对斜纹夜蛾存活率和羽化率的影响并不显著。
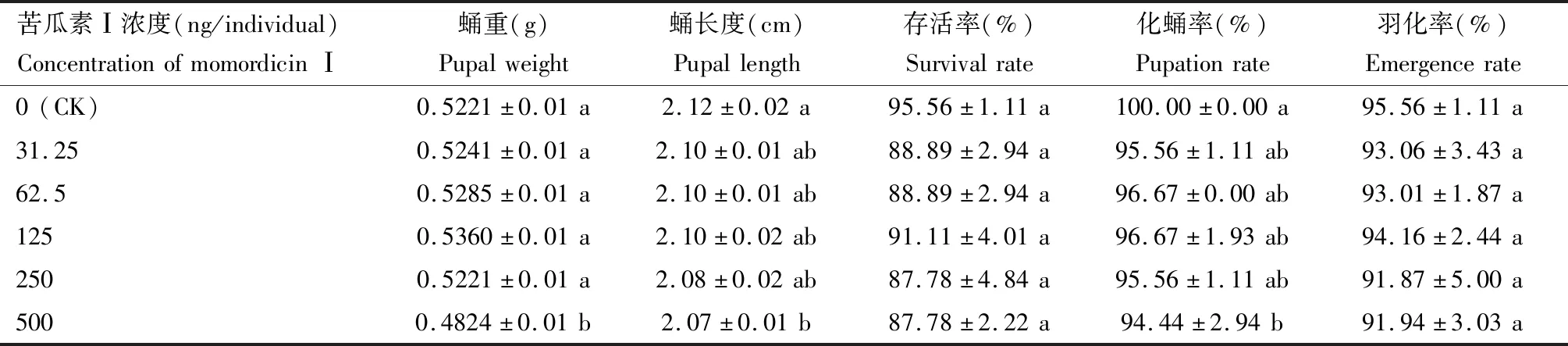
表2 斜纹夜蛾4龄幼虫中注射不同浓度苦瓜素Ⅰ对蛹重、蛹长度、化蛹率、羽化率和存活率的影响Table 2 Effects of different concentrations of momordicin Ⅰ injected into the 4th instar larvae of Spodoptera litura on the pupal weight,pupal length,pupation rate,emergence rate and survival rate
将各个浓度苦瓜素Ⅰ处理斜纹夜蛾过程中均发现斜纹夜蛾幼虫和蛹出现畸形。其中浓度为500 ng/头苦瓜素Ⅰ处理斜纹夜蛾4龄幼虫后,斜纹夜蛾幼虫及蛹出现畸形率最高,达到30%的概率(图6)。斜纹夜蛾幼虫出现了双体壁的畸形表现,蜕下的旧体壁没有脱离虫体,束缚了幼虫的生长发育(图6:E);部分斜纹夜蛾幼虫出现了严重的拒食现象,引发虫体皱缩(图6:F)。
斜纹夜蛾的畸形表现主要集中在蛹期。斜纹夜蛾蛹出现触角部分偏离其原附着部位(图6:G)或是存在沿着触角甚至胸足附着部位的裂缝(图6:H),进一步观察发现这些蛹大部分能羽化。部分斜纹夜蛾蛹的翅部畸形表现如图6(I,J)。图6(I)中的蛹的翅部体壁发育较短,露出较软的乳白色里层;而图6(J)中的蛹畸形最严重,具有致死性,蛹的头胸部整个内缩严重,翅部体壁向头部皱缩,大面积露出内里,头胸部的组织、器官发育严重受阻,最终蛹死亡。图6(K-P)是幼虫化蛹失败的现象。幼虫化蛹时蜕皮失败,大部分旧体壁包围着蛹形成半蛹半幼虫的畸形状态。以上图片结果表明了苦瓜素Ⅰ能干扰斜纹夜蛾幼虫的蜕皮过程并且影响化蛹过程及蛹的发育。

图6 在斜纹夜蛾4龄幼虫中注射500 ng/头苦瓜素Ⅰ引起幼虫和蛹畸形Fig.6 Injection of 500 ng/individual momordicin Ⅰ into the 4th instar larvae of Spodoptera litura results in larval and pupal malformation照片在LEICA体视显微镜下拍摄Photos were taken under LEICA stereoscopic microscope.A:健康4龄末期幼虫Healthy late 4th instar larva;B,C:健康蛹的头胸部Head and thorax of healthy pupa;D:健康蛹的腹部Abdomen of healthy pupa;E,F:异常幼虫Abnormal larvae;G,H:触角异常的蛹Pupae with abnormal antenna;I,J:头胸部异常的蛹Pupae with abnormal head and thorax;K-M:蜕皮失败的蛹头胸部Head and thorax of pupae that failed to molt;N-P:蜕皮失败的蛹的腹部Abdomen of pupae that failed to molt.
3 讨论
本研究利用RT-qPCR检测了斜纹夜蛾SlCht和SlCHS-A在各个发育阶段(卵、幼虫、预蛹、蛹和成虫)和4-6龄幼虫6种组织(体壁、中肠、脂肪体、血细胞、头部和马氏管)中的表达情况(图2和3)。RT-qPCR结果表明斜纹夜蛾SlCht和SlCHS-A基因的表达具有发育特异性和组织特异性。SlCht和SlCHS-A在卵期特异性高表达,在幼虫期和预蛹期表达量较低;在不同的幼虫期,SlCht和SlCHS-A在6龄幼虫特异性高表达,在1-5龄幼虫期的表达量低且呈现龄初低、龄末高的表达模式(图2)。昆虫几丁质酶的表达在蜕皮前达到高峰(李瑶和范晓军,2011)。张群玲等(1999)研究表明斜纹夜蛾产卵以后87 h内进行胚胎发育过程,形成体壁、各种微管及中肠等结构。因此,这些现象说明SlCht和SlCHS-A与斜纹夜蛾的胚胎发育、幼虫到幼虫的蜕皮过程以及幼虫到蛹变态过程有关。SlCht和SlCHS-A在多个组织中都有检测到表达,在血细胞中表达量最高,在体壁中的表达量次之,在马氏管中的表达量最低(图3)。SlCht和SlCHS-A基因在血细胞中特异性高表达说明这两种基因除了参与体壁和中肠围食膜中的几丁质降解与合成外,还存在着其他生理功能。
本研究中,斜纹夜蛾在注射 4 μg/头苦瓜素Ⅰ剂量下,其体壁、中肠、脂肪体、头部、血细胞和马氏管中的SlCht和SlCHS-A的表达被诱导下调(图4)。研究还发现,在500 ng/头低注射剂量下,苦瓜素Ⅰ对斜纹夜蛾幼虫的生长发育具有抑制作用,幼虫体重增重受到抑制(图5),4-6龄幼虫和蛹的历期延长,蛹体重下降,化蛹率降低以及幼虫后出现了幼虫蜕皮异常、化蛹失败、蛹翅部畸形严重等现象(表1和2;图6)。这表明了苦瓜素Ⅰ干扰斜纹夜蛾的蜕皮过程以及幼虫-蛹-成虫的变态发育过程,而苦瓜素Ⅰ对斜纹夜蛾的抑制作用可能是引起斜纹夜蛾蜕皮失败、由中肠结构损坏而导致的拒食、蛹发育不良等现象的原因之一。由于几丁质的生物合成和降解途径复杂严密,苦瓜素对斜纹夜蛾几丁质的影响机制还需进一步研究,并且SlCht和SlCHS-A基因的功能还待进一步确定。

