家蚕Wnt信号通路下游关键基因Pangolin转录剪接体X3的克隆和分析
王叶菁,付秋杰,殷子晴,何华伟,*
(1.西南大学,家蚕基因组生物学国家重点实验室,生物学研究中心,西部(重庆)科学城种质创制大科学中心,重庆400715;2.西南大学西塔学院,重庆400715)
Wnt(wingless-related integration site,Wnt)是一类高度保守的富含半胱氨酸的蛋白,参与胚胎细胞命运决定、细胞迁移、细胞极性、神经模式、器官发生、细胞增殖分化、组织稳态和再生等过程(Nusse,1992;Logan and Nusse,2004;Komiya and Habas,2008)。目前已经鉴定了3种Wnt信号通路:经典Wnt通路(canonical Wnt pathway)、非经典Wnt/平面细胞极化通路(noncanonical Wnt/planar cell polarity pathway,Wnt/PCP)和非经典Wnt/钙通路(noncanonical Wnt/calcium pathway)。Wnt/PCP通路通过调控细胞骨架控制细胞形状,Wnt/钙通路调控细胞内钙离子的浓度(Miller,2001;Komiya and Habas,2008)。经典Wnt通路是指Wnt蛋白与细胞表面Frizzled受体家族结合后,抑制下游Axin/GSK-3/APC复合物,从而提高了胞浆内β-catenin的稳定性。部分β-catenin进入细胞核,与TCF/LEF转录因子结合,促进特定基因的表达(Jandaetal.,2012;Stamosetal.,2014;Jandaetal.,2017;Nusse and Clevers,2017)。
研究发现,黑腹果蝇Drosophilamelanogaster基因组中包含1个Wnt/β-catenin通路的核内效应转录因子dTCF/Pangolin(Brunneretal.,1997)。当Wnt不存在时,β-catenin在细胞内被泛素化降解,Pangolin与下游靶标基因启动子上游的顺式调控元件结合,抑制靶标基因的表达;当Wnt信号被激活时,β-catenin在细胞内稳定,逐渐累积进入细胞核,与Pangolin结合,激活下游靶标基因的表达(Nusse and Clevers,2017),从而调控了果蝇的胚胎分化、组织生长、细胞凋亡和翅发育等过程(Oberhoferetal.,2014;Steinhart and Angers,2018;Songetal.,2019)。因此,Pangolin在Wnt/β-catenin信号通路传导过程中发挥了不可替代的关键作用。
家蚕Bombyxmori是鳞翅目昆虫研究的模式生物(Xiaetal.,2014),其基因组中包含多个Wnt基因(Dingetal.,2019)。研究发现,Wnt信号通路参与了家蚕体色塑造(Yamaguchietal.,2013)和胚胎发育(Zhangetal.,2015)。然而,关于家蚕Wnt/β-catenin通路下游关键基因Pangolin仍然知之甚少。本研究以家蚕为研究对象,从幼虫中肠和血淋巴克隆了Pangolin isoforms A/H/I/S基因转录剪接本(transcript variant)X3(PangolinX3),并对其进行了分析,为深入研究家蚕Pangolin的功能提供了支持。
1 材料与方法
1.1 实验昆虫
家蚕品种大造(Dazao)由西南大学生物学研究中心、家蚕基因组生物学国家重点实验室保存并提供。在温度25℃、相对湿度75%和光周期12L∶12D下,利用新鲜适龄桑叶饲喂家蚕,保证幼虫的自然生长发育。
1.2 Pangolin X3的克隆和序列分析
以Pangolin(GenBank登录号:101742450)同源异构体PangolinX3 (GenBank登录号:XM_038020921)为主要研究对象,从NCBI数据库检索其编码序列(coding sequence,CDS),利用Oligo 7.0软件(DBA Oligo,Colorado,美国)设计正向引物5′-GGATCCATGCCGCATGCTCACTCGAGTTCGG-3′和反向引物5′-GGGCCCCTACGAGACGGAGATGACCT CGTGC-3′,以家蚕5龄第3天中肠和血淋巴cDNA为模板,利用PCR进行克隆,反应体系(50 μL):正反向引物(10 μmol/L)各2 μL,模板2 μL,Q5聚合酶1 μL,Q5 Master Mix (2×) 25 μL,MiliQ H2O 18 μL。PCR反应程序:98℃ 30 s;98℃ 9 s,68℃ 30 s,72℃ 90 s,30个循环;最后72℃ 2 min。收集PCR产物,利用 Blunt-Zero试剂盒(Vazyme,南京)进行连接,然后转化大肠杆菌EscherichiacoliTrans1-T1感受态细胞(全式金,北京),经菌液PCR验证后送华大基因公司测序验证。利用SilkDB 3.0 (https:∥silkdb.bioinfotoolkits.net/main/ species-info/-1)分析PangolinX3 CDS、基因序列和染色体定位,SMART (http:∥smart.embl-heidelberg.de/)分析其结构域特征。
利用NCBI数据库在线工具检索不同昆虫的Pangolin蛋白序列。对于具有多个异构体形式的Pangolin,选择Pangolin isoform X3或与家蚕Pangolin X3序列高度相似的异构体。将家蚕B.mori的Pangolin X3与黑腹果蝇D.melanogaster、野蚕B.mandarina、棉铃虫Helicoverpaarmigera、斜纹夜蛾Spodopteralitura、小菜蛾Pierisrapae、大桦斑蝶Danausplexippus、偏瞳蔽眼蝶Bicyclusanynana、斑点木蝶Parargeaegeria和柑橘凤蝶Papilioxuthus的Pangolin异构体进行蛋白质多序列比对,然后利用ESPript 3.0 (https:∥espript.ibcp.fr/ESPript/cgi-bin/ ESPript.cgi)对结果进行渲染,最后利用MEGA X的邻接(neighbor-joining)法构建系统发育树,分析这些昆虫进化过程中的亲缘关系。
1.3 Pangolin X3基因表达的qRT-PCR分析
为研究PangolinX3在家蚕中的生物学功能,利用qRT-PCR分析家蚕5龄第3天幼虫不同组织中PangolinX3的表达。利用无RNA酶工具解剖5龄第3天家蚕,收集同一头幼虫的不同组织(头、血淋巴、体壁、性腺、中肠、前部丝腺、中部丝腺、后部丝腺、脂肪体和马氏管)样品,分别用PBS缓冲液清洗后置于1.5 mL无RNA酶离心管中,然后加入液氮研磨,利用RNAeasy动物RNA抽提试剂盒(碧云天,北京)分别提取不同组织的RNA。以提取的RNA为模板,利用碧云天BeyoRT Ⅱ cDNA第1链合成试剂盒合成cDNA。RNA提取和cDNA合成分别进行了3次生物学重复实验。以家蚕转录起始因子4A基因(SilkDB探针号sw22934)为内参基因,利用Oligo 7.0设计PangolinX3的引物(正向:5′-GGTTGTCGCCGAATGTA-3′;反向:5′-TTTGGAACC GTAACCGTAG-3′)和转录起始因子4A基因的引物(正向:5′-TTTGGAACCGTAACCGTAG-3′;反向:5′-CAAAGTTGATAGCAATTCCCT-3′)。由于Pangolin X3基因不同剪接体的碱基序列高度相似,我们设计的引物可以检测大部分的Pangolin转录剪接体(X1,X3,X4和X5),基本可以反映Pangolin在家蚕不同组织中的表达。PCR反应体系:正反向引物(10 μmol/L)各1 μL,不同组织cDNA模板2 μL,2×SYBR qPCR SuperMix Plus 10 μL (NovoStart) (Novoprotein,上海),RNase-Free H2O 6 μL。反应程序:95℃ 40 s;95℃ 10 s,60℃ 20 s,40个循环。每个反应重复3次,采用2-ΔΔCt相对定量法对数据进行分析。
1.4 数据分析
Pangolin在家蚕5龄第3 天幼虫不同组织中的相对表达水平以平均值±标准差来表示,利用GraphPad Prism 8.0 (GraphPad,SanDiego,Califormia,美国)软件绘制PangolinX3的相对表达水平柱状图,并采用Dunnett氏检验分析不同组织之间表达水平差异的显著性。
2 结果
2.1 Pangolin X3 CDS的克隆和序列特征
从家蚕幼虫中肠和血淋巴中PCR克隆获得大小约为1 500 bp 的DNA片段,经测序验证与PangolinX3(GenBank登录号:XM_038020921) CDS序列一致。结构域分析显示,Pangolin X3含有经典Wnt/β-catenin通路成员β-catenin的保守结合位点和TCF基因家族保守结构域HMG。PangolinX3定位于27号染色体,开放阅读框大小为1 560 bp,编码519个氨基酸残基,预测分子量为55.86 kD,预测等电点为7.53。
多序列比对分析显示,Pangolin X3的蛋白序列在不同的昆虫中比较保守,特别是与DNA结合的HMG结构域(家蚕Pangolin X3的第287-358位氨基酸残基)。此外,与β-catenin结合的N末端CTNNB1结构域(家蚕Pangolin X3的第13-199位氨基酸残基)也具有较高的保守性,部分氨基酸残基发生了变异(图1)。

图1 家蚕和其他昆虫Pangolin蛋白的多序列比对Fig.1 Multiple sequence alignment of Pangolin proteins of Bombyx mori and other insectsPangolin蛋白来源物种及GenBank登录号Origin species of Pangolin proteins and their GenBank accession numbers:黑腹果蝇Drosophila melanogaster,AFH06765;家蚕Bombyx mori,XP_037876849;野蚕B. mandarina,XP_028025555;棉铃虫Helicoverpa armigera,XP_021185146;斜纹夜蛾Spodoptera litura,XP_022834394;偏瞳蔽眼蝶Bicyclus anynana,XP_023954838;斑点木蝶Pararge aegeria,XP_039761328;大桦斑蝶Danaus plexippus,XP_032525001;小菜蛾Pieris rapae,XP_022123521;柑橘凤蝶Papilio xuthus,XP_013174768。红色阴影部分为Pangolin蛋白保守的氨基酸残基。The red shaded area highlights the conserved amino acid residues of Pangolin proteins.
系统发育树显示,家蚕与野蚕、棉铃虫和斜纹夜蛾、偏瞳蔽眼蝶和斑点木蝶Pangolin分别聚类为一支(图2),暗示了它们在进化上具有相似或相近的起源。相对而言,这些昆虫与黑腹果蝇Pangolin的距离较远(图2),暗示了它们在进化上的亲缘关系较远。
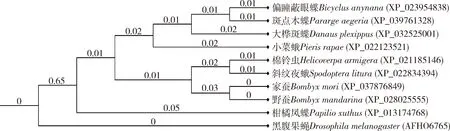
图2 邻接法构建的基于氨基酸序列的家蚕和其他昆虫的Pangolin蛋白的系统发育树(1 000次重复)Fig.2 Phylogenetic tree of Pangolin proteins of Bombyx mori and other insects by neighbor-joining method based on amino acid sequence (1 000 replicates)
2.2 Pangolin X3的表达特征
结果显示,PangolinX3在5龄第3 天家蚕幼虫中肠、血淋巴和性腺中的表达水平相对较高,在头、体壁、前部丝腺、中部丝腺、后部丝腺、脂肪体和马氏管中的表达水平相对较低(图3),暗示了Pangolin X3可能在家蚕中肠、血淋巴和性腺中发挥比较重要的生物学功能。
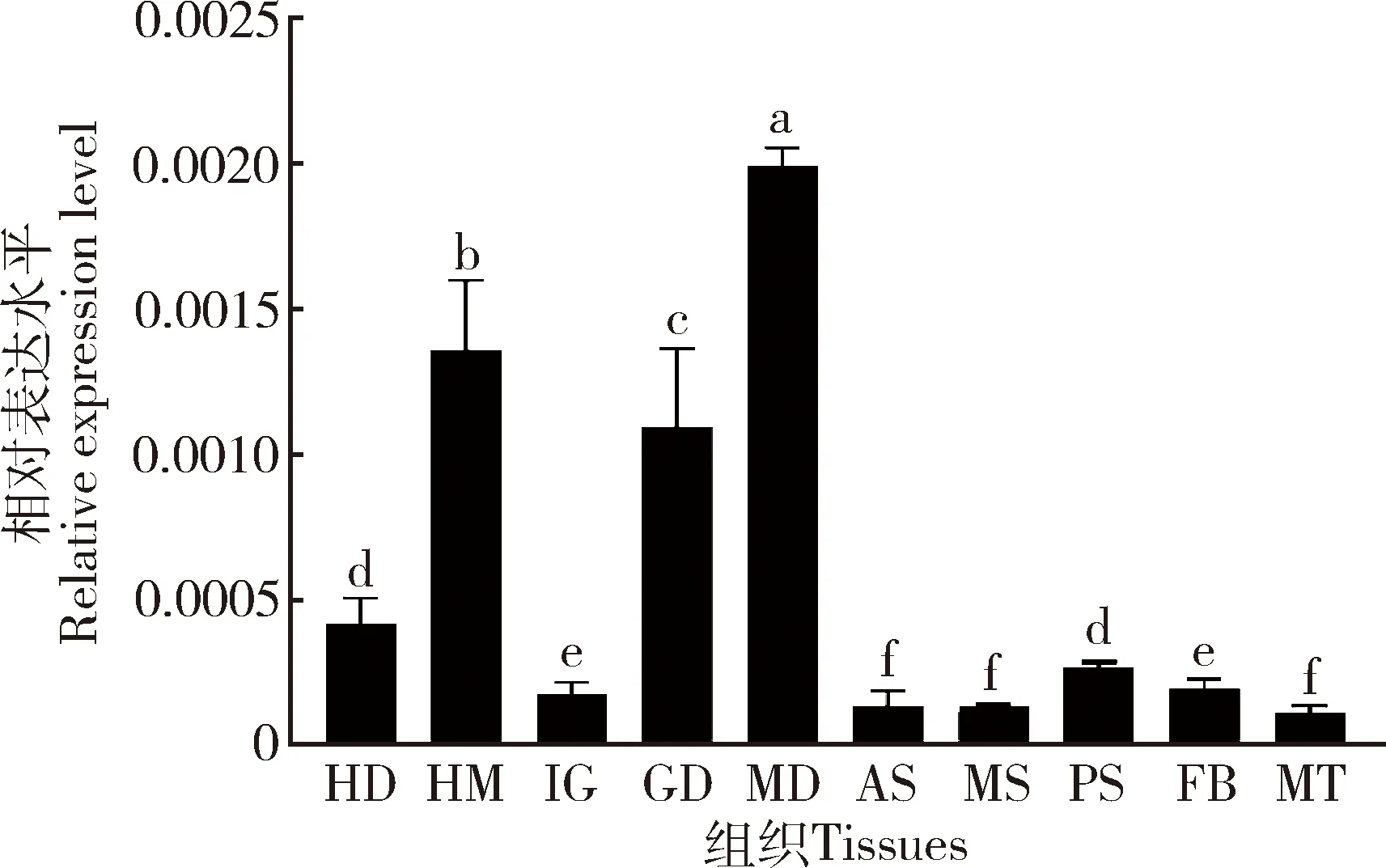
图3 Pangolin X3在家蚕5龄第3 天幼虫不同组织中的相对表达水平Fig.3 Relative expression levels of Pangolin X3 in different tissues of the day-3 5th instar larvae of Bombyx moriHD:头部Head;HM:血淋巴Hemolymph;IG:体壁Integument;GD:性腺Gonad;MD:中肠Midgut;AS:前部丝腺Anterior silk gland;MS:中部丝腺Middle silk gland;PS:后部丝腺Posterior silk gland;FB:脂肪体Fat body;MT:马氏管Malpighian tubules.图中数据为平均值±标准差;柱上不同小写字母表示差异显著(P<0.05,Dunnett氏检验)。Data in the figure are presented as mean±SD.Different small letters above bars indicate significant difference (P<0.05,Dunnett’s test).
3 讨论
Wnt/β-catenin信号通路在果蝇和哺乳动物中已经被广泛地研究,然而我们对昆虫Wnt/β-catenin通路关键的核内效应转录因子TCF/Pangolin仍然知之甚少。果蝇中只鉴定了1个Pangolin基因 (Brunneretal.,1997)。在本研究中,我们在NCBI数据库中检索发现家蚕基因组中包含6个Pangolin基因,然后根据PangolinX3的序列设计引物,从家蚕中肠和血淋巴cDNA中克隆了其CDS。蛋白序列比对显示,不同昆虫Pangolin蛋白的HMG结构域高度保守(图1)。HMG结构域主要负责与下游靶基因上游的顺式作用DNA元件结合。这一结果暗示了Pangolin调控的靶基因在不同的昆虫中可能都比较保守。相对而言,与β-catenin结合的N末端CTNNB1结构域的氨基酸出现了一定的变异,暗示了昆虫中β-catenin与Pangolin结合的多样性。丁鑫等发现昆虫中存在多个Wnt基因,如黑腹果蝇D.melanogaster和西方蜜蜂Apismellifera分别含有7个Wnt基因,家蚕B.mori含有8个Wnt基因,赤拟谷盗Triboliumcastaneum含有9个Wnt基因(Dingetal.,2019)。这一结果暗示了Wnt信号通路作用方式的多样性,与Pangolin N末端CTNNB1结构域氨基酸的变异性比较一致。
不同的Wnt基因在家蚕5龄第3天幼虫大多数组织中的表达水平相对较低,在头部、性腺、翅原基和神经系统中的表达水平相对较高(Dingetal.,2019)。本研究发现Pangolin在5龄第3 天幼虫的中肠、血淋巴和性腺中的表达水平相对较高,而在其他组织中的表达水平相对较低(图3)。作为Wnt/β-catenin信号通路下游的关键效应因子,Pangolin与Wnt基因在家蚕组织中的表达特征较为相似,这与其生物学功能基本保持一致。Wnt/β-catenin通路调控了果蝇和哺乳动物肠干细胞的自我更新,Axin上调表达促进果蝇中肠干细胞的分裂,下调表达则抑制了干细胞过度增殖(Gultekin and Steller,2019)。因此推测Pangolin在家蚕中肠的高水平表达可能与中肠发育和内环境稳态相关。
尽管我们对Pangolin在家蚕胚胎分化和生长发育等过程中的生物学功能仍然知之甚少,我们的结果为深入研究家蚕Pangolin基因的功能提供了基础。随着CRISPR-Cas9基因编辑、单细胞时空转录组等技术的出现和发展,未来有可能利用这些技术深入揭示家蚕Wnt/β-catenin信号通路的作用方式和Pangolin基因的功能。

