丙泊酚通过上调microRNA let-7i的表达诱导上皮性卵巢癌细胞凋亡的机制
尹艳超 李江伟 李蕊 刘斌 张晋
卵巢癌有三种主要类型:上皮细胞,间质细胞和生殖细胞[1];其中,上皮性卵巢癌(EOC)由卵巢表面上皮细胞构成,约占卵巢癌发病率的90%[2]。EOC是最常见的癌症之一,也是世界上致癌性恶性肿瘤死亡的主要原因。大多数患者接受的治疗包括手术、放疗和化疗,但整体来说,近5年患者的生存率较低[3]。微小RNA(miRNA)(20~24个核苷酸)转录后非编码RNA基因产物通过负调节其靶信息的稳定性或翻译效率来调节基因表达RNAs(mRNAs)[4]。当发现miRNA基因时,人们首次发现它可以调节白血病。随后的报告已经表明:miRNA在mRNA中差异表达许多癌症。miRNA现在被广泛认为在许多恶性肿瘤中扮演重要角色,充当其中任何一种肿瘤抑制因子或癌基因[5,6]。有研究分析了miRNA可能有助于EOC的启动和发展。据报道,microRNA let-7i经常参与EOC的调节[5]。研究者还发现一类micro RNA广泛存在于生物体中,它通过结合目标mRNA,转录后抑制相关蛋白的合成,参与表达[7]。在某些条件下,miR从细胞中通过微泡释放出来,核糖核蛋白转运复合物和脂蛋白在循环中非常稳定。研究表明,let-7i表达降低可显著增加卵巢癌细胞和对化疗药物顺泊的耐药性[8]。此外,let-7i表达减少与EOC患者的生存率低具有显著相关性[7]。本文中,我们通过miR介导的调控机制,研究上皮性卵巢癌增殖并诱导细胞凋亡,即通过竞争RNA靶标,研究miRNA串联或互补miR链对miR-let-7i调节的抗肿瘤作用。丙泊酚是广泛和常用的静脉麻醉药之一。有更多证据表明丙泊酚具有在体外和体内影响癌细胞运动、增殖和侵袭性的能力[9]。但是,没有关于抗肿瘤的可用信息证明丙泊酚在EOC细胞中的作用[10]。 目前的研究目标是评估丙泊酚影响人类EOC细胞和microRNA let-7i在这些细胞中的作用效果,报告如下。
1 材料与方法
1.1 细胞培养与试剂 人EOC细胞(OVCAR-3)购于中国科学院上海细胞生物学研究所。细胞在RPMI 1640中培养,后置于10%胎牛血清和100 U/ml青霉素和链霉素的5%CO2培养基中37℃进行培养。丙泊酚在二甲基亚砜中稀释用于体外测定。
1.2 培养基制备 添加2.5%胎牛血清、20%小牛血清和2.5%胎牛血清、20%小牛血清及BDNF(50 ng/ml、75 ng/ml 和100 ng/ml)以鼠尾胶原包被的 100 mm培养皿和孔板,在超净台内过夜,凉干备用。
1.3 细胞培养与分组 取OVCAR-3细胞:加80% DMEM液、10%胎牛血清、2 mg/L两性霉素B、10%小牛血清、100 U/ml青霉素、15 mmol/L Hepes及100 mg/L链霉素, pH值中性,计数后调整培养基量,使其细胞数达到1×105个/ml。置于5% CO2培养箱内37℃下培养2~3 d后更换一次培养液,每48~60小时传一代细胞,待细胞形成单层细胞后传代或在6孔板上接种,保持细胞的良好状态以备实验。待6孔板上细胞密度到80%时,加入含2.5%胎牛血清、20%小牛血清和BDNF(50 ng/ml、75 ng/ml和100 ng/ml)培养液,取分化后第3天的细胞用于实验。实验分组:(1)空白对照组;(2)卵巢癌细胞损伤组;(3)丙泊酚处理组;每组设置8个复孔。
1.4 Transwell法检测细胞数
1.4.1 将培养好的细胞去除血清,Matrigel过夜铺胶,4℃过夜存放。Transwell上室加入稀释后的Matrigel,37℃孵育2 h聚合成胶。胰酶消化,细胞计数,调整细胞密度至1×105/ml,取100 μ1加入到Transwel小室,500 μl完全培养基加入到Transwel下室,最后至于37℃,5%的CO2培养箱中培养2 d。
1.4.2 OVCAR-3细胞染色:用甲醛固定细胞20 min后,加入0.5%的结晶紫溶液作用15 min,显微镜拍照,计数,观察细胞数。
1.5 细胞生长和活力测定 将细胞以5×103个/孔的密度接种于96孔板中,培养皿中加入最终体积为180 μl的培养液在37℃、5%的二氧化碳培养箱中培养。在不同时间温育后,向每孔中加入20 μl的5 mg/ml MTT,之前使用1×PBS进行润洗。然后在37℃下孵育4 h。将样品溶于DMSO中,20 μl/孔中,并摇动15 min。在多重检测微板读数器上,570 nm的波长下测量每个孔的吸光度。
1.6 细胞凋亡检测 用丙泊酚处理细胞24 h后,收获细胞,洗涤,重悬于染色缓冲液中,并用试剂盒进行检测。通过FACSCalibur检测细胞染色情况,用CellQuest软件对数据进行分析。利用Annexin V和碘化丙啶(PI)检测细胞凋亡情况。
1.7 MicroRNA的提取和纯化 在没有(对照)或处理的情况下用丙泊酚处理约5×106个细胞,作用24 h。使用trizol试剂分离并纯化miRNA。miR-let-7i水平的测定通过实时荧光定量PCR,并用U6小核RNA作为内部归一化进行参考。RT-PCR是在实时定量系统中上进行,扩增条件为:95℃预变性10 min,94℃变性30 s,60℃退火/延伸1 min,进行40个循环;融解曲线分析为:94℃条件下进行15 s,60℃进行1 min、94℃进行15 s、60℃进行15 s,反应体系使用:Forward Primer(5 μmol/L)1 μl,Reverse Primer(5 μmol/L)1 μl,2×Gold Star Best Master Mix 10 μl,Template DNA 1 μl,RNase-Free Water 7 μl。见表1。

表1 RT-PCR引物序列设计
1.8 抗miR-let-7i转染 用100 nmol/L的抗miR-let-7i转染OVCAR-3细胞或使用siPort Neo-FX进行阴性对照。转染24 h后,丙泊酚处理组用丙泊酚处理细胞,其余不做任何处理。
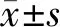
2 结果
2.1 3组细胞中细胞数比较 与空白对照组相比,卵巢癌细胞损伤组细胞侵袭能力显著提高(P<0.05);与卵巢癌细胞损伤组比较,丙泊酚处理组细胞侵袭能力显著减弱,差异有统计学意义(P<0.05)。见表2,图1。
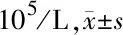
表2 3组细胞中细胞数比较

图1 OVCAR-3细胞染色(×100)情况
2.2 异丙酚对细胞增殖和凋亡的影响
2.2.1 丙泊酚对细胞增殖和凋亡的影响:OVCAR-3细胞系在不同浓度培养基中,加入丙泊酚后细胞增殖以MTT分析,丙泊酚以剂量和时间依赖性方式抑制OVCAR-3。丙泊酚浓度为20 μmol/L和40 μmol/L分别在48和72 h时抑制增殖(P<0.05)。见表3。
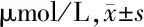
表3 异丙酚对细胞增殖和凋亡的影响
2.2.2 annexin V/PI分析:丙泊酚暴露24 h后,细胞凋亡分析也显示当浓度为20 μmol/L和40 μmol/L时,丙泊酚显著刺激细胞凋亡(P<0.05)。见表4。
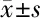
表4 细胞凋亡的测定
2.3 异丙酚刺激 miR-let-7i的表达 与空白对照组比较,卵巢癌细胞损伤组和丙泊酚处理组细胞表达降低,随着丙泊酚的加入,丙泊酚处理组表达显著提升(P<0.05),验证丙泊酚治疗效果显著上调miR-let-7i在OVCAR-3细胞中的表达呈剂量依赖性方式(P<0.05)。见表5,图2。
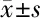
表5 异丙酚对OVCAR-3细胞基因的相对表达量
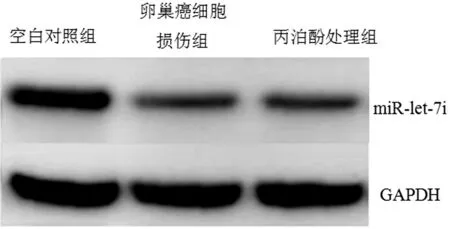
图2 OVCAR-3细胞基因表达情况
3 讨论
卵巢癌是一种常见的妇科恶性肿瘤,是造成女性癌症死亡的主要原因,主要是由于缺乏早期快速发现癌症的方法。现如今,虽然卵巢癌的诊断和治疗已取得很大的进展,但目前仍有许多尚未开发的领域,并且患者转移或复发性疾病的预后仍然不佳[11]。本研究表明异丙酚抑制了OVCAR-3细胞增殖和诱导细胞凋亡;异丙酚可以刺激miR-let-7i的表达,对OVCAR-3生长和作用的影响通过抗miR-let-7i转染逆转细胞凋亡。
异丙酚是最常用的静脉麻醉剂之一,具有顺滑和麻醉诱导和快速恢复的作用,除了镇静/催眠特性外,异丙酚具有神经保护的作用。它对神经细胞凋亡产生显著影响。异丙酚可通过不同的信号传导途径影响人类癌细胞侵袭的能力。异丙酚治疗显著降低了MMPs的表达,从而抑制了结肠癌的细胞侵袭活性[12]。异丙酚可有效抑制肝细胞生长,诱导肝癌细胞凋亡和miR-199a的调节可能有助于丙泊酚的抗肿瘤作用。临床相关实验证明,异丙酚浓度在(5.6~28 μmol/L)时显著降低了人癌细胞(HeLa、HT1080、HOS和RPMI-7951)的侵袭能力[13]。本研究中,在卵巢癌中,异丙酚通过人上皮性卵巢癌细胞OVCAR-3中的miR-let-7i表达抑制细胞增殖和表达。因此,异丙酚在癌症手术的围手术期中使用可能是特别合适的麻醉剂。
微小RNA(miRNA)参与了大多数生物过程,包括细胞周期调节,细胞生长,细胞凋亡,细胞分化等。更确切地说,miRNA可以调节致癌或肿瘤抑制途径[14]。miRNA广泛参与人体生长、分化、免疫应答及炎性反应等生理过程,是调控其他功能基因表达的重要物质,在生物体的生长发育过程中具有重要作用。
理解人体内的miRNA活性可以为人类治疗恶性肿瘤带来新疗法。microRNAs控制组织稳态和疾病的关键作用已得到广泛认可。通过控制其目标的表达水平,从而抑制肿瘤的发展和进展[15]。作为最早的肿瘤抑制之一,miR-let-7家族已被证实在各种类型的肿瘤中具有上调作用[16],对于miR-let-7i,在EOC中与顺泊的化疗敏感性和患者的生存相关。本研究发现异丙酚可以刺激miR-let-7在OVCAR-3细胞中的表达,抑制侵袭并促进细胞凋亡。与卵巢癌细胞损伤组细胞相比,丙泊酚侵染后,侵袭能力减弱;丙泊酚以剂量和时间依赖性方式抑制OVCAR-3细胞的增殖。细胞给药接触丙泊酚24 h后,OVCAR-3显示细胞凋亡,在丙泊酚浓度为20 μmol/L和40 μmol/L分别在48和72 h时显著抑制增殖;与空白对照组相比,卵巢癌细胞损伤组和丙泊酚处理组细胞中miR-let-7i基因表达显著上调,且丙泊酚处理组细胞中miR-let-7i在EOC中表达上调明显,miR-let-7i的表达增加,其呈现剂量依赖性方式;同时,丙泊酚可降低OVCAR-3中的蛋白表达。此外,抗miR-let-7i逆转异丙酚对细胞增殖和凋亡会影响OVCAR-3细胞,表明异丙酚通过调节miR-let-7i起作用。
综上所述,临床相关浓度的异丙酚抑制增殖并诱导EOC细胞凋亡和miR-let-7i的调节可能有助于其抗肿瘤作用。

