五味子乙素对大鼠急性心肌缺血损伤的保护作用
王媛 刘晟楠 马姣姣 郝娜 姜红 李立萍 张勤增 解丽君
缺血性心脏病是引起人类死亡的主要疾病,世界卫生组织(WHO)公布的数据显示,2015年缺血性心脏病死亡人数占全球死亡人数的15.5%[1]。氧化应激在心肌缺血损伤早期发挥着重要的作用,硫氧还蛋白相互作用蛋白(thioredoxin interaction protein,TXNIP)/硫氧还蛋白(thioredoxin,TRX)是机体内重要的抗氧化还原调节系统[2]。硫化氢(H2S)作为一种新型气体信号分子,在体内主要由L-半胱氨酸和同型半胱氨酸等为底物在胱硫醚-β-合酶(cystathionine-β-synthase, CBS)和胱硫醚-γ-裂解酶(cystathionine-γ-lyase, CSE)作用下生成。本实验室前期研究证实H2S/CSE体系参与了大鼠急性心肌缺血的病理生理过程,H2S供体可通过抗氧化应激,抑制心肌细胞凋亡减轻心肌缺血损伤[3,4]。五味子乙素是中药五味子的主要活性成分之一,具有抗氧化、抗癌、保肝等药理作用[5],还有研究报道五味子乙素可以减轻血管紧张素Ⅱ及高糖诱导的内皮细胞损伤[6]。本研究通过建立大鼠急性心肌缺血模型探讨Sch B对心肌缺血损伤的影响及机制。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠60只,体重(230±20)g,由北京华阜康生物科技股份有限公司供,许可证号:SCXK(京)2019-0008,适应性饲养大鼠1周。
1.2 实验仪器及试剂 五味子乙素(Schisandrin B)(上海融禾医药公司,200809,纯度:99.23%);2, 3, 5-氯化三苯基四氮唑(2,3,5-Triphenyltetrazolium Chloride,TTC)(Sigma,T8877-25G);TXNIP兔单克隆抗体(华安生物,ET1705-72);TRX兔多克隆抗体(Proteintech,14999-1-AP);NOX-4兔单克隆抗体(Abcam,ab13303);Caspase-3兔多克隆抗体(Proteintech,19677-1-AP);LPO、GSH、考马斯亮兰法蛋白测试盒(南京建成,批号:A106-1-2,A006-2-1,A045-2-2);硫氧还蛋白还原酶(TrxR)活性检测试剂盒(索莱宝,BC1155);硫化氢(H2S)含量检测试剂盒(索莱宝,BC2055);通用SP试剂盒(中杉金桥,SP-9000);Powerlab8/s多通道生理记录仪(ADInstruments公司);垂直电泳仪、转移电泳仪以及转移电泳槽(Bio-Rad公司);全波长酶标仪(BioTek公司);全自动显微照相系统(Leica公司)。
1.3 方法
1.3.1 动物分组:大鼠采用随机数字表法分为5组(n=12):对照组(C组),心肌缺血模型组(M组),五味子乙素低剂量组(Sch B 20 mg·kg-1·d-1,M + L Sch B组)、中剂量组(Sch B 40 mg·kg-1·d-1,M + M Sch B组)和高剂量组(Sch B 80 mg·kg-1·d-1,M + H Sch B组)。适应性饲养1周,给药组大鼠分别给予1%羧甲基纤维素钠与相应剂量Sch B制成的混悬液,对照组和模型组2组均给予1%羧甲基纤维素钠,10 ml/kg,1次/d,连续14 d。
1.3.2 大鼠心肌缺血模型建立:末次给药2 h后1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉大鼠,记录标准Ⅱ导联心电图;无创气管插管,呼吸机调节为RR 40~60次/min,VT10~12 ml。左侧三四肋间开胸,分离心包膜,暴露心脏。6~0带针缝合线结扎左冠状动脉前降支,以心脏左前壁呈紫绀或Ⅱ导联S-T段弓背向上抬高>0.15 mV并持续>0.5 h为结扎成功标志,3 h后处死大鼠,对照组只穿线不结扎。
1.3.3 大鼠血流动力学指标:5组大鼠于缺血末右颈总动脉插管,Powerlab/8s生理记录仪记录平均动脉压(MAP)、左心室收缩压(LVSP)、左心室舒张末压(LVEDP)、左心室内压上升/下降的最大速率(±dp/dtmax),计算左心室发展压(LVDP=LVSP-LVEDP)。
1.3.4 血清中H2S含量:大鼠腹主动脉取血,取血清,酶标仪测定波长665 nm,测各样品吸光度计算含量。
1.3.5 心肌组织CSE的活性:心肌组织称重,按1∶10加入50 mmol/L磷酸钾缓冲液(pH值=6.8)匀浆,4℃、4 000 r/min离心10 min,取上清备用。25 ml锥形瓶中央体积为1 cm3的中央室中,加入0.1 ml心肌组织匀浆和0.9 ml反应液(含100 mmol/L磷酸钾缓冲液、10 mmol/L L-半胱氨酸、2 mmol/L 15’-磷酸吡多醛,pH值7.4)。37℃恒温摇床孵育90 min后向反应体系中加入0.5 ml 50%三氯醋酸终止反应。中央室内容物转移到试管中,加入3.6 ml蒸馏水、0.5 ml 7.2 mol/L盐酸(含20 mmol/L N,N-二甲基-对苯二胺硫酸盐)和0.4 ml 1.2 mol/L盐酸(含30 mmol/L三氯化铁),混匀,室温静置20 min,波长665 nm测吸光度。根据NaHS标准曲线计算溶液中H2S的含量,组织中CSE活性以每毫克组织在单位时间内生成H2S的量表示,单位为nmol·min-1·mg-1。
1.3.6 心肌组织中LPO、GSH含量:实验末取左心室前壁心肌组织,按试剂盒说明书操作,酶标仪(测定波长分别为586、420 nm),测得吸光度计算含量。
1.3.7 心肌组织中TrxR活性:实验末取左心室前壁心肌组织,剪碎,每0.1克加入1 ml提取液冰上研磨,10 000 r/min,4℃离心10 min,取上清,酶标仪调节波长至412 nm,按每个样本每分钟生成1 nmol TNB为1个酶活力单位,测定样本5 min内的TrxR活力。
1.3.8 大鼠心肌梗死面积:实验末摘取大鼠心脏,-80℃速冻5 min,切片,采用1% TTC 37℃避光温浴染色20 min,拍照, ImageJ软件计算切片梗死面积。
1.3.9 大鼠心肌组织形态学观察:取心肌组织常规固定,石蜡包埋,切片,苏木精-伊红(HE)染色,于光学显微镜下(×200)观察。
1.3.10 透射电镜观察心肌组织的形态学变化:取心尖部组织,冰台上切成1 mm×1 mm×1 mm小块,4%戊二醛固定,环氧树脂浸透,包埋,超薄切片,醋酸铀-枸橼酸铅染色,透射电镜观察心肌超微结构的变化。
1.3.11 免疫组织化学染色方法观察TXNIP、TRX、Caspase-3表达:心肌组织石蜡切片,按照SP9000试剂盒说明书操作,一抗的稀释倍数分别为:TXNIP(1∶100)、TRX(1∶100)、Caspase-3(1∶100),DAB显色,脱水,透明,中性树胶封片,显微镜下观察。
1.3.12 Western blotting法检测心肌组织中TXNIP、TRX、Caspase-3、NOX-4表达:心尖组织提取蛋白,SDS-PAGE电泳,转PVDF膜,封闭,分别加入一抗TXNIP(1∶3 500)、TRX(1∶3 000)、Caspase-3(1∶2 000)、NOX-4(1∶2 000),4℃摇床过夜。加入二抗(1∶5 000)室温孵育2 h,ECL发光液显色,Image J软件分析。以目的蛋白条带灰度值比β-actin条带灰度值计算。
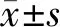
2 结果
2.1 大鼠血流动力学指标测定 与C组相比,M组大鼠心功能指标MAP、LVDP、±dp/dtmax均明显降低,LVEDP明显升高(P<0.01)。与M组相比,SchB中、高剂量组大鼠心功能指标MAP、LVDP、±dp/dtmax明显升高,LVEDP明显降低(P<0.05)。见表1。
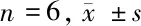
表1 SchB对心肌缺血大鼠心功能的影响
2.2 大鼠血清中H2S含量的测定和心肌组织中CSE活性的变化 与C组相比,M组血清中H2S含量和心肌组织CSE活性降低(P<0.01),与M组相比,Sch B各组大鼠血清中H2S含量和心肌组织CSE活性增加(P<0.05或P<0.01)。见表2。
2.3 大鼠心肌组织中LPO和GSH含量测定 与C组相比,M组大鼠心肌组织中LPO含量明显增加(P<0.01)、GSH含量减少(P<0.01); 与M组相比,Sch B各组大鼠心肌组织中LPO含量明显减少(P<0.01),GSH含量明显增加(P<0.05)。见表2。
2.4 大鼠心肌组织中TrxR的活性的测定 与C组相比,M组大鼠心肌组织中TrxR的活性明显降低(P<0.01),与M组相比,Sch B各组大鼠心肌组织中TrxR的活性明显升高(P<0.05或<0.01)。见表2。
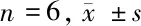
表2 Sch B对大鼠心肌组织中H2S、CSE、GSH、LPO及TRX含量的影响
2.5 大鼠心肌梗死面积的测定 TTC染色后,梗死区显示为白色,非梗死区显示为红色。与C组相比,M组和Sch B各组心肌梗死面积均明显增加(P<0.05),与M组相比,Sch B各组不同剂量给药后心肌梗死面积逐渐减少(P<0.05)。见表3,图1。
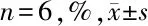
表3 5组大鼠的心肌梗死面积

图1 5组大鼠的心肌梗死面积
2.6 大鼠心肌组织病理学改变 C组心肌组织未见异常,心肌细胞排列整齐,形态正常,M组大鼠心肌缺血后,心肌细胞水肿,肌原纤维松弛断裂,有大量心肌细胞坏死,坏死处由炎性细胞浸润填充。而SchB各剂量组给药后心肌组织改变显著减轻。见图2。
2.7 透射电镜观察心肌组织的形态学变化 C组大鼠心肌纤维排列整齐,线粒体嵴和膜完整,核周隙稍扩张。M组大鼠心肌纤维排列紊乱,核质和核周高度水肿,核膜局部消失;线粒体嵴和膜严重肿胀变形,溶解,消失。与M组相比,Sch B各剂量组大鼠心肌损伤明显减轻,尤其是M+H Sch B组,肌纤维排列稍紊乱,线粒体基质轻微水肿。见图2。
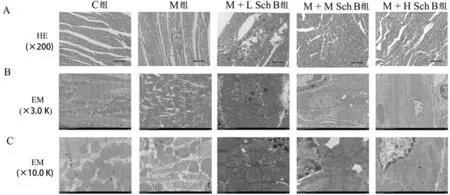
图2 Sch B对I/R大鼠心肌组织形态学改变的影响;A 缺血3 h后心肌组织HE染色(×200);B 缺血3 h后心肌组织的电镜观察(×30 000);C 缺血3 h后心肌组织的电镜观察(×10 000)
2.8 免疫组化和Western blotting法检测各组蛋白表达变化 与C组相比,M组大鼠心肌组织中TXNIP、Caspase-3、NOX-4蛋白表达水平增加,TRX蛋白表达水平下降(P<0.01),与M组相比,Sch B中、高剂量组,TXNIP、Caspase-3、NOX-4蛋白表达水平降低,TRX蛋白表达水平升高(P<0.05)。见表4,图3、4。
表4 Sch B对大鼠心肌组织中TXNIP、Caspase-3、NOX-4、TRX表达的影响
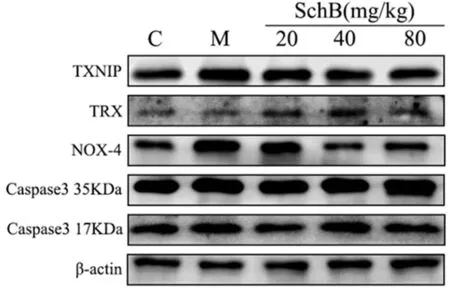
图3 免疫印迹检测TXNIP、Caspase-3、NOX-4、TRX蛋白表达变化
3 讨论
缺血性心脏病是心血管疾病患者的重要死因[3,4]。氧化应激和凋亡被认为是心肌缺血重要的发病机制,氧自由基(oxygen free radical,OFR)介导的脂质过氧化物过度激活是造成心肌缺血损伤的关键因素。氧化应激发生时,血管壁产生过量的活性氧,OFR大量释放,引发链式脂质过氧化反应,损伤细胞膜、细胞器乃至细胞核酸,导致细胞凋亡、坏死,从而造成心肌细胞急性或慢性损伤[7]。机体内存在复杂的氧化还原调节网络,TRX一种巯基抗氧化蛋白,具有直接清除自由基和氧化还原功能。TXNIP是TRX的内源性抑制剂, 通过与TRX 的结合与解离调节机体的氧化应激,TXNIP/TRX是机体内重要的抗氧化还原调节系统,参与多种细胞或器官的保护[2]。心肌缺血时,活性氧生成和抗氧化防御系统之间存在不平衡,氧化应激发生,导致信号转导级联的激活和细胞凋亡的启动[8,9]。
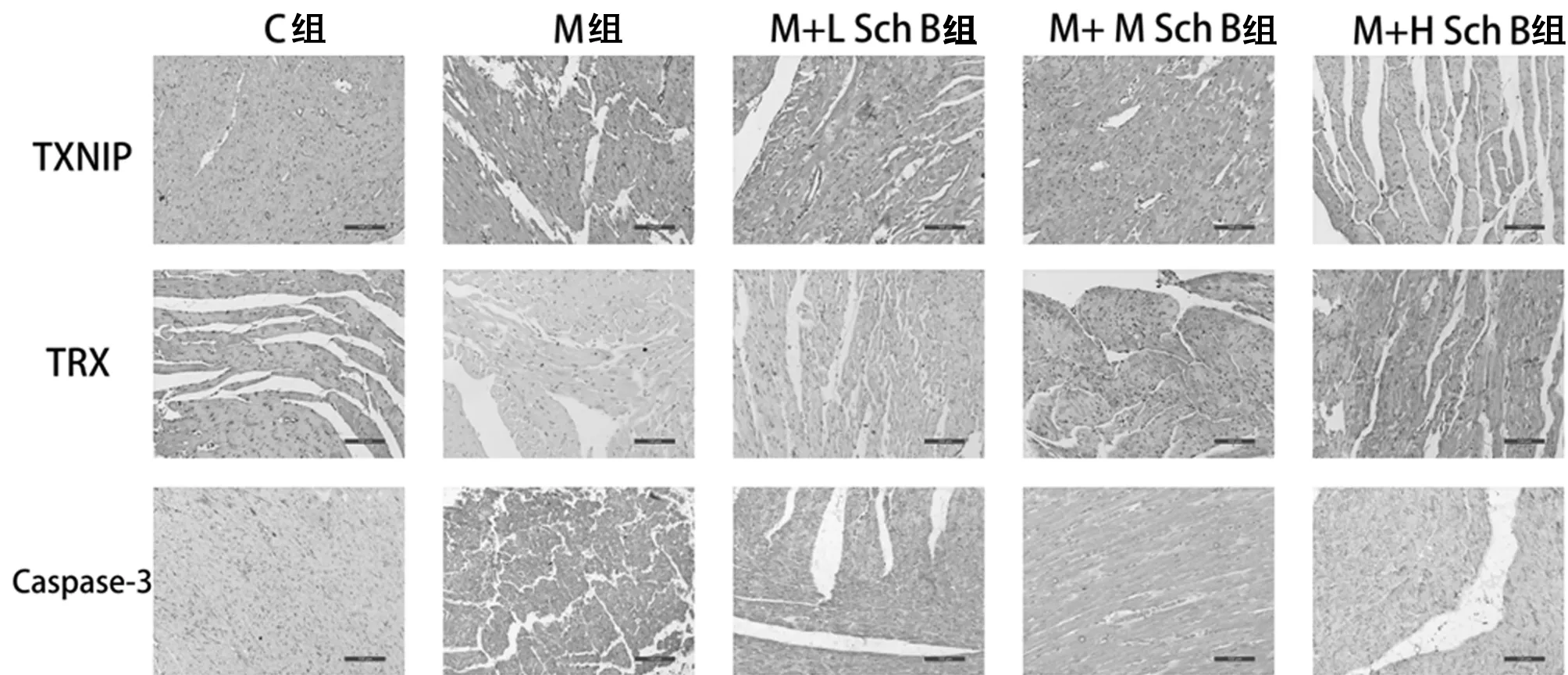
图4 免疫组化法检测TXNIP、TRX、Caspase-3在心肌组织中的表达(免疫组化×200)
H2S在神经、心血管、免疫等多个系统发挥着重要的生理和病生理调节作用。CSE主要分布在心脏和血管平滑肌组织[10]。本研究室前期研究表明内源性H2S参与了急性心肌缺血的病理生理过程,H2S后处理可以减轻脂质过氧化反应,抑制心肌细胞凋亡,从而减轻保护缺血心肌。关于H2S与TXNIP/TRX、MAO等研究表明内源性H2S可以调节TXNIP/TRX系统,促进TRX与TXNIP解离,提高细胞抗氧化损伤能力,保护肾脏足细胞免于阿霉素所致损伤[11]。在肝细胞,抑制H2S产生的酶CSE活性可以使TRX活性降低,促进TXNIP/TRX的相互作用从而加速细胞的死亡[12]。说明H2S抗氧化活性的发挥与TXNIP/TRX系统密切相关。
五味子乙素是从五味子中提纯出来的活性单体二苯并环十八二烯木聚糖,研究表明五味子乙素在体内外具有抗氧化、抗凋亡、抗炎等活性[13,14]。本研究通过建立急性心肌缺血模型给予不同剂量五味子乙素干预,观察五味子乙素的抗氧化作用以及对内源性H2S和TXNIP/TRX系统的的影响,进一步明确五味子乙素的心肌保护机制。
本结果表明,大鼠心肌缺血时给予40、80 mg/kg的Sch B干预,能够改善大鼠心脏功能,降低心肌梗死面积,减轻心肌组织的形态学损伤。本研究结果还显示给予Sch B预处理可以增加心肌组织中CSE酶的活性和血清中H2S的含量,同时维持了心肌缺血大鼠心肌GSH的水平并减少了LPO的过度累积,下调心肌组织中TXNIP蛋白的表达以及上调TRX蛋白的表达,抑制活性氧生成酶NOX-4及细胞凋亡效应分子和执行者Caspase-3的表达,从而减轻了心肌缺血诱导的氧化应激反应和细胞凋亡,发挥心肌保护作用。

