PRKAA1/AMPKα1在消化系肿瘤中的研究进展
雍桃, 刘杰, 魏秋亚, 樊勇
在我国,消化道肿瘤高发且预后较差。据国家癌症中心2022年2月发布的最新全国癌症统计数据[1]显示:结肠癌、胃癌、肝癌在我国最常见的癌症中分别排名第二、第三、第四。其中,肝癌、胃癌、结直肠癌、食管癌的死亡率排名仅次于肺癌。手术治疗加化疗为消化道肿瘤的首选治疗方式。但对于肿瘤晚期的患者来说,传统治疗方式效果欠佳。目前,肿瘤发生发展的机制尚未完全研究清楚,因此,寻找新型分子标志物、推动抗癌创新药物的发展,将有利于降低国家未来的癌症负担,护卫人民健康。近年来的研究发现,PRKAA1参与人体恶性肿瘤的发生发展的多种生物过程。本文就PRKAA1基因的结构及其在消化道肿瘤中的相关研究进行综述。
1 PRKAA1基因的结构
PRKAA1基因编码的蛋白属于丝氨酸/苏氨酸蛋白激酶家族,它是5′-prime-AMP-activated protein kinase(AMPK)的一个催化亚基。AMPK是一种细胞能量状态的感应器,几乎在所有真核细胞中都有表达。它是一个复杂的三聚体复合物(图1),由一个催化亚基α和两个调节亚基β以及γ组成。其中α亚基由一个激酶结构域和被上游激酶激活的调节性T环残基172(Thr172)组成;β亚基上存在糖原结合域(glycogen binding domain,GBD),只有β亚基与糖原(Glycogen,图1中简称Gn)结合,且与α和γ亚基共同表达的情况下,AMPK才成为正常的具有调节活性的复合物,因此,β亚基被称为AMPK异三聚体形成的支架;另外由于γ亚基上存在4个串联的胱硫氨酸-β合酶(cystathionine beta-synthase,CBS)结构域,可以结合腺嘌呤核苷酸,因此它主要感知微环境中(adenosine mono phosphate,AMP)与(adenosine triphosphate,ATP)比率的变化[2]。在人类中,发现有2个α催化亚基,分别是由PRKAA1和PRKAA2基因编码的α1和α2亚基,其中PRKAA2主要存在于肝脏、肌肉、下丘脑等主要代谢器官、组织中;而PRKAA1是在血管细胞和白细胞中发现的催化亚型[3];有2个β调节亚基,即PRKAB1和PRKAB2基因编码的β1和β2;有3个γ亚基,分别由PRKAC1、PRKAC2、PRKAC3基因编码的γ1、γ2、γ3。AMPK作为细胞能量感受器,能感受细胞内AMP浓度及AMP/ATP比值的变化。当细胞能量缺乏时,细胞内AMP/ATP比值上升,导致AMPK表达上调,进而通过一系列复杂而又精细的调节机制最终使能量代谢恢复平衡。研究发现,在低能量状态下,AMPK通过PRKAA1基因激酶结构域Thr172亚基的磷酸化来完成自身的活化。高糖刺激则主要通过活性氧(reactive oxygen species,ROS)依赖性AKT(又称PKB)使AMPKa在S485/491位点磷酸化,从而完成AMPKα随后的泛素化和降解[4]。
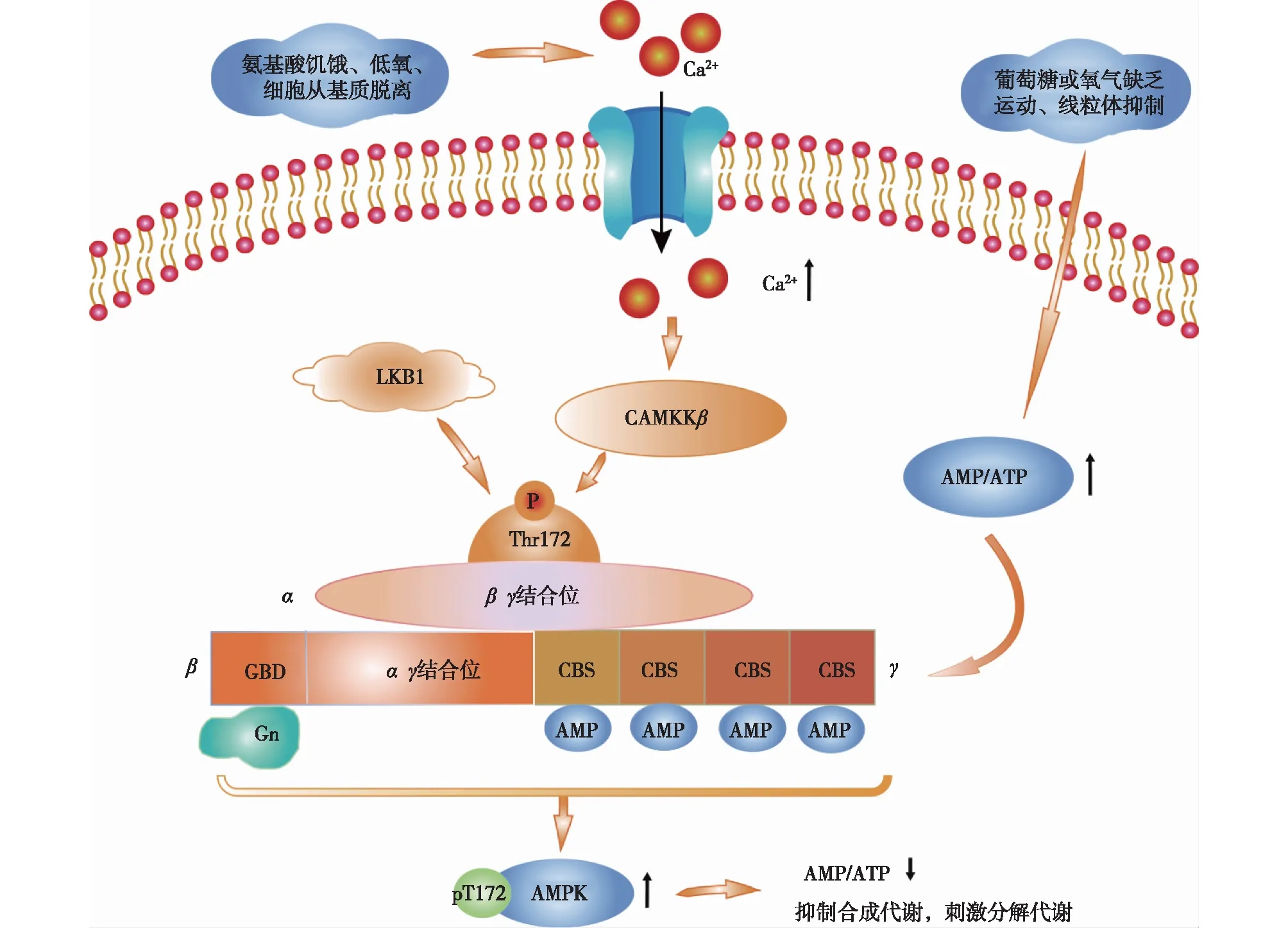
图1 AMPK三聚体复合物及其部分激活过程 AMPK是由催化亚基α以及调节亚基β、γ组成的三聚体,AMPK的激活主要依赖于其上游激酶(liver kinase B1,LKB1) 肝激酶B1 和(calcium-calmodulin-dependent protein kinase kinase,CAMKK2) 钙调蛋白依赖性蛋白激酶激酶2的激活,它们是通过AMPKα亚基Thr172位点的磷酸化来激活AMPK,此外,AMP/ATP比值降低会通过影响AMPKγ亚基激活AMPK,进而调节代谢来恢复能量平衡
2 PRKAA1在消化系肿瘤中的研究
PRKAA1作为能量感受器AMPK的一个亚基,我们好奇它在肿瘤发生发展过程中的作用是否也与能量代谢息息相关。首先,我们从GEPIA2数据库[5]中得知PRKAA1在消化道肿瘤中呈差异表达(图2),但具体的作用机制尚不完善。本文整理了现有消化道肿瘤的研究中PRKAA1具体是如何参与肿瘤的发生、发展。
现有研究表明,PRKAA1具体作用与所处的特定环境条件有关。在营养物质比较充足的情况下,PRKAA1基因表达量较高时肿瘤细胞的增殖和生长代谢受限。这使得PRKAA1表现出“抑肿瘤”的一面;例如Wu等[6]发现二甲双胍可通过上调磷酸化AMPKα诱导细胞G1周期阻滞而抑制膀胱癌细胞增殖。Jones等[7]也发现在营养限制的条件下,PRKAA1的激活可导致G1期细胞周期阻滞,进而通过P53轴影响细胞增殖。
另一方面,基因毒性损伤会通过Ca(2+)/CaMKK2信号通路激活细胞核中的AMPKα1亚型,以提高肿瘤细胞的生存。当细胞营养受限时,PRKAA1基因呈高表达反而可以保护细胞免于死亡,它可以促进细胞对低能量状态的适应;如Jeon等[8]的研究指出,将细胞内ATP水平降低至一定水平的能量应激条件下,AMPK激活,PRKAA1基因表达量增加,可促进肺癌细胞的增殖。Xu等[9]也发现黄芪甲苷可通过抑制AMPKα的活化从而降低肺癌的生长、侵袭、迁移和血管生成,但该研究并未指明肺癌细胞此时所处的能量状态。An等[10]在调节性T细胞(Treg细胞)中进行的一项研究指出:AMPKα1的激活通过维持肿瘤浸润Treg细胞中FOXP3的稳定性来促进肿瘤的生长,因此在Treg细胞中选择性抑制PRKAA1可能是一种有效的抗肿瘤治疗方法。另外肝脏损伤和能量剥夺也可以通过激活AMPKα1来增强肿瘤炎症,进而促进肿瘤的发生发展[11]。大量的研究数据表明PRKAA1在肿瘤中发挥的作用远比我们想象中要复杂。
2.1 食管癌(esophageal squamous cell carcinoma,ESCC) 食管鳞状细胞癌是ESCC中公认的一种侵袭性恶性肿瘤。PRKAA1在ESCC组织和细胞中的表达量明显高于正常组织和细胞。从现有的研究看来,PRKAA1在ESCC中主要发挥促癌基因相关作用;例如He 等[12]发现LINC00473通过抑制miR-497-5p/PRKAA1轴来抑制ESCC细胞的增殖、迁移和上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程。Lu等[13]也通过实验验证了香橼激酶(citron kinase,CIT)通过上调PRKAA1基因的表达来促进ESCC细胞的增殖。PRKAA1有着保守的磷酸化区域,其功能比较稳定,可进一步提高肿瘤细胞的生存能力,促进其抗凋亡能力,因此可以在ESCC细胞的增殖、生长以及分化的信号通路方面发挥重要作用。这也将有很大可能成为ESCC一种新的治疗方向。
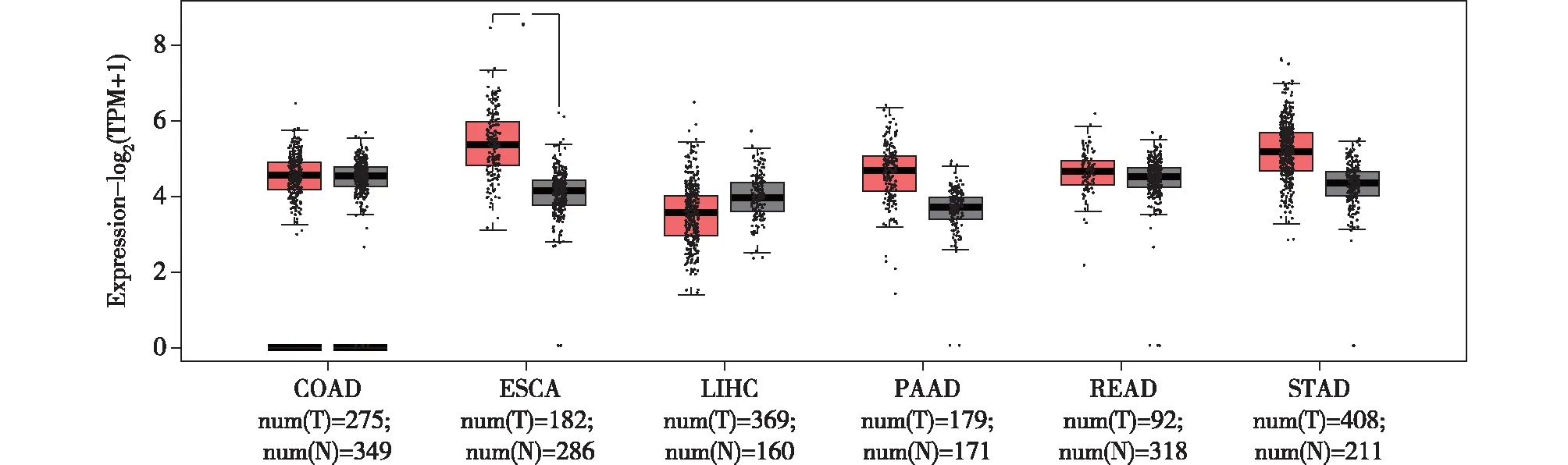
图2 GEPIA数据库中PRKAA1在消化道恶性肿瘤中的差异表达 红色为肿瘤标本,黑色为正常标本从GEPIA数据库中获取的PRKAA1基因在消化道肿瘤中的表达提示,PRKAA1基因在消化道各肿瘤中呈差异表达,其中在食管癌中差异最明显(P<0.05)
2.2 胃癌(gastric cancer,GC) 目前,遗传变异已经被广泛证明与GC发生风险相关,尤其是涉及信号转导途径的多态性。有一项病例对照研究[14]指出:PRKAA1基因多态性rs13361707CC、rs10074991GG、rs461404GG、rs154268CC与GC风险增加相关。但是该研究样本量太小,且都是基于已发现多态性潜在功能的研究,缺乏与单倍分析的关联评估。此外,PRKAA1被发现通过多种信号通路参与GC的发生发展。在缺氧条件下,环状RNA(circRNAs)通过miR-873-5p/PRKAA1轴,促进GC细胞的增殖、迁移、侵袭和糖酵解[15]。Zhang等[16]的实验结果表明NF-jBp50-PRKAA1信号通路的激活促进了GC细胞侵袭和迁移。Kun等[17]认为胃泌素可以诱导PRKAA1基因在GC细胞中表达,从而增加GC细胞的自噬和增殖。但是Yan等[18]进行的基于全基因组关联研究和功能分析的Meta分析却指出,使用siRNA来抑制PRKAA1在BGC823和SGC7901细胞中的表达后,细胞的增殖、迁移等恶性表型被促进。可见PRKAA1在GC中机制的研究仍存在争议。
2.3 结直肠癌(colorectal cancer,CRC) 根据世界卫生组织国际癌症研究机构(IARC)在2020年发布的数据表明,CRC已成为仅次于肺癌的全球第二大癌症。癌胚抗原(carcinoembryonic antigen,CEA)和糖类蛋白199(CA19-9)虽然是最早应用于CRC诊断的血清标志物,但其敏感性和特异性不强,无法成为有效的筛查指标。因此CRC早期诊断标志物的探索仍然相当重要。PRKAA1在结肠癌(colorectal cancer,CRC)中高表达,且这种高表达状态与生存期差息息相关。长链非编码RNA是重要的癌症调控因子,Liang等[19]报道在CRC细胞中,LINC01315通过调控miR-205-3p的表达进而上调miR-205-3p的靶基因PRKAA1的表达,促进细胞的生长及侵袭。Wang等[20]报道了PRKAA1在应激条件下具有维持高水平的还原性谷胱甘肽从而来维持还原氧化反应稳态的功能,这一功能促进了体外代谢应激下细胞的生存,可能会导致疾病复发和预后不良,因此他们认为PRKAA1基因可作为预后的一个预测因子。
2.4 胰腺癌(pancreatic cancer,PC) PC是消化道常见的肿瘤,也是消化道恶性程度最高的肿瘤,其进展迅速,但起病隐匿,早期症状不典型,因此迫切需要新的早期诊断标志物以及治疗手段。RNA测序结果显示PRKAA1在正常胰腺中表达量很低,但在PC组织中呈明显高表达。Kato等[21]在人PC细胞株PANC-1和ASPC-1中进行的AMPKα干扰实验证明:干扰AMPK的反义RNA可抑制PC细胞在裸鼠体内的生长,并提出AMPK可作为抑制肿瘤生长和侵袭治疗策略的靶点。Zhao等[22]也发现,miR-148b通过靶向AMPKα1抑制PC的增殖和迁徙,并能增强化疗的敏感性。这两项研究均表明在PC中PRKAA1基因表现出癌基因的特性。但是Ye等[23]在探索Isoorientin通过AMPK信号通路在PC中抗肿瘤特性的过程中检测到了PRKAA1的抗肿瘤活性,并指出肿瘤抑制因子TSC2和p53是AMPK的下游靶点。这与前两项研究中PRKAA1基因在PC中的促癌作用结果不一致。但同时也不排除其与其他信号通路之间的复杂联系的影响。由于PRKAA1的激活会促进PC的进展和转移,因此开发针对AMPK激活引起的癌症的特定AMPK抑制剂将非常重要。
2.5 肝癌(hepatic carcinoma,HCC) HCC是消化道最常见的恶性肿瘤之一,其死亡率在男性中占第五位,女性中占第七位[24]。尽管近几年在治疗方法上有了很大的进步,但临床上仍出现较多的术后复发和肝内/肝外转移,这是HCC患者预后不良的原因之一[25-26]。在肿瘤形成的最初阶段,癌细胞经常经历缺氧而导致营养物质受限的环境。自噬作为适应机制被激活[27-28]。Kwon等[29]研究发现:半胱天冬素可通过调控(silent information regulator 1,SIRT1)/PRKAA1,进而通过衰老介导的自噬受损导致HCC细胞死亡,发挥抗肿瘤作用。但自噬与肿瘤进展和癌症治疗存在复杂的矛盾关系,自噬到底能否成为肿瘤的治疗靶点还有待进一步研究。
3 PRKAA1的应用
目前,研究人员已经研发出多种不同化学结构和作用范围的AMPK激活剂和抑制剂用于临床前研究。仅作用于AMPKα亚基的抑制剂和激活剂见表1。除了已知的激活剂如5-Aminoimidazole-4-carboxamide1-β-D-ribofuranoside(AICAR)、A-76966等外,越来越多的活性天然产物从植物界被发现,许多有效的AMPK激活剂来自传统草药。AICAR、糖尿病一线用药二甲双胍以及阿司匹林均可作为AMPK的激活剂,已经被证实至少部分通过AMPK信号通路发挥其抗肿瘤特性[30-31]。在众多现有的抑制剂中,大多为非特异性,可以同时靶向其他很多分子,因此迫切需要新的方法协助研制高特异性的PRKAA1抑制剂,以助于更好服务于肿瘤相关研究。

表1 部分靶向AMPKα亚基的抑制剂和激活剂
4 小结
消化系统肿瘤发病率和死亡率呈逐年上升的趋势,严重影响着人们身体健康。虽然传统治疗方式如手术切除、放疗、化疗等都取得了很大进展。但效果仍不理想,因此寻找早期诊断标志物,筛选新的靶标是我们急需攻克的难题。就消化道肿瘤而言,在ESCC、HCC、CRC中已证实PRKAA1的高表达会促进肿瘤细胞增殖、侵袭和迁移。由于PRKAA1对消化道肿瘤的促进作用,抑制PRKAA1的药物备受关注。遗憾的是,目前尚没有靶向PRKAA1的药物。PRKAA1不仅仅参与消化道肿瘤的发生发展,还可以作为判断肿瘤预后情况的指标。然而未来还需要通过更深入的研究,来探索PRKAA1与恶性肿瘤发生发展之间的关系,并开发靶向于PRKAA1的相关药物,进而通过改变肿瘤细胞周期、抑制肿瘤细胞抗凋亡能力、降低肿瘤耐药性等方法来减缓甚至抑制肿瘤生长,最终实现治疗消化道恶性肿瘤的目的。
从理论来看,癌症晚期肿瘤细胞竞争营养与空间,细胞能量缺乏则PRKAA1激活,从而有利于肿瘤细胞的存活。但现有的研究认为PRKAA1既有促癌一面,亦有抑癌一面,PRKAA1在各种肿瘤中具体如何发挥作用,是癌症初期机体营养尚充足时发挥抑癌作用,还是癌症晚期营养缺乏时发挥促癌作用?我们考虑PRKAA1可能会通过调节癌细胞的生长速率来匹配它们的能量供应,并促进基因组的稳定性,从而支持癌细胞的生存。PRKAA1发挥作用时,AMPK其他亚基如α2、β、γ等对PRKAA1的影响如何?因此,在这方面进一步的研究和探讨,将为肿瘤的靶向治疗提供新的靶标和新途径,为肿瘤患者带来新的希望。

