影响Ⅱ、Ⅲ期结直肠癌术后复发或转移的临床因素分析
王远飚, 董坚, 李慧, 马继龙, 张琪鹏, 张锦平, 陈艳
结直肠癌(colorectal cancer, CRC)是全球癌症相关死亡的主要原因之一。CRC在癌症发病率方面位列世界第三,死亡率则位列第二,根据 Globocan统计数据表明,2020年全球新发CRC病例超过 190万例,死亡病例超过93万[1-2]。我国CRC在恶性肿瘤的发病率中位于第三,死亡率第五[3-4]。尽管CRC治疗采用了多学科个性化精准治疗模式,手术方式不断改进[5],Ⅱ期伴有危险因素、Ⅲ期的CRC患者应用手术切除联合术后放化疗,5年生存率仍然较低,死亡的主要原因是术后出现肿瘤复发或转移[4]。肿瘤标志物是肿瘤筛查、检测肿瘤复发转移的重要指标,癌胚抗原(CEA)、糖类抗原(CA19-9)是胃肠道肿瘤常用的肿瘤标志物,CEA 和CA19-9升高与CRC患者长期生存率低相关[6-7]。外周血T淋巴细胞亚群是评估细胞免疫功能的重要指标,分析CRC中的肿瘤浸润性T细胞可以预测CRC患者的无病生存期[8]。因此,研究CRC患者术后复发或转移的危险因素,分析临床病理参数、免疫功能状态与复发或转移的相关性,对改善CRC患者预后和提高生存质量具有重要意义。
1 资料与方法
1.1 临床资料 选取2017年12月至2018年12月间云南省肿瘤医院结直肠外科收治的结直肠癌患者150例,所有手术均由结直肠外科高年资主任医师主刀,均行根治性手术。男性77例,女性73例;平均年龄(58.19±11.85)岁;结肠癌80例,直肠癌70例;随访时间4~46个月。TNM分期根据国际癌症控制联盟AJCC/UICC(第八版)分期,术后诊断Ⅱ期59例,Ⅲ期91例,低分化CRC患者39例,中高分化111例;T1、T2期15例,T3、T4期135例;N0期59例,N1期65例,N2期26例。本研究获得昆明医科大学第三附属医院伦理审查委员会批准。纳入标准:结直肠原发肿瘤,术前未行抗肿瘤治疗,术后经病理诊断为Ⅱ、Ⅲ期;复发转移情况及诊断明确,随访资料完整。
1.2 方法 收集并记录患者年龄、性别、肿瘤部位、是否有淋巴结转移、分化程度、T分期、N分期、血清CEA、血清CA19-9、T淋巴细胞亚群、无进展生存时间等指标,以手术日期为起点,出现死亡、复发或转移为终点,时间截止至2021年12月,150例患者均定期门诊复诊和接受电话随访,无失访。无进展生存期定义为病理确诊至肿瘤复发、转移的时间。根据 CT、磁共振成像、正电子发射断层扫描图像或通过活检组织学发现新病变的出现来诊断复发。复发病例至少由1名放射科医生和1名外科医生审查。
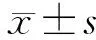
2 结果
2.1 Ⅱ、Ⅲ CRC患者临床病理特征与复发或转移的关系 本组年龄、性别、肿瘤部位、TNM分期、T分期、CEA、CA19-9、CD4+细胞比率、CD8+细胞比率、CD4+/CD8+组间比较,差异无统计学意义(P>0.05);分化程度、N分期、CD3+、CIK细胞比率组间比较,差异有统计学意义。(P<0.05),见表1。

表1 Ⅱ、Ⅲ期结直肠癌患者的临床病理特征与术后复发或转移的关系[例(%)]

续表1:
Ⅱ期CRC患者术前外周血CD3+T细胞、CD8+T细胞比率低于Ⅲ期患者,差异有统计学意义(P=0.019,P=0.012),见表2。

表2 Ⅱ期和Ⅲ期结直肠癌患者术前外周血中NK细胞、CIK细胞、CD3+细胞、CD4+细胞、CD8+细胞含量的比较(均数±标准差,%)
2.2 生存分析 以出现复发转移或死亡为终点事件,计算无进展生存期。Kaplan-Meier生存分析显示CA19-9高表达组患者的平均生存期为31.7个月,CA19-9低表达组患者为39.3个月,两组之间差异具有统计学意义(χ2=5.006,P=0.024);出现复发或转移的患者平均生存期25.5个月低于未出现复发或转移的患者42.8个月,两组之间差异具有统计学意义(χ2=45.925,P<0.001),见图1。
以性别、年龄、病理分期、肿瘤部位、T分期、N分期、CEA、CA19-9、分化程度、T淋巴细胞亚群为变量进行Cox单因素、多因素回归分析,单因素分析结果显示N分期、CA19-9是结直肠癌术后出现复发或转移的危险因素;多因素回归分析N分期是结直肠癌术后出现复发或转移的独立危险因素,见表3。

图1 不同CA19-9水平和不同复发、转移情况的Ⅱ、Ⅲ结直肠癌患者的生存分析 1A:不同CA19-9水平的结直肠癌患者总体生存率;1B:结直肠癌患者术后复发或转移情况总体生存曲线

表3 Ⅱ、Ⅲ期结直肠癌患者术后或复发转移的Cox回归分析
3 讨论
CRC术后出现复发或转移是影响CRC患者生存率的重要影响因素,部分患者确诊CRC时已经存在微转移病灶,但因太小而无法检测到,影像学评估认为无转移,因此,手术可能会错过这些无法检测到的微转移病灶[9]。因此探索灵敏度高、特异性强的早期预测指标,对改善CRC患者预后和提高生存质量具有重要意义[10]。
肿瘤标志物对于检测早期筛查恶性肿瘤具有重要临床意义,可用于指导临床治疗及评估复发转移风险,且属于相对无创且容易获得的癌组织样本[11]。Lech等[12]发现Ⅱ、Ⅲ期CRC患者的高 CEA 浓度预示着更具侵袭性。Ushigome等[13]回顾性分析 420例手术治疗的Ⅱ、Ⅲ期CRC患者的临床资料发现CEA和CA19-9阳性是影响复发后总生存率的重要预后因素。郭文静等[14]发现血清CEA和CA19-9在消化道肿瘤中CRC的阳性率最高,可辅助诊断。CRC转移一般先出现淋巴结转移,目前CRC临床分期、诊断和评估预后的重要指标是淋巴结微转移[15]。淋巴结转移度作为临床分期的补充指标,可帮助更好地评估CRC患者的预后[16]。分化程度反映肿瘤恶性程度,低分化的肿瘤细胞具有增生快和变异程度高等特点,侵袭性、转移能力强,患者预后差[17]。本研究显示,N分期、肿瘤分化程度、CD3+细胞、CIK细胞比率与Ⅱ、Ⅲ期CRC复发或转移密切相关,Cox回归分析显示N分期、CA19-9是Ⅱ、Ⅲ期CRC术后复发或转移的危险因素,CA19-9阳性和有复发或转移的CRC患者生存期降低,与上述研究一致。
机体抗肿瘤免疫的重要机制之一是细胞免疫功能,外周血T淋巴细胞亚群检测是目前评估免疫状态的重要方法,循环T淋巴细胞可能是针对肿瘤的免疫反应的指标,可作为预测性生物标志物[18]。CD3+T细胞数量代表了细胞的整体免疫状态,CD4+T细胞为辅助性T细胞,起辅助免疫作用,CD8+T细胞是细胞毒性T细胞,CD4+/CD8+比值保持动态平衡对于维持机体稳定的细胞免疫功能至关重要[19],CIK是CD3+CD4+、CD3+CD8+、CD3+CD56+和CD3-CD56+细胞群体[20],具有抗肿瘤活性广谱、抗肿瘤活性强、毒性小等特点[21]。本研究结果显示CD45+CD3+、CIK细胞比率与Ⅱ、Ⅲ期CRC患者术后复发或转移有关,这与Evans等[22]的研究结果一致,分期晚的CRC患者的细胞免疫状态紊乱,出现免疫失衡甚至免疫抑制,导致肿瘤细胞逃脱免疫系统监视,从而促进肿瘤免疫逃逸。单项的肿瘤标志物监测可能灵敏度或特异度不高,不能有效监测CRC复发或转移。因此,临床早期筛查预防CRC复发或转移,应联合监测肿瘤标志物及淋巴结转移、分化程度以及细胞免疫功能状态,并采取针对性干预措施,以预防CRC患者术后复发或转移,提高生存质量。
本研究存在一定的局限性,为回顾性研究,且纳入的样本量不够大,没有对肿瘤标志物、T淋巴细胞亚群等指标进行动态观察,将在未来进一步论证。

