FOXP3与乳腺癌病理特征和预后的相关性研究
姜林宏, 李蕾, 钟山亮, 王丹丹, 张建, 唐金海, 张鹤达
乳腺癌已经成为全球女性发病率最高的恶性肿瘤,占女性恶性肿瘤总发病率的30%,且总死亡率仅次于肺癌,占女性恶性肿瘤总死亡率的15%。此外,乳腺癌发病率仍以每年约0.5%的速度继续增长[1]。目前手术、化疗、放疗,靶向治疗等提高了乳腺癌的生存率,但是我们对乳腺癌发病机制和途径的认知仍有很大不足,需要不断寻找乳腺癌新的治疗靶标。
叉头样转录因子(forkhead box protein 3,FOXP3),是叉头样转录因子家族中的一员,被认为是调节性T细胞(Treg细胞)最特异性的标志[2-3]。Treg细胞是CD4+T细胞的免疫抑制亚群,具有保护性作用,其主要通过抑制T效应细胞的功能来促进肿瘤的生长[4]。PD1可以通过促进FOXP3的表达增加Treg细胞的稳定性[5]。此外,文献发现FOXP3在肿瘤的发生发展中起着重要的作用,如FOXP3作为wnt/β-catenin信号通路的共激活因子,促进β-catenin-TCF4复合物的形成,同时激活EMT相关的转录因子,进而诱导EMT信号通路,从而促进非小细胞肺癌细胞的增殖和侵袭转移[6];FOXP3可以与LINC00885的启动子特异性地相互作用,诱导LINC00885的转录,进而激活EMT信号通路,从而增加子宫颈癌细胞的增殖和侵袭[7]。此外,在乳腺癌中,高剂量的花萼菌素可降低FOXP3的表达,进而减少VEGF 和 MMP-9的表达,从而抑制乳腺癌细胞的迁移和侵袭[8];此外,FOXPS可以与VEGF启动子相互作用,抑制其转录,从而下调VEGF的表达抑制乳腺癌的血管生成[9]。然而目前关于FOXP3在乳腺癌中的研究较少,本研究分析FOXP3在乳腺癌中的表达及预后,并通过免疫组化进一步分析FOXP3在乳腺癌中的表达,为乳腺癌的诊断及治疗提供更多有利的依据。
1 资料与方法
1.1 UALCAN数据分析 UALCAN (http://ualcan.path.uab.edu/)是一个分析TCGA数据库中RNA-seq和临床资料在线数据库,通过肿瘤数据库UALCAN分析FOXP3在乳腺癌和癌旁组织中的表达,及其在不同乳腺癌分子分型及分期中的表达情况[10]。
1.2 Kaplan-Meier生存分析 Kaplan-Meier(http://kmplot.com/analysis/)是一个基于GEO、EGA和TCGA数据库Meta分析肿瘤预后的数据库。将乳腺癌患者以FOXP3 mRNA表达的中位数为界分为高表达和低表达组,根据Kaplan-Meier在线分析FOXP3 mRNA的表达与乳腺癌预后的关系。
1.3 TIMER分析 TIMER (https://cistrome.shinyapps.io/timer/)是一个评估肿瘤浸润性免疫细胞及其临床意义的在线数据库,利用该数据库分析乳腺癌中FOXP3与肿瘤浸润性免疫细胞的关系,包括B细胞、CD4+T细胞、CD8+T细胞、树突状细胞、中性粒细胞和巨噬细胞。
1.4 免疫组化 选取盐城市第一人民医院病理科2014年至2016年存档的手术切除或活检的蜡块标本101例,经3名有经验的病理医师确诊。临床资料完整;均为女性;年龄36~84岁,中位年龄54岁。本研究经本院医学伦理委员会讨论并通过,患者及家属均签署知情同意书。将乳腺癌组织依次采用二甲苯、梯度乙醇水化、PBS进行脱蜡,柠檬酸缓冲液进行抗原修复,PBS冲洗,内源性过氧化物酶失活,滴加小鼠抗人PD-L1(DAKO,PD-L1试剂盒)、CD3、CD4、CD8、CD20、CD68多克隆抗体(CD系列是即用型抗体,迈新),4 ℃冰箱过夜,滴加适量生物素标记羊抗鼠二抗,室温孵育30 min,PBS冲洗;然后滴加HRP标记的链霉亲和素,PBS冲洗,经DAB显色试剂盒显色,苏木素复染,梯度乙醇脱水,二甲苯透明,封片,最后荧光倒置显微镜观察PD-L1、CD3、CD4、CD8、CD20、CD68的表达。
1.5 统计分析 箱形图以TPM值来评估组间基因表达水平的差异,两组间比较采用独立样本t检验,用log-rank检验评价生存差异。采用Spearman相关检验分析表达相关性。P<0.05表示差异有统计学意义。
2 结果
2.1 FOXP3在乳腺癌组织中的表达 通过UALCAN数据库分析,我们发现与癌旁组织相比,FOXP3在乳腺癌组织中表达高,差异有统计学意义(P<0.001),图1A;进一步分析,在luminal型、HER2 阳性型和三阴性乳腺癌3种乳腺癌不同的分子分型中,FOXP3在肿瘤组织的表达均高于癌旁组织,差异有统计学意义(P<0.001),图1B;在淋巴结转移及远处转移的乳腺癌中,FOXP3在肿瘤组织的表达均高于癌旁组织,差异有统计学意义(P<0.001),图1C、1D。

注:***为P<0.001图1 FOXP3在癌旁及乳腺癌组织中的表达 1A:FOXP3在癌旁及乳腺癌组织中的表达;1B:FOXP3在癌旁及不同乳腺癌分型中的表达;1C:FOXP3在癌旁及不同级别乳腺癌淋巴结转移中的表达;D:FOXP3在癌旁及不同分期乳腺癌转移中的表达
2.2 FOXP3与免疫浸润细胞的关系 通过TIMER数据库评估FOXP3表达系数和免疫细胞浸润之间的关系,结果显示FOXP3与肿瘤纯度(指肿瘤组织中肿瘤细胞所占的比例)、B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞的免疫浸润水平均有关,差异有统计学意义(P<0.001),图2。

图2 FOXP3与肿瘤纯度(2A)、B细胞(2B)、CD8+T细胞(2C)、CD4+T细胞(2D)、巨噬细胞(2E)、中性粒细胞(2F)和树突状细胞(2G)免疫浸润细胞的关系
2.3 乳腺癌患者中FOXP3的预后 通过Kaplan-Meier数据库,评估FOXP3表达与乳腺癌预后的关系。FOXP3+以中位值作为临界值分成低表达组(≤5%)和高表达组(>5%)。相比于FOXP3低表达组,FOXP3高表达组的总生存率(OS)降低(HR: 1.33,P=0.012),图3A。不同乳腺癌亚型中,仅在HER2阳性型乳腺癌患者中FOXP3的低表达组OS升高(HR:2.01,P=0.023),图3B。而在luminal型(HR:1.09,P=0.590)(图3C)和三阴性乳腺癌(HR:0.78,P=0.53)(图3D)中,FOXP3的表达与患者的OS无关,差异无统计学意义(P>0.05)。

图3 不同乳腺癌亚型中FOXP3高表达、低表达患者的Kaplan-Meier生存曲线 3A:乳腺癌患者中FOXP3高表达、低表达患者总生存率的生存曲线对比;3B:HER2阳性型乳腺癌患者中FOXP3高表达、低表达患者总生存率的生存曲线对比;3C:luminal型乳腺癌患者中FOXP3高表达、低表达患者总生存率的生存曲线对比;3D:三阴性乳腺癌患者中FOXP3高表达、低表达患者总生存率的生存曲线对比
2.4 FOXP3+与乳腺癌临床病理特征的关系 对72例乳腺癌患者进行免疫组化分析,以FOXP3+表达的中位值作为临界值分成低表达组(≤5%)和高表达组(>5%),发现FOXP3+表达水平与乳腺癌肿瘤大小无关,差异无统计学意义(P>0.05),但FOXP3+表达与淋巴结转移、远处转移、TNM分期有关,差异有统计学意义(P<0.05),见表1。
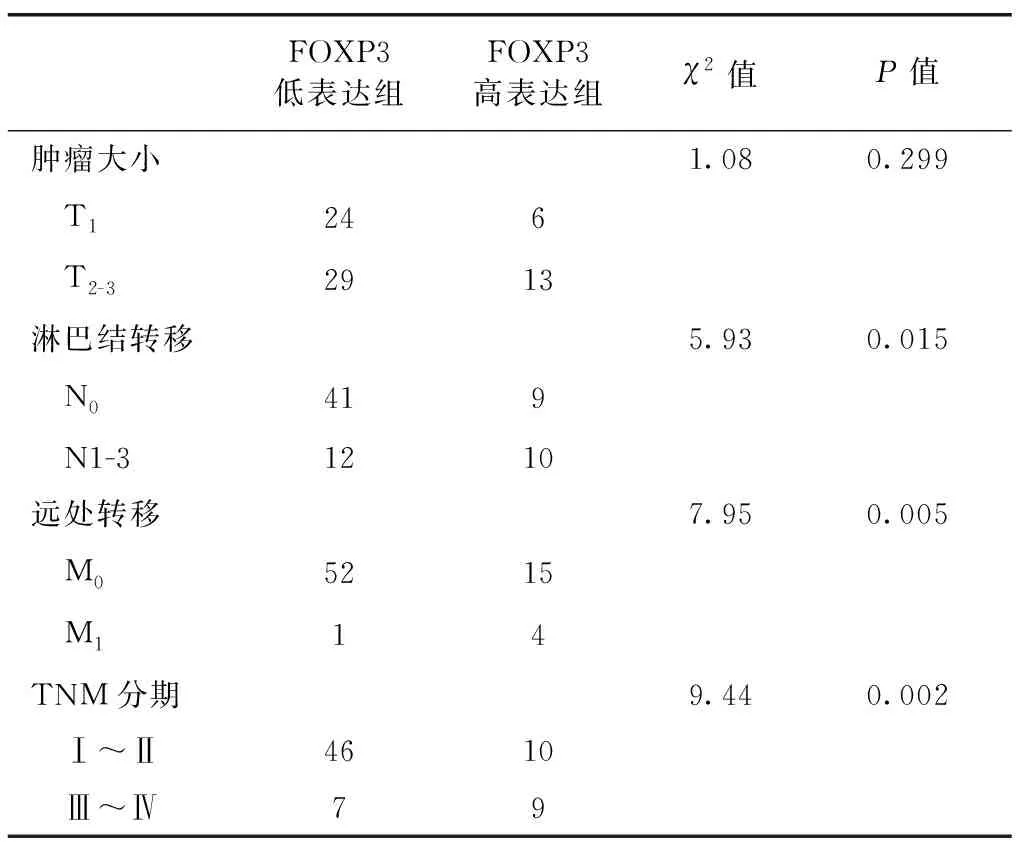
表1 FOXP3+低表达、高表达与乳腺癌临床病理特征的关系
2.5 FOXP3+与免疫细胞标记因子的关系 对免疫细胞标记因子进行免疫组化分析,免疫细胞标记因子均以各自表达的中位值为临界值进行分组,分为CD20低表达组(≤5%)和高表达组(>5%);CD68低表达组(≤10%)和高表达组(>10%);CD3低表达组(≤20%)和高表达组(>20%);CD4低表达组(≤10%)和高表达组(>10%);CD8低表达组(≤20%)和高表达组(>20%))。发现CD20+的免疫细胞与乳腺癌淋巴结转移和TNM分期有关,差异有统计学意义(P<0.05),而其他免疫细胞标记因子(PD-L1、CD68、CD3、CD4和 CD8)与乳腺癌TNM分期无关,差异无统计学意义(P>0.05),表2。FOXP3+表达水平与CD3+,CD20+,CD68+免疫细胞标记因子有关(P<0.05),表3。
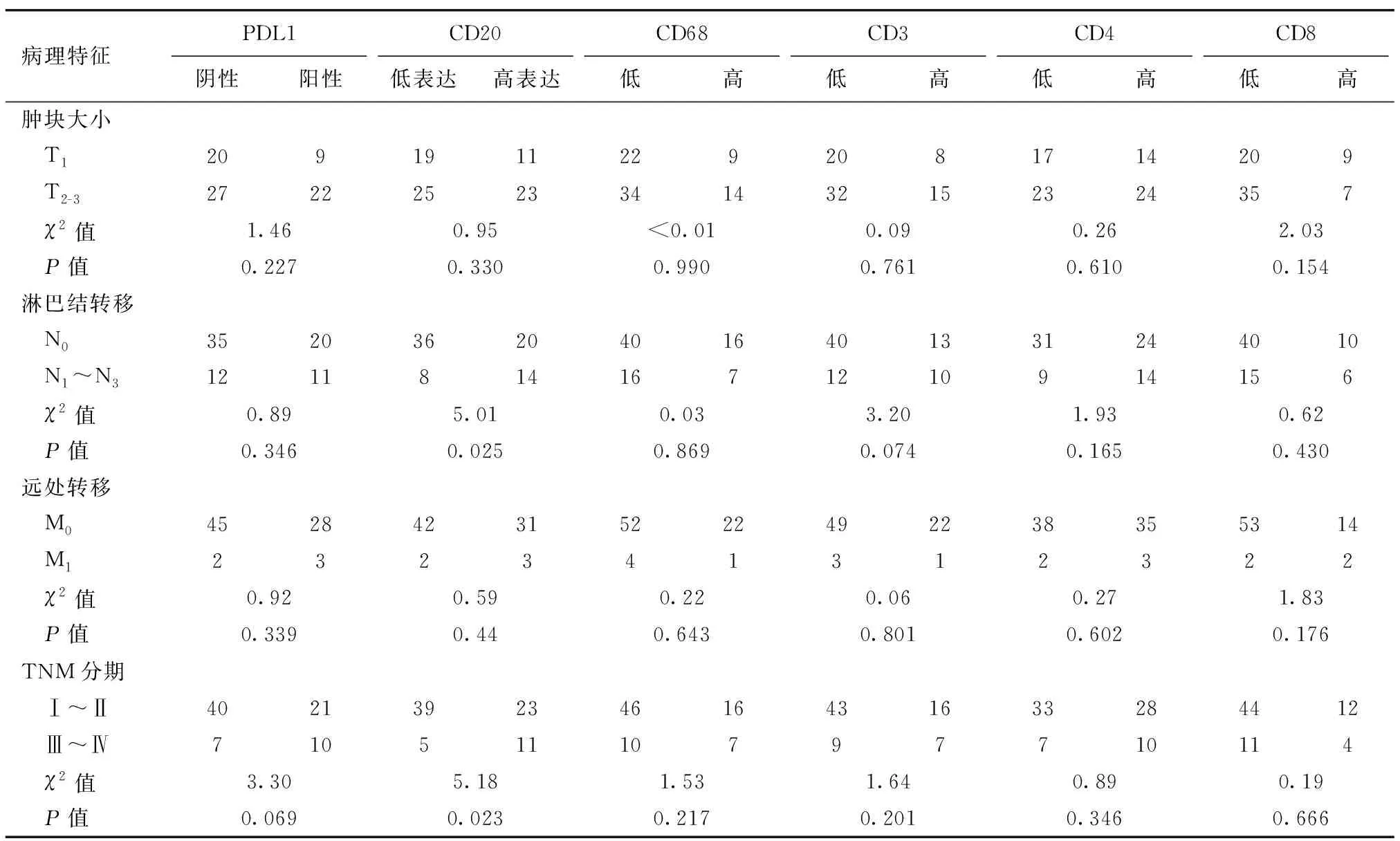
表2 免疫细胞标记因子表达水平与乳腺癌临床病理特征的关系

表3 FOXP3+表达水平与免疫细胞标记因子的关系
3 讨论
FOXP3 基因位于Xp11.23,由11个外显子组成,可编码1个由431个氨基酸组成的蛋白质[11-12]。研究发现FOXP3具有肿瘤生物学功能,参与肿瘤的进展,如FOXP3在舌鳞状细胞癌中高表达,且与舌鳞状细胞癌的病理分化和较差的患者生存率相关[13]。在上皮性卵巢癌中,FOXP3过表达可通过降低Ki-67和细胞周期蛋白依赖性激酶(CDKs)的表达减少细胞增殖,同时FOXP3也可以下调MMP2和尿激酶型纤溶酶原激活物(uPA)抑制细胞迁移侵袭,另外FOXP3还可能部分通过抑制mTOR和 NF-kB信号通路抑制细胞的增殖和侵袭[14]。本研究发现,与癌旁组织相比,FOXP3在乳腺癌组织中表达更高,且在不同的乳腺癌分子分型中,FOXP3在luminal型、HER2 阳性型和三阴性乳腺癌3种乳腺癌分子分型的癌组织中的表达比在癌旁组织表达高,同时FOXP3在发生淋巴结转移、远处转移的乳腺癌组织中表达高,以上数据提示FOXP3可能与乳腺癌发生、发展有关。通过生存分析发现FOXP3的低表达与总生存率相关,然而在不同的乳腺癌分子分型中进一步分析,发现仅在HER2阳性的患者中,FOXP3低表达者总生存率高,提示着FOXP3高表达不仅与乳腺癌不良预后有关,而且在HER2过表达时,FOXP3的激活可能促进了肿瘤发生侵袭转移或者免疫逃逸或者FOXP3与HER2有协同作用,这需要后续实验进一步验证。既往研究表明FOXP3在调节Treg细胞的分化和发育中发挥着不可或缺的作用,并在肿瘤微环境中发挥重要作用[15]。Treg细胞是一类负免疫调控的T细胞,其可以阻止其他T细胞的活化,躲避免疫系统对肿瘤细胞的监视,从而形成有效的免疫逃逸[16]。例如来源于肿瘤浸润淋巴细胞抑制免疫反应的CD8+、FOXP3+ 、Treg细胞能够抑制初始T细胞的增殖,从而导致前列腺癌的免疫抑制[17];肝癌细胞中的FOXP3 + Treg可以通过抑制CD8+CTL 的增殖使免疫抑制增强,促进肿瘤进展[18]。为探究FOXP3在乳腺癌中与免疫浸润的关系,我们通过免疫化学标记发现FOXP3+与肿瘤纯度、B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞的免疫浸润水平均相关。CD68是巨噬细胞最可靠的标记,CD3、CD4、CD8、PDL1主要存在于T细胞表面,CD20是在除浆细胞外的B细胞表面,均参与细胞的免疫调节。因此我们通过不同免疫细胞化学标志物进一步研究了FOXP3与免疫细胞标记因子在乳腺癌中的表达。研究发现FOXP3+与乳腺癌肿瘤大小无关,但与淋巴结转移、远处转移和TNM分期有相关性。而钟恋君等[19]发现在三阴性乳腺癌中FOXP3与组织学分级呈正相关性,与患者肿瘤直径、淋巴结转移均无关,这可能与乳腺癌分子分型有关。同时我们进一步分析PD-L1、CD3、CD4、CD8、CD20、CD68免疫细胞标记因子在乳腺癌中的表达,发现CD20+与乳腺癌淋巴结转移和TNM分期有关,而PD-L1、CD3+、CD4+、CD8+、CD68+却与乳腺癌肿瘤大小、淋巴结转移及TNM分期无关。而其他研究显示CD4+,CD8+与三阴性乳腺癌肿块大小呈负相关[19],PD-L1与三阴性乳腺癌淋巴结转移,脉管癌栓呈正相关[20],CD8+与三阴性乳腺癌组织学分级呈正相关[21],CD68阳性的肿瘤相关巨噬细胞与淋巴结转移,较差的组织学分级相关[22],这些结果差异可能与研究标本中乳腺癌分型有关,需要后续研究进一步验证。本研究发现FOXP3+与CD3+,CD20+,CD68+有关,提示FOXP3+可能通过影响肿瘤细胞的抗原呈提,抑制T细胞杀伤能力,从而达到肿瘤细胞的免疫逃逸。
综上所述,FOXP3在乳腺癌组织中高表达,且与淋巴结转移及分期相关,同时FOXP3+与CD3+,CD20+,CD68+免疫浸润细胞相关,有望成为乳腺癌新的标志物,但是目前研究尚缺乏分子机制的探索,FOXP3生物学功能及相关的免疫逃逸机制有待更深入的探究,这将为乳腺癌的临床治疗提供新途径。

