气相色谱测定烟草中非挥发有机酸方法改进
刘瑞红,潘立宁,王晓瑜,陈黎,陈满堂,秦亚琼,刘克建,王冰,谢复炜
(中国烟草总公司郑州烟草研究院,郑州 450001)
烟草中非挥发性有机酸约占烟叶重量的10%,其种类和含量对烟气吸味有很大影响[1-3]。非挥发有机酸不仅能与生物碱结合,调节游离态和质子化烟碱的比例,减少口腔刺激感,改善抽吸质量,还可以增加烟叶的脂肪和腊味,提高抽吸劲头[4-5],另外,研究还显示非挥发有机酸是烟叶香型风格研究的重要指标之一[6-7],因此检测烟草中非挥发性有机酸对了解烟叶的内在质量、改进叶组配方和加香加料都具有重要指导意义。
烟草中的非挥发有机酸一般是以碱金属盐或有机碱盐的形式存在,只有小部分以游离形式存在,因此其检测一般先经衍生化处理,再使用气相色谱进行分离分析。硫酸甲醇衍生化-气相色谱(GC)法由于原料易得、操作简单、结果准确度高,已成为烟草有机酸测定常用的检测方法[8-13],如刘春奎等[8]通过硫酸甲醇甲酯化-GC法测定并比较了河南不同产区、不同等级烤烟样品的非挥发性有机酸含量;王冰等[9]比较了加热回流和室温放置两种硫酸甲醇甲酯化衍生化方法对烟草中多元酸和高级脂肪酸测定的影响;穆童等[10]用硫酸甲醇甲酯化-GC法测定并分析了烟株上、中、下3个部位烟叶样品中的非挥发性有机酸含量变化及其与化学品质和感官品质指标的关系。
甲酯化过程和萃取过程均是硫酸甲醇衍生化-GC法检测有机酸的关键步骤。已有文献对甲酯化过程的温度和时间进行了研究[14-15],但针对烟草中有机酸的甲酯化过程探讨较少。另外由于甲酯化溶液中杂质较多,通常在甲酯化溶液中加入水和二氯甲烷,充分摇匀或振荡,进行目标物萃取。已报道的萃取方法存在静置时间长、分层效果差、萃取次数多、操作繁琐等问题,萃取效果往往不理想;且硫酸甲醇甲酯化溶液呈强酸性,采用二氯甲烷萃取后仍残留较多氢离子,进样会导致气相管路及金属配件损耗较大。基于此,笔者对烟草中非挥发有机酸的甲酯化过程和萃取过程关键影响因素进行了探索和优化,建立了13种影响烟草吃味的非挥发性有机酸测定方法,为大批量烟叶测试工作提供一种精密度好、稳健度高、测定结果准确可靠的分析方法。
1 实验部分
1.1 主要仪器与试剂
气相色谱仪:6890N 型,附氢火焰离子化检测器,美国安捷伦科技有限公司。
电子天平:CP2245型,德国赛多利斯集团。
恒温水浴锅:HH-ZK4型,巩义市予华仪器有限责任公司。
分液漏斗振荡器:EYELA MMV-1000W 型,日本东京理化器械株式会社。
调速振荡器:HY-8型,常州国华电器有限公司。
涡旋仪:Multi Reax型,德国海道夫公司。
乳酸:质量分数为98%,美国阿法埃莎公司。
乙二酸:质量分数为99%,德国西格玛奥德里奇公司。
丙二酸、十四酸、十六酸、十八酸、十九酸、二十酸、己二酸:质量分数分别为99%、97%、98%、98%、98%、99%,日本东京化成工业株式会社。
丁二酸、苹果酸、亚油酸、油酸、亚麻酸:质量分数分别为99%、99%、97%、99%,比利时Acros Organics公司。
柠檬酸、香草酸:质量分数分别为98%、99%,北京百灵威科技有限公司。
甲醇:色谱纯,质量分数为99.9%,德国默克公司。
二氯甲烷:色谱纯,德国默克公司。
浓硫酸、氯化钠、十二水合磷酸氢二钠、无水硫酸钠:分析纯,国药集团化学试剂有限公司。
蒸馏水:香港屈臣氏集团。
烟叶样品:251个,2019年从全国八大香型烟叶产区的80 个取样点采集的X2F、C3F、B3F 3 种等级烟叶。
参比烟叶样品:由上述251 个烟叶样品均匀混制而成。
1.2 溶液制备
硫酸-甲醇溶液:采用量筒准确量取3 800 mL甲醇至5 000 mL 烧杯中,量取200 mL 浓硫酸,边搅拌边加入,放置冷却后,转移至棕色瓶中,常温密封放置,待用。
水相溶液:(1)Na2HPO4-NaCl 混合溶液:分别称取90 g 十二水合磷酸氢二钠和40 g 氯化钠,加入1 000 mL 水,采用630 W 的功率超声,边超声边搅拌,至完全溶解。(2)Na2HPO4溶液:称取90 g十二水合磷酸氢二钠,加入1 000 mL 水,采用630 W 的功率超声,边超声边搅拌,至完全溶解。(3)蒸馏水:采用香港屈臣氏集团的4 L桶装蒸馏水。
内标溶液:称取1.00 g 己二酸、0.15 g 十九酸至50 mL容量瓶中,用甲醇定容至45 mL,超声溶解并放至室温,用甲醇定容至标线。
有机酸系列标准工作溶液:分别称取0.05 g 乳酸、0.7 g乙二酸、0.1 g丙二酸、0.02 g丁二酸、1.0 g苹果酸、0.6 g柠檬酸、0.02 g香草酸、0.02 g十四酸、0.1 g十六酸、0.1 g亚油酸、0.15 g油酸、0.035 g十八酸、0.02 g 二十酸(精确至0.1 mg)于150 mL 烧杯中,加入约40 mL 甲醇超声至完全溶解,放置室温后转移至50 mL容量瓶中,用甲醇定容至标线,得到有机酸混合储备液。依次移取上述储备液125、250、500、1、2、5 mL于50 mL容量瓶中,用硫酸-甲醇溶液稀释定容至标线,摇匀,然后转移至100 mL 平底烧瓶中,加入300 μL 内标溶液和50 mL 硫酸-甲醇溶液,将烧瓶与冷凝管紧密连接,在80 ℃下水浴回流120 min,冷却至室温,得到甲酯化溶液,取5 mL 甲酯化溶液至125 mL 分液漏斗中,依次加入10 mL Na2HPO4-NaCl混合水溶液和7.5 mL二氯甲烷,于分液漏斗中振荡器中以220 r/min 速度振荡10 min。振荡结束后,取下分液漏斗,静置10 min,然后取下层溶液至盛有4.0 g无水硫酸钠的锥形瓶中,向分液漏斗中继续加入7.5 mL 二氯甲烷,重复萃取,合并两次萃取液。摇动锥形瓶,使萃取液与无水硫酸钠充分接触,然后机械振荡30 min,振荡频率为180 r/min。将萃取液过0.22 μm 有机相滤膜,得到系列浓度有机酸标准工作溶液,分别用B1、B2、B3、B4、B5、B6表示。
1.3 样品处理
硫酸甲醇甲酯化:称取1 g 烟末样品至100 mL平底烧瓶中,加入300 μL内标溶液和50 mL硫酸-甲醇溶液,将烧瓶与冷凝管紧密连接,在设定温度下水浴回流设定时间,冷却至室温,得到甲酯化溶液。
提取:(1)用分液漏斗一次萃取。取5 mL 上述甲酯化溶液至125 mL分液漏斗中,依次加入10 mL水相溶液和15 mL 二氯甲烷,于分液漏斗中振荡器中以220 r/min振荡10 min。振荡结束后,取下分液漏斗,静置10 min,然后取下层溶液至盛有4.0 g 无水硫酸钠的锥形瓶中。摇动锥形瓶,使萃取液与无水硫酸钠充分接触,然后以180 r/min 机械振荡30 min。萃取液过0.22 μm有机相滤膜,进样至气相色谱仪中分析。(2)两次萃取。每次加入二氯甲烷7.5 mL,合并两次萃取液,其余步骤不变。(3)三次萃取。每次加入二氯甲烷5 mL,合并三次萃取液,其余步骤不变。(4)涡旋萃取。取5 mL甲酯化溶液至40 mL离心管中,依次加入10 mL水相溶液和15 mL二氯甲烷,于涡旋仪中以2 000 r/min 的速度涡旋10 min,取下层萃取液过0.22 μm 有机相滤膜,进样至气相色谱仪中分析。
1.4 色谱条件
色谱柱:DB-5MS 石英毛细管柱(60 m×0.25 mm,0.25 μm,美国安捷伦科技有限公司);进样模式:分流进样,分流比为5∶1;进样体积:1 μL;进样口温度:280 ℃;升温程序:40 ℃保持3 min,以10 ℃/min 升至280 ℃,保持30 min;载气:氦气,恒流模式,流量为1.5 mL/min;检测器:FID;检测器温度:280 ℃;氢气流量:40 mL/min;空气流量:400 mL/min;尾吹气:氦气,流量为30 mL/min。
2 结果与讨论
2.1 色谱条件的确定
虽然气相色谱-质谱联用仪(GC-MS)和气相色谱-火焰离子化检测器(GC-FID)均可用来测定有机酸甲酯化产物,而国家计量检定规程(JJG 700—2016)[16]要求GC-FID 的定量重复性(测定值的相对标准偏差)不大于3%,国家计量技术规范(JJF 1164—2006)[17]对GC-MS 测量重复性要求为不大于10%,文献也表明GC-FID 的测量重复性优于GCMS[18],因此针对需长期测定大批量烟叶样品并对测定结果重复性要求较高的情况,在满足待测物质分离度的条件下,优先选择GC-FID进行检测。
有机酸甲酯化后极性降低,适合使用弱极性色谱柱进行分离,因此笔者选择DB-5MS 石英毛细管柱(60 m×0.25 mm,0.25 μm)进行检测。由于烟草中乳酸、香草酸、二十酸含量较低,为了满足其测定,实验优化了载气流速、升温速率以及FID 检测器的氢气、空气、尾吹气流速及比例,在确保十三种有机酸甲酯化产物具有良好分离度的基础上,获得较窄的色谱峰,从而提高分析灵敏度。最终优化的色谱条件见1.4。
图1 为在上述优化色谱条件下,有机酸标准工作溶液B4和参比烟叶样品经硫酸-甲醇甲酯化后的二氯甲烷萃取液的GC-FID色谱图。由图1可知,13 种有机酸的分离效果好,色谱峰形对称,说明优化得到的色谱条件较为合适。

图1 有机酸标准工作溶液和参比烟叶样品甲酯化产物的GC-FID图

表1 无内标和双内标校正下参比烟叶样品目标酸的相对标准偏差
2.2 甲酯化过程优化
2.2.1 甲酯化温度
甲酯化温度是影响烟草中游离和结合态有机酸是否衍生完全的关键因素。王冰等研究表明,60 ℃加热回流2 h比室温放置20 h甲酯化测定结果高5%~38%[9],原因可能是烟草中结合态的酸要进一步酯化需要的反应能量更高,但其并未进一步考察不同温度对甲酯化的影响。笔者对比了60、70、80 ℃下加热回流对甲酯化结果的影响。
通过观察实验发现,当水浴温度为60 ℃时,甲酯化溶液不沸腾,烟叶粉末沉于烧瓶底部;随着温度升高,甲酯化溶液沸腾状态逐步加剧,在70 ℃水浴时,甲酯化溶液微沸,部分烟叶粉末处于流动状态;当水浴温度增加至80 ℃时,甲酯化溶液处于剧烈沸腾状态,烟叶粉末上下翻滚,甲酯化过程更加均匀。进一步增加甲酯化温度,甲酯化溶液沸腾状态无明显变化,但水的蒸发损失加速,因此选择将考察的甲酯化温度上限设定为80 ℃。
图2为甲酯化温度对样品中有机酸甲酯相对萃取率的影响(样品编号见图1,下同)。由图2 可知,由于有机酸在烟草中的存在形态不同,不同有机酸全部酯化需要的反应能量略有差异,水浴温度由60 ℃增至80 ℃,参比烟叶样品中乳酸等13 种有机酸酯化产物响应面积增加4%~12%,因此选择80 ℃作为水浴温度。
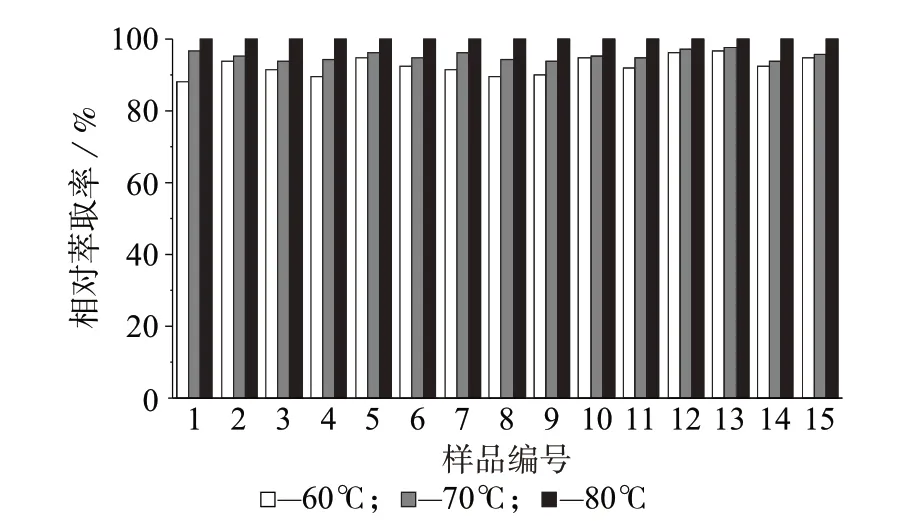
图2 甲酯化温度对样品中有机酸甲酯相对萃取率的影响
2.2.2 甲酯化时间
为了确保目标有机酸完全衍生,分别设置水浴时间为60、75、90、105、120 min 进行试验,探究水浴时间对参比烟叶样品甲酯化结果的影响,结果如图3所示。由图3可见,水浴120 min时,各有机酸衍生化基本完成,因此选择甲酯化时间为120 min。
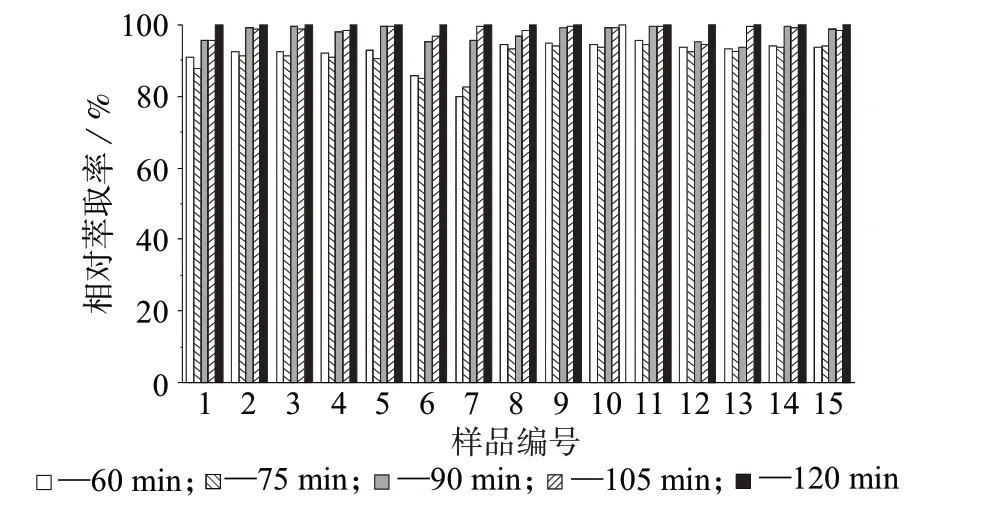
图3 甲酯化时间对样品中有机酸甲酯相对萃取率的影响
2.3 萃取过程优化
2.3.1 盐析萃取
在水中加入适量盐产生的盐析效应不仅可提高萃取率,还可降低萃取过程中的乳化现象,有利于分层取样;另外有机酸甲酯化溶液呈强酸性,即使用二氯甲烷萃取后仍残留有氢离子,对气相色谱仪金属配件有腐蚀作用,因此笔者在水相中加入Na2HPO4,形成pH 缓冲体系,以减弱溶液酸性,同时提高萃取效率。图4 为分别采用蒸馏水、Na2HPO4溶液和Na2HPO4-NaCl 混合溶液振荡萃取甲酯化参比烟叶样品中各有机酸甲酯的相对萃取率。由图4 可知,加入Na2HPO4溶液与Na2HPO4-NaCl 混合溶液均能提高萃取效率,但由于Na2HPO4-NaCl混合溶液中因加入NaCl 而增大了离子浓度,盐析效率提高,其萃取效果稍优于Na2HPO4溶液。另外实验观察到加入Na2HPO4-NaCl 混合溶液进行萃取时,分层速度快、效果好,因此选用Na2HPO4-NaCl混合溶液进行盐析萃取。

图4 水相组成对样品中有机酸甲酯相对萃取率的影响
2.3.2 振荡方式
为进一步提高萃取效率,以参比烟叶样品中有机酸甲酯化产物的色谱峰面积为指标,对比了分液漏斗振荡和涡旋振荡两种萃取方式的萃取效果。图5为不同萃取次数和方式下有机酸甲酯的相对萃取率,其中分液漏斗萃取3次代表萃取完全。由图5可知,仅萃取1 次时,乳酸、苹果酸和香草酸的甲酯化产物萃取率较低,为77%~88%,其它有机酸甲酯化产物萃取率为88%~96%。造成这种差异的原因是乳酸、苹果酸和香草酸甲酯化产物含有游离羟基,在极性溶剂中溶解度较高,不易被萃取到二氯甲烷相,柠檬酸虽然也含有羟基,但其三个羧基甲酯化后会产生较大位阻,与其它含羟基有机酸相比,在极性溶剂中的溶解度较低。有机酸甲酯化产物的分子结构决定了其在甲醇水和二氯甲烷两相间的分配比,由于分配比是固定的,无论采取分液漏斗振荡萃取还是涡旋萃取,仅萃取1次时的萃取率较低,因此为了保证萃取完全,选用分液漏斗多次振荡萃取方式。

图5 萃取方式对样品中有机酸甲酯相对萃取率的影响
2.3.3 萃取次数
萃取不完全,方法的稳健度会受到影响,而重复萃取3 次,萃取步骤耗时较长。由上述研究可知,Na2HPO4-NaCl混合溶液可以提高萃取效率,缩短萃取时间,因此在保证萃取完全的前提下,为了减少萃取次数,提高工作效率,研究了使用Na2HPO4-NaCl混合溶液萃取完全所需要的萃取次数。
图6 为采用Na2HPO4-NaCl 混合溶液对甲酯化参比烟叶样品分别萃取1、2、3 次的萃取率。由图6可知,加入Na2HPO4-NaCl混合溶液萃取2次与萃取3 次的效果相当,因此选用Na2HPO4/NaCl 混合盐水萃取2次即可萃取完全。

图6 萃取次数对样品中有机酸甲酯相对萃取率的影响
2.4 线性关系与定量限
对系列浓度的甲酯化标准品检测,以各有机酸与相应内标的峰面积比(y)对其相应含量比(x)进行回归分析,得到各有机酸的线性方程及其相关系数;以10 倍信噪比对应的有机酸质量分数为方法的定量限。13 种有机酸的线性范围、线性方程、相关系数、定量限、测定值的相对标准偏差及加标回收率列于表2。由表2可知,13种目标酸的线性关系良好,相关系数均大于0.999,定量限为0.02~0.13 mg/g。

表2 烟草中有机酸的线性范围、线性方程、相关系数、定量限
2.5 加标回收与精密度试验
以参比烟叶样品作为分析对象,重复测定10次,考察方法的精密度,精密度试验质量分数测定结果见表3。对样品进行低、中、高3 种不同浓度水平的加标处理,衍生化后进GC-FID分析,计算其加标回收率,结果见表4。从表3、表4可知,测量结果的相对标准偏差为0.4%~3.5%(n=10),加标回收率为90.6%~105.0%,说明该方法精密度、准确度较好,可以满足大批量样品定量需求。
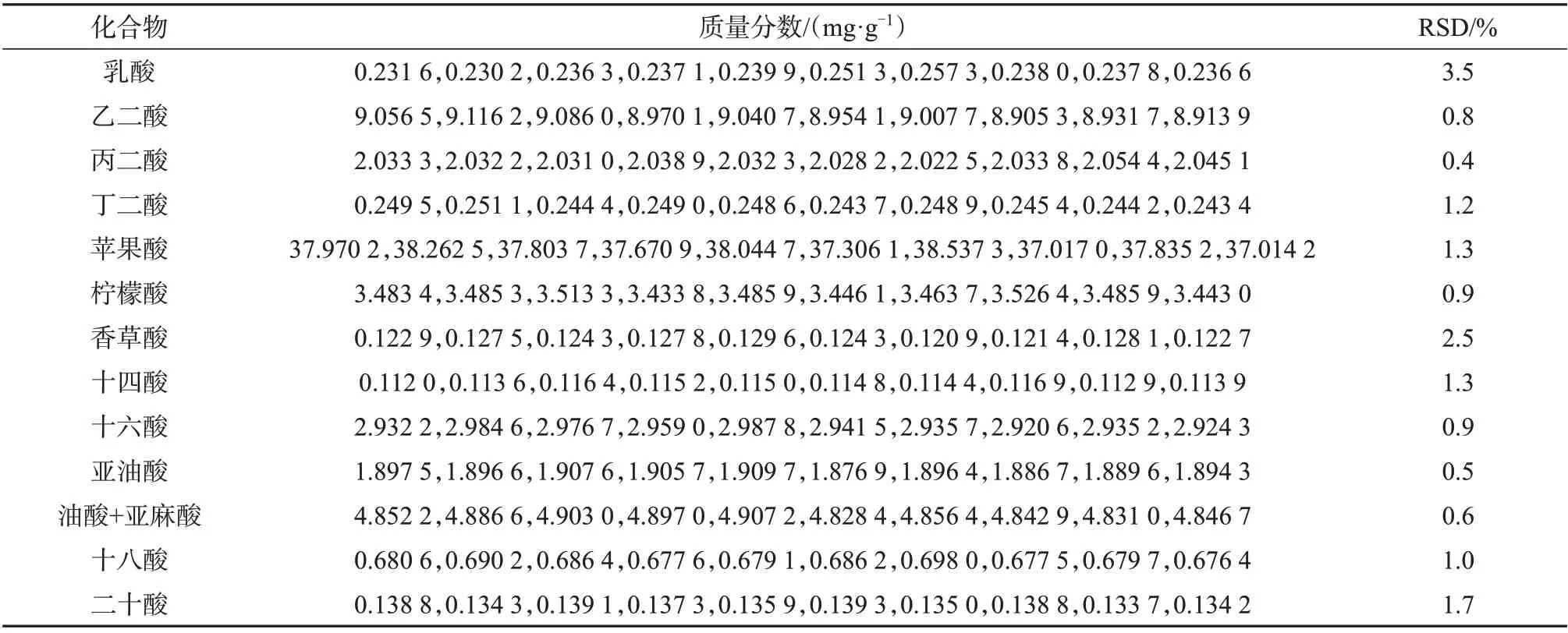
表3 烟草中有机酸的精密度试验质量分数测定结果
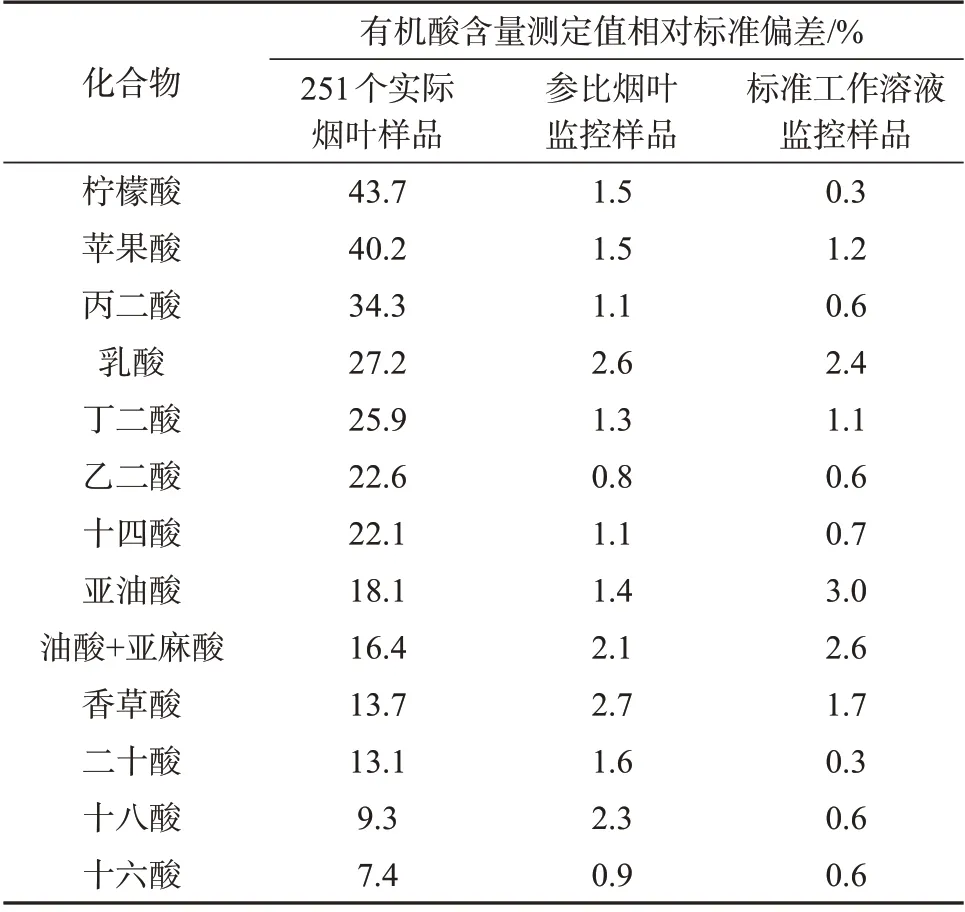
表4 251个烤烟样品检测结果分析
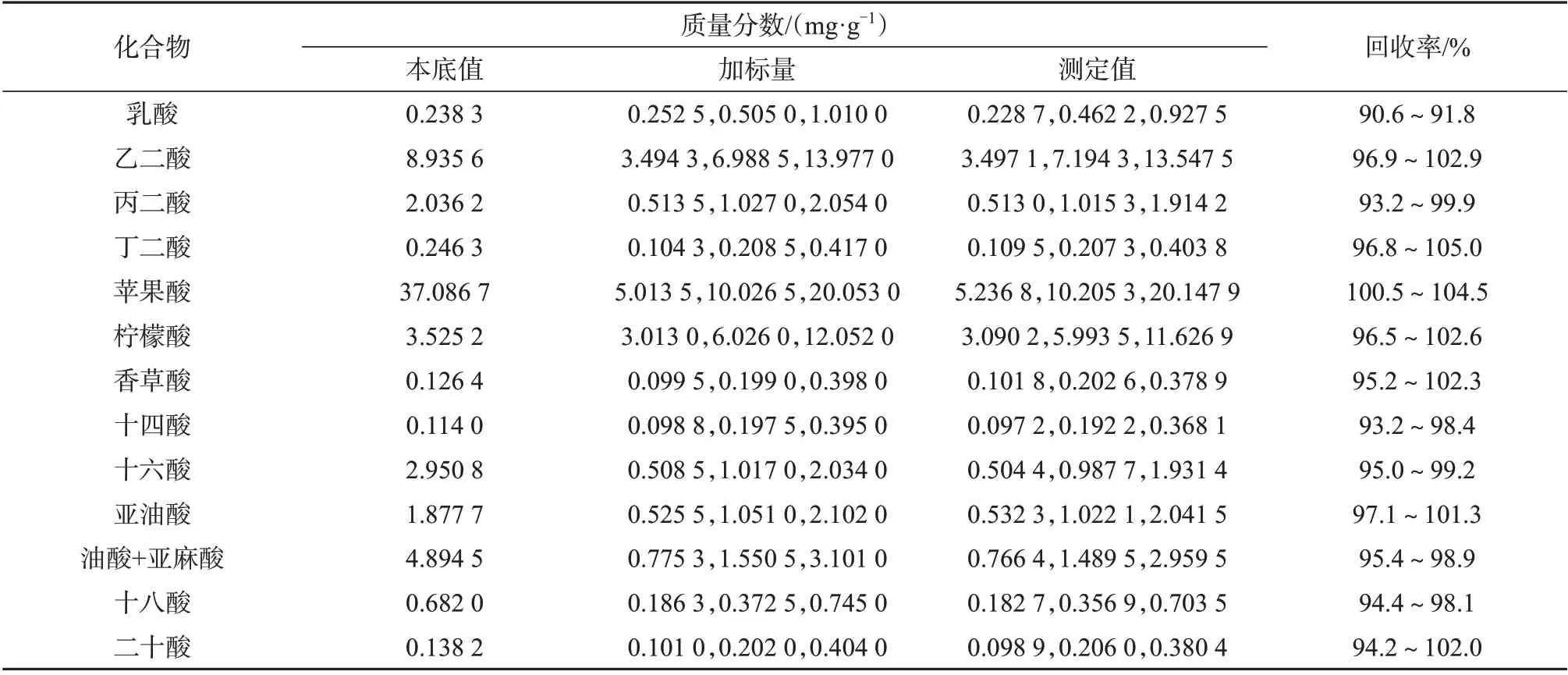
表4 烟草中有机酸的加标回收试验质量分数测定结果
2.6 实际样品分析
采用上述优化方法分批测试了从全国八大香型烟叶产区采集的251 个实际烟叶样品,每批样品测试时均插入1个参比烟叶样品和1个标准工作溶液B4作为监控,其中参比烟叶样品需和每批待测实际烟叶样品经过相同的样品前处理后进样检测,以用来监控样品前处理过程,而标准工作溶液B4经一次性制备好后密封备用,每批实际烟叶样品进样前取备用标准工作溶液进样检测,以监控仪器状态。表5为36天内251个实际烟叶样品和两种监控样品中有机酸含量测定值的相对标准偏差。由表5 可知,在实际样品测试期间,参比烟叶监控样品和标准工作溶液监控样品中各目标酸测定值的相对标准偏差均低于3%,进一步说明了优化后的方法稳健性好,适合长时间、大批量样品测试。而由251 个实际烟叶样品中有机酸测定值的相对标准偏差可知,丙二酸、苹果酸、柠檬酸在不同烟草样品中含量差异较大,是造成卷烟香型质量风格差异的重要有机酸类物质,文献也表明丙二酸、苹果酸、柠檬酸是区分浓香型烟叶和其它香型烟叶的关键指标[19];而十六酸、亚油酸、油酸+亚麻酸、十八酸和二十酸在烟叶样品中含量差异较小,说明高级脂肪酸类物质在不同类型烟叶样品中含量相对稳定。
3 结语
建立了一种简单、准确、稳定且适合大批量烟草样品中非挥发有机酸测试的样品处理方法。采用双内标校正提高烟草中有机酸甲酯化-气相色谱分析方法的稳定性。在甲酯化温度80 ℃、水浴120 min条件下,通过分液漏斗振荡方式,利用二氯甲烷和Na2HPO4/NaCl混合盐水溶液盐析萃取两次,测得的有机酸结果重复性好、精密度和回收率高,适合大批量烟叶样品测试。

